环核苷酸磷酸二酯酶PDE9A的体外表达、纯化与酶活特性分析
2020-10-27王郅媛李赤霞王友升
王郅媛, 李赤霞, 张 萌, 王友升,4,*
(1.北京工商大学 北京食品营养与人类健康高精尖创新中心/轻工科学技术学院, 北京 100048;2.北京科学仪器装备协作服务中心, 北京 100048;3.山东凯普菲特生物科技有限公司, 山东 日照 276800;4.日照华伟大健康产业研究院, 山东 日照 276800)
随着人们对健康食品的关注日益增加,筛选食品功能因子成为国内外的研究热点[1-2]。基于靶点导向的特定生物活性筛选是高通量开发食品功能因子的较为广泛的研究方法[3-4]。研究表明,环核苷酸磷酸二酯酶(phosphodiesterase,PDE)9A能催化体内环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)的水解[5],可作为筛选开发具有有效预防糖尿病[6]、心血管病[7]、贫血[8]及阿尔茨海默氏症[9-11]等功效的功能因子的新型靶点[12]。基于PDE9A靶点导向的生物活性物质高通量筛选的前提是获得高质量的PDE9A蛋白并对其酶学特性进行系统分析,但目前关于PDE9A体外表达及其酶学特性的报道较少。
研究将人源PDE9A(氨基酸残基181~506)重组质粒转化到大肠杆菌感受态细胞中,利用异丙基硫代半乳糖苷(isopropylβ-D-1-thiogalactopyranoside,IPTG)诱导PDE9A蛋白表达,采用不同纯化系统制备高纯度PDE9A,并对纯化的PDE9A蛋白进行酶活特性分析,以期可高通量筛选具有调节血糖等功能的天然活性物质,并为功能性食品的开发提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1菌体与质粒
Escherichiacoli感受态细胞BL21,本实验室保存;pET15b-PDE9A(氨基酸残基181~506),美国北卡莱罗纳大学教堂山分校柯衡明教授馈赠。
1.1.2实验试剂
DNA分子质量标准品Marker、10 x PCR buffer、标准蛋白质Marker,美国Thermo公司;乙二胺四乙酸钠(EDTA),北京西陇化工有限公司;三羟甲基氨基甲烷(Tris-Base)、 氨苄青霉素(ampicillin,AMP)、氯霉素,美国Sigma公司;IPTG、cGMP,美国Amoresco公司;蛋白胨、酵母浸粉,北京奥博星生物技术有限公司;氯化钠,国药集团;琼脂,北京博奥拓达科技有限公司。
1.2 仪器与设备
1.2.1实验仪器
French Press SL-650D型超声破碎仪,南京顺流仪器公司;层析实验冷柜,北京博医康实验仪器有限公司;JP61M/HV-85型高压灭菌锅,日本Hirayama公司;PHS-3D型pH计,上海仪表有限公司;Thermo Forma ClassⅡA2型净化工作台,美国Thermo公司;5810R型高速离心机,德国Eppendorf公司;1260型高效液相色谱仪,美国Agilent公司。
1.2.2蛋白纯化柱
30230型Ni-NTA agarose,德国Qiagen公司;17-0510-01型Q-SepharoseTMFast Flow、SephacrylTMS300,美国GE Healthcare Life公司。
1.3 实验方法
1.3.1重组pET15b-PDE9A质粒诱导表达
将pET15b-PDE9A质粒转化至E.coliBL21感受态细胞中37 ℃培养12~16 h。挑菌、接种到2xYT培养基中采用 IPTG低温(15 ℃)诱导表达[13]。诱导结束后在4 ℃、10 000 r/min条件下离心5 min集菌,并分别在诱导前和诱导结束后测定600 nm处的吸光度,按照等菌体量取样并进行SDS-PAGE检测。
1.3.2PDE9A蛋白纯化
1.3.2.1 菌体破碎
参考文献[14],表达菌体按照质量比1∶10加入提取液悬浮液并进行超声破碎(工作时间5 s,间歇时间5 s,共工作30 min)3次,分别对总蛋白质、上清液蛋白、沉淀蛋白进行SDS-PAGE检测[15]。
1.3.2.2 基于重组蛋白多重性质的分离纯化
上清液蛋白利用Ni-NAT琼脂糖树脂亲和柱纯化并在280 nm处测定纯化蛋白质的吸光度,将A280等于1定义为蛋白质质量浓度1 mg/mL,并进行SDS-PAGE检测[16]。Ni-NAT纯化收集溶液中加入牛凝血酶酶切1.5 h。10 000 r/min离心20 min后,将上清液蛋白溶液加入Q-Sepharose进行分离纯化和SDS-PAGE检测。Q-Sepharose纯化后的蛋白质经超滤浓缩至10 mL[17]。浓缩后的蛋白质加入Sephacryl S300中进行纯化,洗脱收集的PDE9A蛋白测定其280 nm处的吸光度并进行SDS-PAGE和Native-PAGE检测。将蛋白收集液超滤浓缩至10 mg/mL以上并冷冻保存[18]。
1.3.3PDE9A酶活力测定
PDE9A酶活测定参考Hou等[19]。反应体系为20 μmol/L cGMP底物、3.2 μg/mL PDE9A纯化蛋白和20 mmol/L Tris-HCl缓冲液(pH值8.0),30 ℃反应30 min后采用HPLC测定底物的含量,根据底物峰面积的减少量计算PDE9A蛋白的水解率。1 min内转化1 μmol cGMP所需要的酶量定义为1个酶活力单位(U),相对酶活力定义为各条件测得的蛋白水解率相对于最高水解率的百分比。每组实验做3次平行实验。
色谱检测条件:色谱柱Intertsil ODS-3(4.6 mm×250 mm,5 μm)。流动相A为0.02 mol/L KH2PO4,流动相B为甲醇,洗脱条件为体积分数82%A:18%B。检测波长252 nm,柱温30 ℃,流速1 mL/min,进样量20 μL[20]。
1.3.4最适反应温度的测定
按照1.3.3中的反应条件,分别在4、25、30、37、45、50、60、70 ℃下反应30 min后,测定其酶活力[21]。
1.3.5最适pH值的测定
配置不同pH值的缓冲液作为反应缓冲液(pH值为3.0、4.0、5.0的柠檬酸盐缓冲液,pH值为6.0、7.0的磷酸钠盐缓冲液、pH值为8.0、9.0的Tris-HCl缓冲液),缓冲液的浓度均为20 mmol/L。根据1.3.3的方法,在最适温度下反应30 min后测定PDE9A蛋白的酶活力[22]。
1.3.6Mg2+离子和DTT对酶活力的影响
在磷酸盐缓冲液(20 mmol/L,pH值7.0)、Tris-HCl缓冲液(20 mmol/L,pH值8.0)反应体系中分别添加10 mmol/L Mg2+和(或)1 mmol/L DTT,在最适温度下反应30 min后测定PDE9A的酶活力。
1.4 数据处理
SDS-PAGE电泳图应用Image软件进行分析,酶活特性测定数据采用SPSS和Origin软件进行数据分析。
2 结果与分析
2.1 pET15b- PDE9A质粒诱导表达分析
对诱导0 h和24 h的蛋白表达菌体进行SDS-PAGE检测,结果如图1。低温诱导培养可以减少包涵体的形成,促进可溶性蛋白的表达并维持蛋白质的稳定结构[23]。由图1可知,IPTG低温(15 ℃)诱导24 h后,出现一条明显的蛋白质条带,蛋白质条带的大小与PDE9A目的蛋白(约41 kDa)相近,由此可说明该诱导条件可增加PDE9A蛋白表达含量且平均1 L培养基可得到3.125 g外源表达菌体。

M:标准蛋白质Marker;1:诱导0 h;2:诱导24 h。图1 PDE9A蛋白不同诱导时间的SDS-PAGE结果Fig.1 SDS-PAGE results of PDE9A protein at different induction time
2.2 PDE9A蛋白的分离纯化分析
外源表达菌体破碎以及Ni-NAT、Q-Sepharose和Sephacryl S300分离纯化结果见图2。 从图2(a)可以看出,经过超声破碎后,上清液中的目的蛋白含量远高于沉淀中目的蛋白含量,说明此蛋白质水溶性较强,但仍形成少量的包涵体。经过Ni-NAT亲和层析纯化后,PDE9A蛋白纯度达到80%以上,说明PDE9A蛋白与Ni-NAT有较强的结合能力且PDE9A蛋白能够得到有效纯化(图2(b))。牛凝血酶可在1.5 h内有效切除蛋白质中的His-tag标签,且经过Q-Sepharose纯化目的蛋白的纯度达95%(图2(c))。浓缩蛋白加入Sephacryl S300进行进一步纯化,此时杂合蛋白的含量小于5%,证明Sephacryl S300分子筛纯化系统可以进一步去除杂蛋白,提高蛋白质的纯度(图2(d))。
PDE9A经过Sephacryl S300纯化后继续浓缩并检测蛋白质稳定性。Native-PAGE结果显示蛋白质基本没有凝聚现象,主蛋白质条带占80%以上,表明PDE9A蛋白在此分离纯化条件不易形成多聚体且维持较好的生物学活性,具有较强的稳定性(图2(e))。
纯化过程蛋白质回收率结果见表1。结果表明,Q-Sepharos纯化后蛋白质的回收率为36%,而Sephacryl S300纯化后蛋白质回收率为25%,说明Q-Sepharos纯化过程中损失大量蛋白质。经过Ni-NAT、Q-Sepharos和Sephacryl S300纯化后,最终1 g表达菌体可纯化获得8.9 mg蛋白质,证明该诱导条件能够获得大量的目的蛋白,并能经过多重纯化手段得到高纯度的蛋白质。

M:标准蛋白质Marker;1:超声破碎总蛋白;2:离心上清液蛋白;3:离心沉沉淀蛋白;N:Ni-NAT纯化;E:酶切1.5 h;Q:Q-Sephacrose纯化的蛋白质;S:Sephacryl S300纯化的蛋白质;N1:取样3 μL;N2:取样10 μL。图2 PDE9A蛋白的分离纯化凝胶电泳结果Fig.2 Electrophoresis results of PDE9A protein after different purification
2.3 PDE9A蛋白酶活性分析
利用HPLC检测体系测定不同质量浓度PDE9A蛋白对cGMP的水解情况,见表2。由表2可知,3.6 μg/mL PDE9A蛋白的水解率达77.27%,且酶活力达到7.76 U,说明低质量浓度PDE9A蛋白可以水解cGMP,具有较高生物活性。Rui等[24]纯化的PDE9A蛋白的EC50值为0.083 47 mg/mL,相比较而言,本实验表达以及纯化的蛋白酶活性更强。3.2 μg/mL的PDE9A蛋白可水解65%底物,因此该质量浓度可用于筛选具有PDE9A蛋白抑制作用的天然活性物质。

表1 PDE9A蛋白质纯化回收率

表2 不同含量PDE9A对cGMP水解情况
2.4 PDE9A蛋白最适反应温度分析
PDE9A蛋白的最适反应温度测定结果见图3。由图3可以看出,该酶的最适反应温度为37 ℃。30 ℃的相对酶活力为60%,45 ℃的相对酶活力为40%;而在低温4 ℃、高温50 ℃及以上相对酶活力降至20%以下。由此可以看出,PDE9A蛋白最适反应温度与人体正常温度相同,且其在25~45 ℃有较为广泛的作用温度范围,说明获得的PDE9A蛋白能够适应较为宽泛的反应温度。
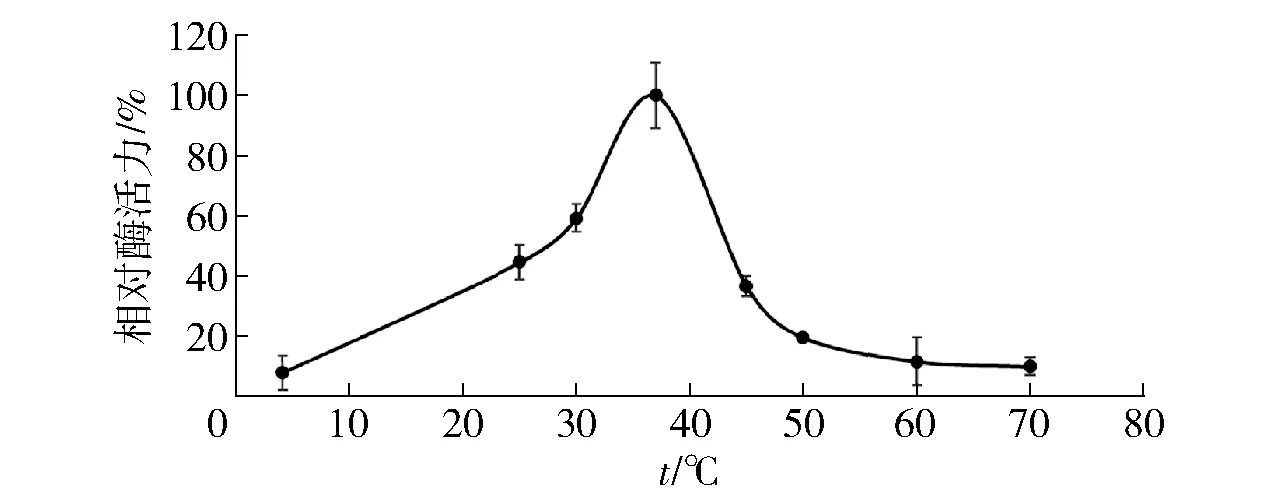
图3 PDE9A最适反应温度的测定Fig.3 Detection of optimum reaction temperature for PDE9A
2.5 PDE9A蛋白最适反应pH值分析
PDE9A蛋白在不同pH值反应缓冲液中的相对酶活力结果见图4。从图4可以看出,该酶的最适反应缓冲体系的pH值为7.0,在pH值6.0~9.0,相对酶活力均能达到50%以上。由此可知,获得的PDE9A蛋白更适合在碱性缓冲体系中发挥作用,这可能与人体的碱性环境有关,也证明该酶能够在较宽泛的pH值范围内发挥作用。

图4 PDE9A最适反应pH值的测定Fig.4 Detection of optimum reaction pH value for PDE9A

图5 Mg2+与DTT对PDE9A酶活力的影响Fig.5 Effects of magnesium ion and DTT on PDE9A enzyme activity
2.6 Mg2+和DTT对酶活力的影响分析
磷酸盐缓冲液(20 mmol/L,pH值7.0)和Tris-HCl缓冲液(20 mmol/L,pH值8.0)反应体系中Mg2+和DTT对PDE9A蛋白活性的影响见图5。DTT具有较强的还原能力和巯基激活能力,在Tris-HCl缓冲液反应体系中可将PDE9A蛋白相对酶活性提高16.8%,说明PDE9A蛋白中含有较多的半胱氨酸。金属离子是影响酶活性的重要因素之一,Fisher等[25]证明Mg2+、Mn2+和Ca2+均可提高PDE9A蛋白的酶活力。实验结果表明,Mg2+在Tris-HCl缓冲液中可将相对酶活力提高34.6%,与文献报道一致,但在磷酸盐缓冲液中无作用。在Tris-HCl缓冲液体系中,Mg2+和DTT共同作用可将相对酶活力提高71.8%,说明PDE9A具有一定的金属离子依赖性且活性中心可能有半胱氨酸,另外反应体系的缓冲液会影响Mg2+和DTT对蛋白质活性的调节。
3 结 论
本研究通过IPTG诱导,使PDE9A蛋白在大肠杆菌中大量异源表达,1 L培养基可获得3.125 g蛋白表达菌体。采用多种纯化手段对目的蛋白进行纯化,1 g表达菌体可纯化得到8.9 mg高纯度蛋白质。通过高效液相色谱技术检测,制备的PDE9A具有较高的催化活性。此外,Mg2+和DTT能够显著提高PDE9A活性,但反应体系的缓冲液会影响Mg2+和DTT对蛋白质活性的调节作用。本研究最终制备得到高纯度、高催化活性的PDE9A蛋白,可作为筛选具有调节血糖等功效的天然活性物质的靶点。
