热加工过程中植物源蛋白的糖基化作用研究进展
2020-10-27王娅娅王俊平
王 硕, 王娅娅, 王俊平, 张 燕, 董 璐
(1.南开大学 医学院/食品科学与健康天津市重点实验室, 天津 300371;2.天津科技大学 食品科学与工程学院/食品营养与安全国家重点实验室, 天津 300457)
受宗教信仰、个人喜好的影响,以及出于保护动物和对自身健康的考虑,素食者群体的数量在西方发达国家急剧增加;在许多不发达国家,动物蛋白是一种非常有限的资源[1],而植物源蛋白则可以满足人群的蛋白需求并防止蛋白能量营养不良[2]。有学者认为,将当前的饮食模式改为以植物为基础的饮食,不仅可以提高环境效益,也有益于人类健康。大量研究表明,用植物源蛋白质替代动物源蛋白质具有很多健康益处,例如,降低2型糖尿病、心血管疾病及癌症的风险[3-4]。有研究表明,从以肉食为主向以植物为主的饮食模式的转变可使全球死亡率降低6%~10%[5]。
在传统加工食品中,大豆和小麦是主要的植物蛋白质来源。在亚洲地区,大豆作为蛋白质食品历史悠久,并通过各种加工形式得到利用。几个世纪以来,亚洲人通过蒸煮、焙烤、研磨、发酵等多种加工方式,开发了各种大豆食品,包括豆腐、酱油、豆豉等。小麦面筋是在中国发明的一种重要的植物蛋白源食品,其历史可以追踪到公元6世纪[6]。小麦面筋是由小麦蛋白制成的,在生产面筋时,需要用水清洗小麦粉面团以除去所有的淀粉颗粒。面筋在结构上与肉制品相似,因此被称为面筋肉。面筋的一个独特特性是易于成型和加工,使其看起来像特殊的肉类产品,例如纯素食鸡翅和纯素食模拟鸭。面筋的独特结构和性质与麦谷蛋白的结构密切相关。小麦蛋白分为在水中可以提取的白蛋白、在盐溶液中可以提取的清蛋白、在乙醇溶液中可以提取的麦醇溶蛋白和不可在水或醇溶液中提取的麦谷蛋白。麦醇溶蛋白是以单体形式存在的,分子质量在30~60 kDa,而麦谷蛋白则是分子质量大约为80~20 000 kDa的聚集体[7]。麦谷蛋白约占小麦蛋白含量的35%~45%,对小麦制品的加工品质具有非常重要的作用,也是人类重要的植物膳食蛋白质来源,具有较高的营养价值。
热处理是最常用的加工方式,在食品加工中,热处理除了能实现一些功能性的效果,还能起到改善食品感官特性、灭菌消毒、延长货架期以保证食品安全质量的作用;在加热过程中由于其他食品成分的存在,还会产生一些化学反应,如糖基化反应、美拉德反应等[8]。在食品热加工中美拉德反应能够赋予食品风味物质、色泽,同时形成一系列高分子聚合物,其中一些反应产物是人们所期望的,包括反应过程中产生的风味物质。反应过程中也会形成健康危害物,如还原糖及美拉德中间产物与蛋白质及游离氨基酸的反应,不仅会造成氨基酸损失,还会产生晚期糖基化终末产物(advanced glycation end products, AGEs)。 已有研究表明,AGEs与糖尿病及其并发症息息相关[9-11]。α-二羰基化合物(α-dicarbonyl compounds,α-DCs)是热加工过程中糖类物质美拉德反应的一个非常重要的中间体,包括乙二醛(glyoxal, GO)、丙酮醛(methylglyoxal, MGO)、3-脱氧葡萄糖醛酮(3-deoxyglucosone, 3-DG)等,对人体具有很多潜在的危害性。 细胞实验表明,α-DCs具有细胞毒性,可诱导细胞凋亡,对神经细胞和噬铬细胞瘤细胞具有直接的致死作用。该类物质具有较强的反应活性,模拟生理条件下证明,α-DCs可对蛋白修饰生成高级糖化终端产物,也可对脂肪、 核糖核酸等进行修饰,损伤细胞结构和功能。在食品体系中,α-DCs由于极强的反应活性,可与食品中的氨基酸及蛋白质发生反应,造成食品中氨基酸的损失及蛋白质性质的改变[12]。明确食品热加工体系中还原糖和α-DCs引起的植物源蛋白质的糖基化对蛋白质结构的影响,是研究蛋白质营养、功能特性、生物利用性等方面的必要条件。
1 食品中主要的植物源蛋白结构及其营养特性研究
1.1 大豆蛋白结构及营养特性
大豆蛋白因其独特优势而深受消费者喜爱。大豆蛋白中包含所有必需氨基酸,并且其氨基酸组成平衡。除此之外,大豆蛋白还富含多种生理活性成分,可降低胆固醇并降低高脂血症和心血管疾病的风险。在食品加工中,大豆蛋白具有良好的可加工性能,例如胶凝特性、乳化能力、保水性和保油能力。
以干物质为基准,大豆中约含40%的蛋白质和20%的油脂。通过在较低温度下去除油脂,可以获得大豆分离蛋白(soy protein isolate, SPI)。另外,通过调整pH值至 4.5~4.8 ,可将大豆蛋白分离为球蛋白和乳清蛋白。酸沉淀部分主要包括大豆贮藏蛋白,其余部分由γ-伴大豆球蛋白、杂质蛋白以及乳清蛋白组成[13]。乳清蛋白由脂氧合酶、β-淀粉酶、凝集素和Kunitz胰蛋白酶抑制剂组成[14-16]。
1.1.1大豆蛋白的结构
SPI是多种蛋白质的混合物,根据其组成成分的沉降系数不同可分为2S、7S、11S和15S四个蛋白质类别,当溶液在离心力作用下,不同沉降系数的组分会以不同的重力沉降[17]。在这4种蛋白质中,7S(β-伴大豆球蛋白)和11S(大豆球蛋白)占80%以上,据报道,7S/11S的比例约为0.5~1.3(取决于品种)[18]。11S球蛋白是六聚体,由5个不同的亚基组成,每个亚基是由分子质量约为35 kDa的酸性亚基A和分子质量约为20 kDa的基本亚基B组成,蛋白质与其亚基通过二硫键连接。研究证实,A、B亚基通过静电作用和氢键结合形成空心圆柱体的两个六角环解耦[17,19]。另发现,不同pH值和离子强度下,11S球蛋白可分解为2S、3S或7S形式。大量研究工作分析了β-伴大豆球蛋白和大豆球蛋白的氨基酸组成,但是由于结晶困难,目前还没有相关三维结构的研究[20]。有研究已经通过X射线衍射研究了7S和11S的晶体结构[21-22],并且对先前提出的11S的图像进行了改进。他们提出,移动无序区域向三聚体一侧移动以及六聚体解离为三聚体的过程可能对蛋白酶较为敏感[21]。天然大豆球蛋白通过二硫键形成稳定的致密结构,因此其乳化和起泡能力低于缺乏二硫键的β-伴大豆球蛋白。
1.1.2大豆蛋白营养特性
豆制品中蛋白质含量高,而碳水化合物和脂肪含量低,易于消化,且在食品加工中用途广泛,因此有望成为未来健康饮食模式中的主食。大豆蛋白中含有9种必需氨基酸,可为食品加工和健康饮食提供许多益处。豆制品热加工过程中会破坏难以消化的胰蛋白酶抑制剂蛋白,因此,热处理可增加蛋白质的消化率,并增强大豆的营养品质[23]。大约38%的豆类主要由蛋白质组成,是植物蛋白质的重要来源。大豆成分可促进水分和风味的保留,还可以增强许多食品的质地。分离和浓缩的大豆蛋白都易于消化,并且与牛奶、肉制品和蛋类中的蛋白质质量相当。此外,几乎所有不含胆固醇的饮食都可以添加大豆蛋白。在食品添加剂行业,胶囊和片剂以及功能性食品越来越多地将大豆成分用于制造面包、薄脆饼干、早餐谷物、乳制品和饮料。与其他蛋白质产品相比,大豆蛋白质具有更多的优质蛋白质[24-25]。
1.2 麦谷蛋白结构及营养特性
小麦是我国居民的主要食物,麦谷蛋白是小麦的主要成分和人类主要的植物蛋白来源,同时也是小麦制品质构特性形成的主要物质,占小麦面筋蛋白的35%~45%。
1.2.1麦谷蛋白的结构
Shewry等[26]根据麦谷蛋白的迁移特性,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳,将麦谷蛋白亚基按照分子质量的不同分为高分子质量麦谷蛋白亚基(high-molecular-weight glutenin subunit,HMW-GS)和低分子质量麦谷蛋白亚基(low-molecular-weight glutenin subunit,LMW-GS)。HMW-GS含量较少,大约占总面筋蛋白的10%,分子质量范围在60~90 kDa。LMW-GS(30~70 kDa)约占面筋蛋白总量的20%,在麦谷蛋白中决定了面团的最大抗延伸性、流变学性能以及面制品品质,是起主导作用的亚基[27]。已有的研究表明,HMW-GS具有两种类型,分子质量较高的为x型,分子质量较低的为y型,如图1。两种不同类型的HMW-GS均具有典型的结构域,由相对较小的N末端和C末端结构域侧接主要中央结构域构成。C末端结构域由42个氨基酸残基组成,而N末端结构域的组成略有不同,大约包含80~100个氨基酸残基。相比较而言,中央结构域的长度具有多变性,大约包含600~850个氨基酸残基。大部分半胱氨酸残基均位于HMW-GS的末端附近。在一些亚基中,中心结构域中也存在半胱氨酸残基。α-螺旋为N末端和C末端结构域的主要二级结构。相反,中央结构域由富含谷氨酰胺、脯氨酸和甘氨酸的重复序列组成,这就产生一系列重叠的反向折叠结构,从而形成了以β-螺旋为主的超二级结构。一般认为,HMW-GS由于具有中央结构域的特定重复结构而形成刚性的棒状构象[26]。Shewry等[26]通过扫描隧道显微镜,小角度X射线散射和黏度分析研究了谷蛋白的形状和尺寸,并表明HMW-GS的长度约为50 nm,直径为1.8 nm。尽管LMW-GS的一级和二级结构与麦醇溶蛋白的一级和二级结构相似,但与麦醇溶蛋白不同的是,除了链内二硫键之外,LMW-GS还包含链间二硫键。圆二色光谱表明,LMW-GS的结构与α-麦醇溶蛋白和γ-麦醇溶蛋白的结构有相似之处。LMW-GS中的重复序列占整个蛋白质结构的30%,因此,麦谷蛋白具有清晰的双结构域结构。
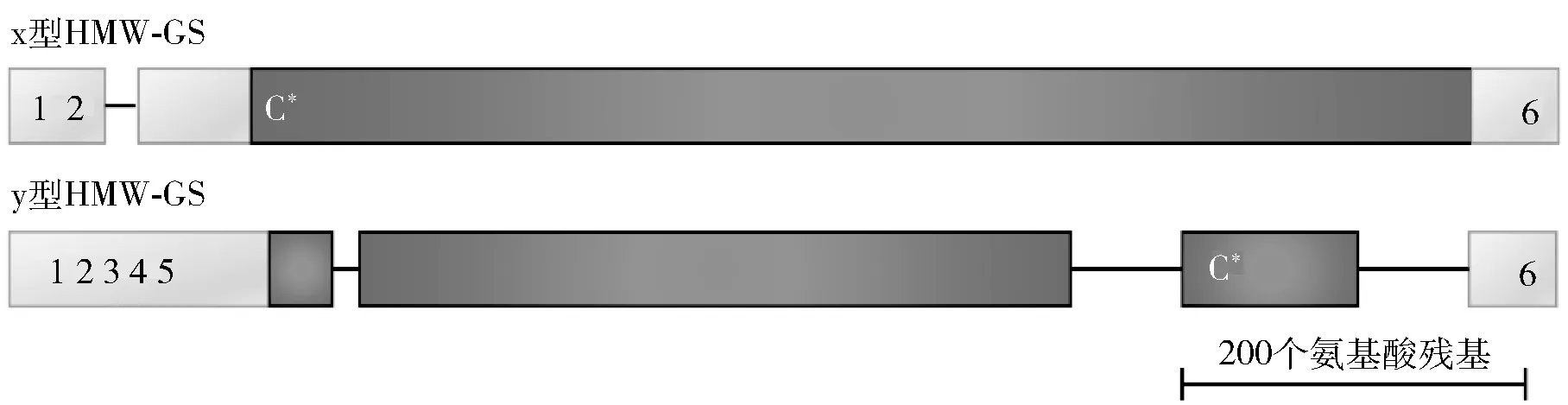
保守的半胱氨酸残基的位置用阿拉伯数字表示,其他不保守的半胱氨酸残基用C*表示。基于相似的多肽区域的氨基酸序列进行比对。图1 x型和y型HMW-GS的结构[12]Fig.1 Structures of x-type and y-type of HMW-GS[12]
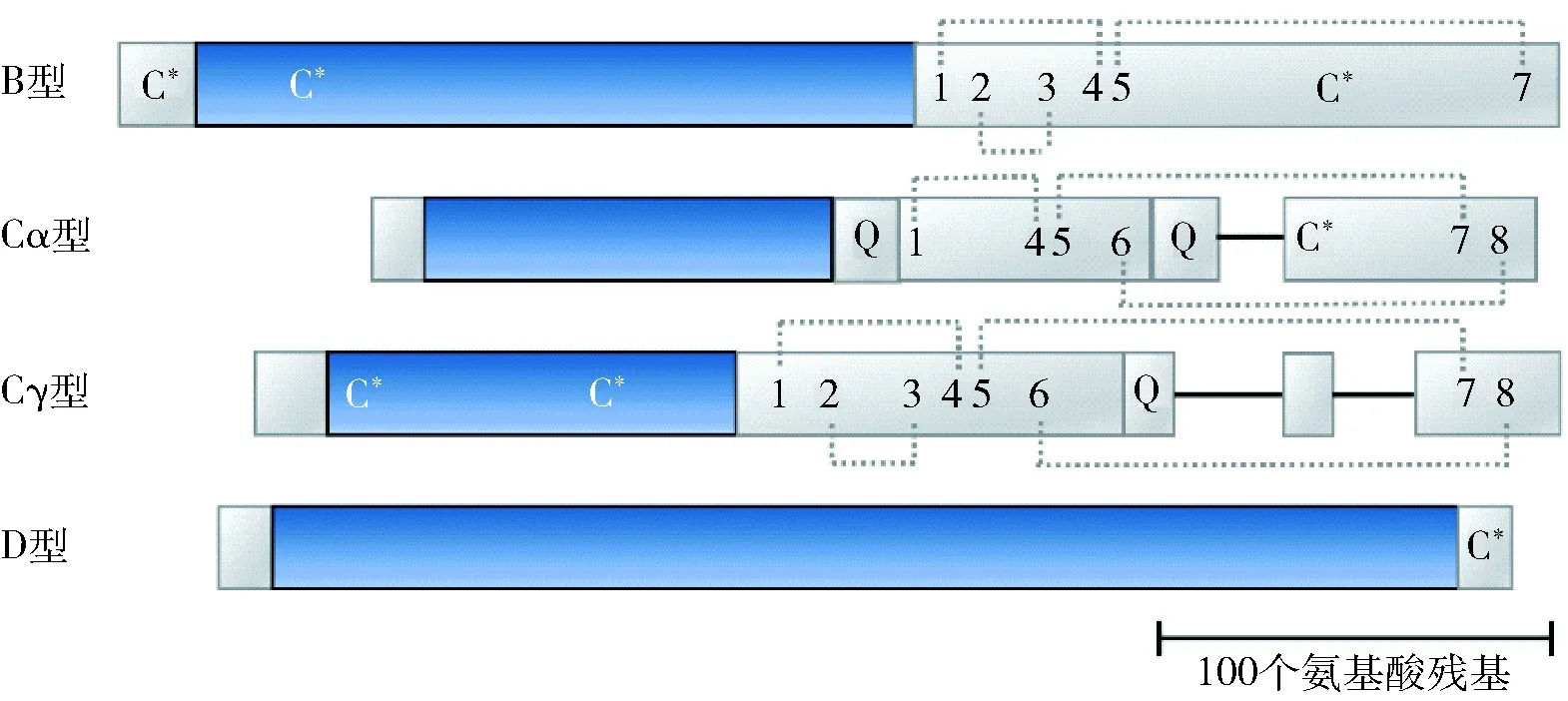
重复域用彩色表示,非重复域用白色表示;灰色虚线表示分子内二硫键;Q表示聚谷氨酰胺序列;阿拉伯数字表示保守的半胱氨酸残基的位置;C*表示其他不保守的半胱氨酸残基的位置。图2 B、C、D型LMW-GS的结构[26]Fig.2 Structures of B, C and D types of LMW-GS[12]
由于麦谷蛋白聚合物的分子质量超过20 000 kDa[28],而且其制备过程繁琐,因此准确确定麦谷蛋白聚合体的四级结构和分子质量分布比较困难,且由于缺乏合理的实验方法和确凿证据,目前关于其结构及分子质量的研究只停留在相关假设阶段。在Graveland等[29]提出的模型中,麦谷蛋白聚合体主链仅由HMW-GS组成,而LMW-GS以侧向连接的形式存在,HMW-GS和LMW-GS之间的二硫键增强了聚合体的结构,如图2。迄今为止,该领域能获得的所有实验结果大部分证实了该模型。除此之外,麦谷蛋白由于具有巨大的分子尺寸导致其在大多数溶剂中溶解性较差,这也限制了麦谷蛋白在食品工业中的应用及相关的研究。
1.2.2麦谷蛋白的营养特性
小麦是世界上消费最广泛的谷物之一,由于富含优质的碳水化合物(以淀粉的形式)和蛋白质,被作为常量营养素的主要来源。麦谷蛋白是小麦中的主要蛋白质,对人类生理健康能够产生有益或者不利的影响。例如,麦谷蛋白的某些氨基酸序列表现出抗高血压活性,但是,患有特定病症的个体摄入麦谷蛋白则会产生不良影响,其中,最常见的是乳糜泻(celiac disease,CD),也称为麸质敏感性肠病。CD是由小麦贮藏蛋白[30-31]消化产生的过敏原肽引起的。这些有利或不利的影响都归结于不同人体对麦谷蛋白消化作用的差异性。通常小麦是需要经过热处理(包括烘焙、挤压、烹饪等)才会被食用,所以目前对麦谷蛋白的消化特性研究主要集中在消化过程中的蛋白质的降解及加热处理对其消化作用的影响。众所周知,蛋白质的物理化学和生物学特性(包括抗原性)在加热后会发生变化,并且在消化过程中热处理会导致它们的降解程度增加或降低[32]。所有这些修饰都可以影响麦谷蛋白的消化产物的特性,并因此改变它们对人体生理状况的影响。关于热处理对小麦面粉蛋白质消化率的影响已经有些相关研究[33],所有这些研究均在体外模拟消化中进行,其中麦谷蛋白的消化率与水分活度和加热温度密切相关。食品加工会通过引起膳食蛋白质解折叠或聚集而改变其胃肠消化的敏感性,除此之外,膳食蛋白质与食物基质或食品中其他成分的相互作用同样会引起蛋白质结构改变从而引起蛋白质消化率的变化[34-35]。在小麦制品中,研究最多的是淀粉与小麦蛋白的相互作用及小麦中的蛋白质对淀粉消化率的影响[36]。麦谷蛋白引发免疫介导的食物不良反应方面具有重要作用,但很少有关于食品基质对小麦蛋白质的模拟胃肠消化性影响的研究。烘焙改变了谷物蛋白的免疫学和生理化学特性[37],经过烘焙的麦谷蛋白似乎不易消化,但由于实验所用到的模拟消化的方法不同,使得麦谷蛋白的消化性研究比较困难。就我们所知,目前没有关于α-DCs对小麦面粉蛋白质消化性影响的数据。
2 参与植物源蛋白质糖基化反应的活性羰基化合物研究
单糖(葡萄糖和果糖)、还原性二糖(麦芽糖和乳糖)、寡糖都参与食品中蛋白质的糖基化反应[38]。通过糖蛋白、糖脂、植物糖苷或非还原性二糖(如蔗糖)中糖苷键连接的糖只能在糖苷键裂解后才能参与蛋白质的糖基化[39]。葡萄糖是最常见的还原糖,也是研究最多的羰基前体化合物[39]。碳水化合物经过热处理形成的美拉德反应的某些中间体会进一步加速反应。美拉德反应中的糖被降解从而导致α-DCs的产生,例如2-己糖、MGO和GO[40]。已有学者从美拉德反应混合物中分离出了几种源自单糖、二糖(如麦芽糖或乳糖)的α-DCs,但关于它们在实际食品基质中具体含量的报道较少[41]。这些二羰基化合物是由游离氨基酸形成重要风味化合物的主要前体。二羰基化合物对蛋白质的反应性很高,可导致形成蛋白质结合的氨基酸衍生物[42]。
2.1 食品中的α-DCs
α-DCs是食品中风味物质主要的前体物,然而,在食品热加工过程中α-DCs会修饰食品中的蛋白质,导致其营养质量下降,并有可能产生有毒化合物,因而食品热加工过程中α-DCs及其修饰产物受到广泛关注。作为中间产物,α-DCs在食品加工过程中很容易形成。食品加工过程中的α-DCs主要通过焦糖化反应、美拉德反应和脂质氧化形成[43-44]。MGO、3-DG、GO和二乙酰(diacetyl,DA)等都是由美拉德反应或糖酵解过程中产生的主要α-DCs[45-46]。这些α-DCs广泛存在于常见的食品中,如饮料、蜂蜜、乳制品、果酱和烘焙食品,并且α-DCs的含量在食品的热处理过程会随着加工条件的改变而增加[47]。据报道,将牛奶进行超高温处理后,MGO质量浓度从低于0.3 mg/L增加到约2.5 mg/L[48]。将红花油、乳酪、黄油或人造黄油加热处理后(在100 ℃和200 ℃下加热1 h),DA的质量分数从低于13.9 mg/kg增加到约28.7 mg/kg[49-50]。这些研究表明,食品在加工和储存中α-DCs大量形成,因此,这些化合物的营养和健康意义需要进一步关注和研究。
2.2 食品中α-DCs的产生机理及含量
食品热加工过程中形成的α-DCs种类繁多,其中MGO和GO是最广泛、反应活性最强的α-DCs。在食品加工和储藏过程中,MGO主要通过糖自动氧化、美拉德反应、脂质降解以及微生物发酵来产生。在糖自动氧化过程,MGO通过糖降解过程中的逆醛醇缩合形成,氧分子在这个过程中起重要作用。该过程主要发生在含有大量碳水化合物,特别是含有大量单糖的食品中。单糖来源的MGO的含量高于二糖来源的MGO的量[45],葡萄糖产生的MGO含量高于果糖产生的MGO含量。具有高含量葡萄糖和果糖的蜂蜜在加工和储存条件下的加热过程中通过糖降解形成MGO,蜂蜜中MGO的质量分数为0.8~33.0 mg/kg[51]。含有大量果葡糖浆的商业饮料中MGO的质量浓度为23.5~139.5 μg/100 mL[52]。咖啡作为受欢迎的饮料之一,也因其中含有大量MGO和GO而受到广泛研究。Hollnagel等[53]测试了4种类型的黑咖啡,其中浓缩咖啡中MGO的含量最高,质量浓度为230.9 μmol/L,其次是浓咖啡,这是由于焙烤过程中的美拉德反应影响了咖啡豆中MGO的含量。Marceau等[54]研究表明,当绿豆在210 ℃下烘烤20 min时,GO含量在前6 min增加,在6 min时达到峰值,质量分数为(13.07 ± 0.39) mg/100 g,然后在20 min时缓慢降至(1.93 ± 0.05) mg/100 g。MGO变化规律与GO相似,在烘烤10 min后质量分数达到最大值[(21.19 ± 0.42) mg/100 g],随后下降。脂质中MGO的积累是由加工和储存过程中的脂质降解引起的。Lo等[55]将鱼油(金枪鱼、鳕鱼肝和鲑鱼油)在60 ℃加热7 d,结果形成的MGO质量分数为2.03~0.13 mg/kg至2.89~0.11 mg/kg,在相同条件下的植物油(大豆、橄榄油和玉米油)中,只有橄榄油产生MGO(0.03~0.61 mg/kg)。在发酵过程中,微生物将MGO释放到食品中,最常见的是酒精饮料和乳制品,其中,白兰地、醋和葡萄酒中MGO的质量分数分别为1.9、35.0、10.0 mg/kg[56]。
3 热加工过程中植物源蛋白的糖基化修饰作用研究
还原糖及α-DCs可与膳食蛋白质的精氨酸和赖氨酸残基的侧链反应,导致其结构发生变化,并生成晚期糖基化终末产物。GO是Nε-羧甲基赖氨酸、乙二醛氢咪唑酮和乙二醛赖氨酸二聚体的前体,而MGO是Nε-羧乙基赖氨酸、氢咪唑酮和甲基乙二醛赖氨酸二聚体的前体[49,57]。
3.1 大豆蛋白的糖基化修饰作用
大豆蛋白和还原糖是非常重要的食品组分,因而被广泛应用于现代食品加工过程中,而热加工过程中食物组分间会发生复杂的反应,特别是以美拉德反应为基础的糖基化反应。Achouri等[58]研究了葡萄糖对11S大豆球蛋白糖基化修饰作用,结果表明,经过葡萄糖糖化修饰的11S大豆球蛋白溶解性、表面疏水性均显著提高;Li等[59]研究了葡萄糖对SPI糖基化修饰作用,结果表明,葡萄糖糖化修饰的SPI溶解性和乳化特性显著提高。Bu等[60]研究了葡萄糖、乳糖、半乳糖、麦芽糖对大豆7Sβ-伴球蛋白的糖基化修饰作用,分别比较各种糖对大豆7Sβ-伴球蛋白结构及功能特性的影响,利用SDS-PAGE电泳和圆二色谱分析大豆蛋白糖基化后一级和二级结构的变化,结果表明,经过糖化修饰的7Sβ-伴球蛋白亚基数量减少,蛋白质分子质量增大,表明糖化修饰导致蛋白质发生分子聚集;Li等[61]研究了SPI的乳糖基化修饰作用,结果表明,经过乳糖修饰的SPI乳化性和乳化稳定性均有显著提高;并利用SDS-PAGE电泳分析大豆蛋白糖基化后结构的变化,发现糖化蛋白亚基分子质量增大,表明糖基化过程中蛋白结构发生变化,导致蛋白质发生聚集。目前对于大豆蛋白糖基化的研究大多集中在试图通过糖基化修饰改变其加工特性,很少有研究关注食品热加工条件对大豆蛋白糖基化的影响。对于大豆蛋白糖基化的修饰作用,大多数研究都侧重于其二级结构的变化,对于糖基化引起的大豆蛋白变化研究较少。
3.2 麦谷蛋白的糖基化修饰作用
小麦粉中除了麦谷蛋白还有大量淀粉、小部分可溶性糖及脂肪,在热加工时这些组分会参与到美拉德反应中,生成与食品风味、颜色、口感等品质相关物质,同时也会产生丙烯酰胺等热加工有害物。在小麦制品中,谷蛋白、淀粉及糖是美拉德反应的主要参与者,三者之间的复杂反应关系一直是食品加工领域研究的重点。Wen等[62]研究了不同热加工条件下淀粉与小麦面筋蛋白的相互作用及对面筋蛋白结构和消化性的影响,结果表明,在小麦面筋蛋白热加工过程中加入淀粉能够提高小麦面筋蛋白的消化性能;对小麦面筋蛋白进行结构分析表明,淀粉提高小麦面筋蛋白消化性能的机理是,淀粉的加入可以避免小麦面筋蛋白因疏水作用发生的热聚集,并在加热过程中通过溶胀、凝胶化对蛋白质的空间结构进行破坏,使蛋白质水合程度增加,暴露更多的酶切位点与消化酶相互作用,从而实现小麦面筋蛋白消化性能的提高。Wang等[63]研究了热加工过程中MGO对麦谷蛋白的修饰作用及消化性的影响,结果表明,热加工过程中 MGO 修饰可导致麦谷蛋白发生交联和聚集,较高加热温度下存在美拉德反应介导的蛋白质氧化现象;进一步分析可知,麦谷蛋白消化率的变化与其结构变化紧密相关,推测麦谷蛋白表面疏水性的降低和二硫键的增加可引起 MGO-麦谷蛋白消化性的降低。MGO诱导的羰基氧化导致麦谷蛋白分子间产生的交联和聚集,使蛋白酶的酶切位点逐渐被掩蔽甚至破坏,也是导致麦谷蛋白消化率降低的重要原因。由于麦谷蛋白提取和纯化困难,并且难溶于水,对于糖基化引起的麦谷蛋白结构的研究并不充分,目前,很少有文献报道糖基化修饰对麦谷蛋白氨基酸序列的影响。
4 结论与展望
普遍认为,食品热加工过程中由美拉德反应介导的蛋白质糖基化会导致蛋白质结构改变,降低蛋白质的营养价值甚至产生一些健康危害物。近几年,大量文献报道了由葡萄糖及美拉德反应的中间产物α-DCs对蛋白质的修饰作用,然而,大部分研究都是针对肉制品及牛乳制品中蛋白质的糖基化修饰作用,对植物源蛋白质的糖化修饰作用深入研究较少。大豆蛋白是优质的植物源蛋白,在过去十几年,大量研究通过糖基化修饰来改善大豆蛋白的功能特性,忽略了食品热加工过程中糖基化引起的大豆蛋白结构及营养特性的变化。麦谷蛋白对小麦加工品质和营养具有重要决定作用。目前,麦谷蛋白的修饰作用研究主要集中在利用侧链氨基酸的反应活性进行修饰,例如通过乙酰化、琥珀酰化、糖基化、酰胺化、烷基化、共价键、磷酸化和脱酰胺化对蛋白质进行化学改性,而对热加工过程中糖基化引起的结构变化研究较少。除此之外,由于麦谷蛋白结构复杂、难以分离并且在水中的溶解度极低,限制了人们对热加工过程中α-DCs对麦谷蛋白结构修饰的研究。植物源蛋白质在日常饮食中具有非常重要的地位,热加工作为豆制品和小麦制品最常见的加工方式,加工条件(加工方式、加工温度、加工时间、水分活度、体系pH值等)对大豆蛋白质和麦谷蛋白的糖基化具有重要影响。因此,后续应系统研究不同食品加工条件对大豆蛋白及麦谷蛋白糖基化的影响,为通过控制食品加工条件减少植物源蛋白热加工危害物控制技术提供理论依据。
