纤维铜配合物催化苯乙炔与邻碘苯甲酸选择性合成异香豆素和苯酞
2020-10-13董旭辉陆思雨吴之传
董旭辉,陆思雨,高 薇,吴之传*
(1.安徽省功能配合物材料化学与应用重点实验室,安徽 芜湖 241000; 2.安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
异香豆素和苯酞都属于天然内酯类化合物,其衍生物都表现出重要的生物活性和药理活性,在抗肿瘤[1-2]以及抗病毒药[3-4]等药物的研究和生产中被广泛应用。区域选择性的控制对于天然产物和生物活性分子的合成方法的经济性和多样性具有重要的意义[5],在传统的异香豆素的合成方法中,由过渡金属催化的2-炔基苯甲酸酯的亲电环化反应和邻卤苯甲酸与炔烃的偶联环化反应应用最为广泛[6-7]。这类反应通常具有5-exo-dig和6-endo-dig两种环化途径,可分别获得苯酞和异香豆素两种产物。但是,在反应过程中两种环化途径往往同时发生,具有区域选择性低和难以控制的问题。
Bellina[8]等报道了Ag/Ag+催化2-炔基苯甲酸甲酯区域选择性合成苯酞和异香豆素的方法。Wang[9]等发表了CuI与L-脯氨酸共催化末端炔烃和邻卤苯甲酸合成异香豆素及其衍生物的报道。Liu[10]等报道了一种Pd催化的邻碘苯甲酸与酰胺基炔烃环化合成异香豆素的方法。也有直接对苯甲酸邻位C-H活化和氧化环化合成异香豆素的方法被报道[11-12]。然而,这类方法大部分除了使用Ag、Pd和Rh等贵金属作为催化剂之外,通常具有底物范围有限和区域选择性低等缺陷。
因此,开发一种高效高区域选择性的合成方法对这类反应具有重要的意义。以羟胺改性的聚丙烯腈纤维负载二价铜离子制备得到的铜纤维配合物(Cu(Ⅱ)-AOFs)作为催化剂,催化苯乙炔衍生物与邻碘苯甲酸的偶联环化反应,与大多数已见报道的以CuI作为催化剂催化该类反应的合成方法相比[13-15],Cu(Ⅱ)-AOFs具有更高的催化活性和区域选择性,且反应对环境要求相对更低,无需添加复杂有毒的配体,通过工艺条件优化和底物拓展实验以较高的收率选择性合成含不同取代基的异香豆素类化合物和苯酞类化合物。催化剂的制备简单廉价,且因反应在非均相体系中进行,催化剂可回收处理后重复利用。
1 实验部分
1.1 试剂与仪器
聚丙烯腈纤维(中国石化安庆分公司,AR);盐酸羟胺、氯化钠、溴化铜、碳酸钾、氢氧化钾、氢氧化钠、无水硫酸镁、碳酸铯(国药,AR);N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、乙腈、二甲亚砜、三乙胺、邻碘苯甲酸、5-氟2-碘苯甲酸、2-氟6-碘苯甲酸、2-碘3-甲基苯甲酸、苯乙炔、4-甲氧基苯乙炔、4-甲基苯乙炔、4-乙基苯乙炔、4-正丙基苯乙炔、4-丁基苯乙炔、4-戊基苯乙炔、2-氟苯乙炔、4-氟苯乙炔、3-Cl-苯乙炔、3-乙炔基吡啶(阿拉丁试剂,AR);乙酸乙酯、石油醚(上海泰坦科技股份有限公司)。
真空干燥箱(DZF-6053,上海一恒科学仪器有限工司);电热鼓风干燥箱(GZX-9240MBE,上海博讯实业有限公司医疗设备厂);集热式恒温加热磁力搅拌器(DF-101S,巩义市予华仪器有限公司);旋转蒸发仪(RE-2000B,南京大卫仪器设备有限公司)。
1.2 实验步骤
(1)催化剂的制备。称取0.017 9 g溴化铜,溶解于10 mL的蒸馏水中,取0.1 g AOFs加入配制好的溴化铜溶液中,在40 ℃下反应0.5 h后,取出纤维,用蒸馏水重复洗涤2~3次,干燥处理后即得到铜纤维配合物Cu(Ⅱ)-AOFs[16]。具体步骤如图1所示。

图1 Cu(Ⅱ)-AOFs纤维铜配合催化剂的制备
(2)Cu(Ⅱ)-AOFs催化苯乙炔与邻碘苯甲酸的偶联环化反应。异香豆素的合成:在N2气氛下,依次向25 mL的圆底烧瓶中加入苯乙炔(1 mmol)、邻碘苯甲酸(1.1 mmol)、催化剂Cu(Ⅱ)-AOFs(8 mol%,0.1 g)、碱NaOH(2 mmol)以及溶剂DMF(4 mL),90 ℃下搅拌回流4 h。
苯酞的合成:在N2气氛下,依次向25 mL的圆底烧瓶中加入苯乙炔(1 mmol)、邻碘苯甲酸(1.1 mmol)、催化剂Cu(Ⅱ)-AOFs(8 mol%,0.1 g)、碱Cs2CO3(2 mmol)以及溶剂DMF(4 mL),在40℃下搅拌回流6 h。具体反应过程如图2所示。

图2 Cu(Ⅱ)-AOFs催化苯乙炔与邻碘苯甲酸的环化反应
反应过程中通过TLC点板跟踪反应进程,观察到反应完全结束后,将催化剂取出,洗涤干燥以备重复使用。反应液经萃取,旋蒸,得到粗产物,再通过柱层析,以石油醚为洗脱剂分离提纯,得到纯化产物,将其放入真空干燥箱中真空干燥12h。得到的产物通过核磁共振氢谱进行了表征,并对核磁谱图进行了分析,确定了产物的分子结构。
(3)催化剂的重复使用性能探究。在最优工艺条件下使用Cu(Ⅱ)-AOFs催化苯乙炔与邻碘苯甲酸的环化反应,反应结束后,对催化剂进行回收,投入到下一次条件相同的环化反应中,如此重复多次使用,直至催化剂催化性能降低或明显消失。
(4)产物的表征。通过核磁共振谱仪(Bruker AVABCE Ⅲ 400,德国布鲁克公司)进行核磁共振分析最终得到的产物,表征测试以CDCl3作为溶剂,TMS作为化学位移内标,得到的核磁氢谱数据使用 MestReNova软件进行图谱分析,最终确定产物分子结构。
2 结果与讨论
2.1 反应条件的优化
以邻碘苯甲酸和苯乙炔作为基本底物对环化反应的工艺条件进行了优化,结果如表1所示。
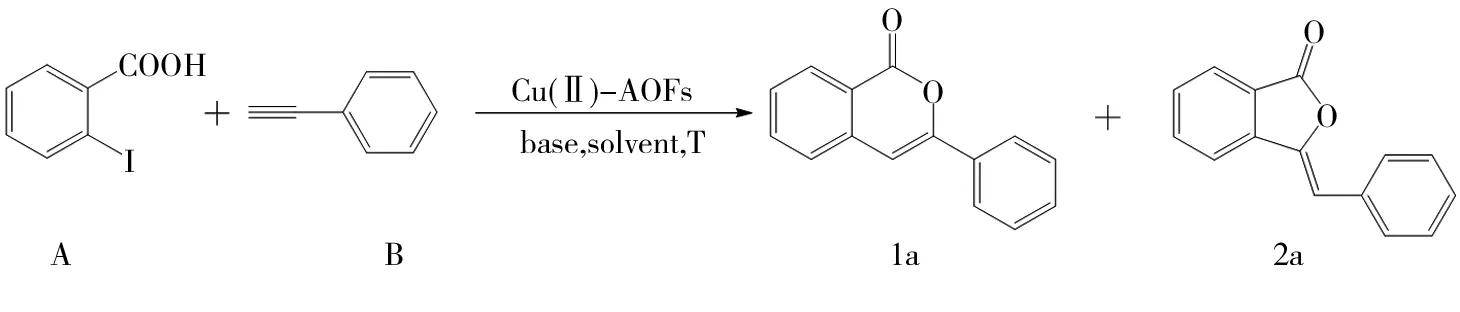
表1 不同条件对反应的影响

EntryCatalyst BaseSolventT/℃t/hYield/%Ratio of 1a/2a1CuBr2NaOHDMF9047391/92CuINaOHDMF9048580/203Cu(Ⅱ)-AOFsNaOHDMF90493>99/04Cu(Ⅱ)-AOFsCs2CO3DMF9049495/55Cu(Ⅱ)-AOFsK2CO3DMF9047385/156Cu(Ⅱ)-AOFsKOHDMF9048188/127Cu(Ⅱ)-AOFsEt3NDMF9042879/218Cu(Ⅱ)-AOFsCs2CO3DMF406950/>999Cu(Ⅱ)-AOFsNaOHDMF4068920/8010Cu(Ⅱ)-AOFsNaOHDMSO9048398/211Cu(Ⅱ)-AOFsNaOHDMAc9042594/612Cu(Ⅱ)-AOFsNaOHCH3CN9043192/813Cu(Ⅱ)-AOFsNaOHDMSO406883/9713Cu(Ⅱ)-AOFsCs2CO3DMSO90483>99/015Cu(Ⅱ)-AOFsCs2CO3DMSO406883/9716Cu(Ⅱ)-AOFsCs2CO3DMF258730/>9917Cu(Ⅱ)-AOFsCs2CO3DMF8059186/1418Cu(Ⅱ)-AOFsNaOHDMF2587720/8019Cu(Ⅱ)-AOFsNaOHDMF8058998/2
根据表1中数据可以看出,Cu(Ⅱ)-AOFs作为催化剂与CuBr2和CuI相比,在相同条件下催化环化反应具有更好的催化效果和区域选择性,而且在不同的反应温度下,选用不同的碱试剂对反应的环化路径也有着明显的影响。在相对较高的温度下,反应更倾向于发生六元环化反应生成异香豆素产物(1a),而在相对较低的温度下,反应更易发生五元环化反应生成苯酞产物(2a)。随后在尝试了不同的碱试剂后,成功控制了反应的环化路径,即在N2气氛下,以Cu(Ⅱ)-AOFs(8 mol%,0.1 g)作为催化剂,苯乙炔(1 mmol)、邻碘苯甲酸(1.1 mmol)、DMF(4 mL)、NaOH(2 mmol)在90 ℃下反应4 h,以93%的收率合成了1a;使用Cs2CO3(2 mmol)代替NaOH作为碱试剂,在40 ℃下反应6 h,以95%的收率合成了2a。
2.2 不同取代基对反应的影响
(1)探究不同取代基对合成异香豆素环化反应的影响。选取不同取代基的苯乙炔衍生物和邻碘苯甲酸衍生物作为反应底物,在最佳条件下进行环化反应,考察了不同给电子、吸电子取代基对催化剂催化效率和区域选择性的影响,实验结果如图3所示。由图3可以看出,当苯环上对位的取代基为甲基等给电子基时,催化剂依然具有很好的催化效果;当间对位为F等吸电子基时,产率有所降低,反应过程中无苯酞类化合物产生,表现了优异的区域选择性。
(2)探究不同取代基对合成苯酞反应的影响。选择不同取代基的底物衍生物在合成苯酞的最佳条件下进行环化反应,实验结果如图4所示。由图4可以看出,在合成苯酞的环化反应中,催化剂对不同给电子基和吸电子基都具有很好的适应性,且反应中无异香豆素类化合物生成,表现出了优异的区域选择性。
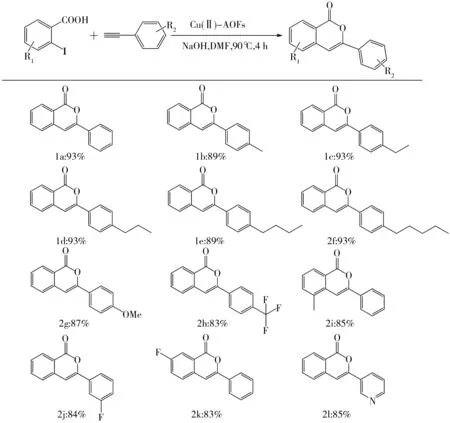
图3 不同取代基对合成异香豆素反应的影响
图4 不同取代基对合成苯酞反应的影响
2.3 产物的核磁表征
对产物的核磁氢谱数据进行分析,异香豆素类化合物以1a为例,化学位移为δ=8.33(d,J=8.2 Hz,1H)的单氢是苯环上与羰基相邻碳上的氢,化学位移为δ=6.98(s,1H)的单氢是氧环中双键碳上的氢,其余位置的氢为苯环上的氢。苯酞类化合物以2a为例,化学位移为δ=7.97(d,J =7.7 Hz,1H)的单氢是苯环上与羰基相邻碳上的氢,化学位移为δ=6.46(s,1H)的单氢是双键碳上的氢,其余位置的氢为苯环上的氢。
1a:3-Phenyl-1H-isochromen-1-one.
1H NMR(400 MHz,CDCl3)δ 8.33(d,J=8.2 Hz,1H),8.04~7.85(m,2H),7.74(t,J=6.9 Hz,1H),7.63~7.38(m,5H),6.98(s,1H).

1b:3-p-Tolyl-1H-isochromen-1-one.
1H NMR(400 MHz,CDCl3)δ 8.32(d,J=8.2 Hz,1H),7.80(d,J=8.3 Hz,2H),7.73(t,J=7.6 Hz,1H),7.50(dd,J=9.2,5.1 Hz,2H),7.32~7.26(m,2H),6.93(s,1H),2.43(s,3H).
1c:3-(4-Ethylphenyl)-1H-isochromen-1-one.
1H NMR(400 MHz,CDCl3)δ 8.31(d,J=8.5 Hz,1H),7.82(d,J=10.2 Hz,2H),7.72(t,J=7.6 Hz,1H),7.49(t,J=7.7 Hz,2H),7.30(d,J=12.1 Hz,2H),6.92(s,1H),2.82~2.56(m,2H),1.29(t,J=7.6 Hz,3H).
1d:3-(4-N-propylphenyl)-1H-isochromen-1-one.
1H NMR(400 MHz,CDCl3)δ 8.31(d,J=8.5 Hz,1H),7.81(d,J=8.4 Hz,2H),7.71(t,J=7.6 Hz,1H),7.48(t,J=6.8 Hz,2H),7.37~7.17(m,2H),6.92(s,1H),2.81~2.52(m,2H),1.69(t,J=11.3 Hz,2H),0.98(t,J=7.3 Hz,3H).
1e:3-(4-Butylphenyl)-1H-isochromen-1-one .
1H NMR(400 MHz,CDCl3)δ 8.32(d,J=8.4 Hz,1H),7.82(d,J=8.4 Hz,2H),7.73(td,J=7.4,1.3 Hz,1H),7.56~7.45(m,2H),7.32~7.28(m,2H),6.93(s,1H),2.90~2.49(m,2H),1.75~1.58(m,2H),1.40(dq,J=14.6,7.3 Hz,2H),0.97(t,J=7.3 Hz,3H).
1f:3-(4-Amylphenyl)-1H-isochromen-1-one.
1H NMR(400 MHz,CDCl3)δ 8.33(d,J=7.4 Hz,1H),7.88~7.80(m,2H),7.73(td,J=7.8,1.3 Hz,1H),7.55~7.47(m,2H),7.34~7.28(m,2H),6.94(s,1H),2.75~2.64(m,2H),1.71~1.64(m,2H),1.36(t,J=5.5 Hz,4H),0.93(t,J=7.0 Hz,3H).
1g:3-(4-Methoxyphenyl)-1H-isochromen-1-one.
1H NMR(400 MHz,CDCl3)δ 8.31(d,J=8.3 Hz,1H),7.86(d,J=11.9 Hz,2H),7.77~7.64(m,1H),7.49(t,J=7.7 Hz,2H),7.00(d,J=9.8 Hz,2H),6.86(s,1H),3.89(s,3H).
1h:3-(4-Trifluoromethylphenyl)-1H-isochromen-1-one.
1H NMR(400 MHz,CDCl3)δ 8.37(d,J=8.0 Hz,1H),7.99(d,J=7.7 Hz,1H),7.92~7.70(m,3H),7.64(dd,J=13.6,6.7 Hz,2H),7.43(t,J=7.6 Hz,1H),6.79(s,1H).
1i:5-methyl-3-phenyl-1H-isochromen-1-one.
1H NMR(400 MHz,CDCl3)δ 8.20(d,J=7.9 Hz,1H),7.93(d,J=8.0 Hz,2H),7.58(d,J=7.3 Hz,1H),7.53~7.45(m,3H),7.41(t,J=7.7 Hz,1H),7.09(s,1H),2.58(s,3H).
1j:3-(3-fluorophenyl)-1H-isochromen-1-one.
1H NMR(400 MHz,CDCl3)δ 8.35(d,J=7.9 Hz,1H),7.83~7.73(m,1H),7.70(d,J=9.2 Hz,1H),7.58(dd,J=27.6,8.9 Hz,3H),7.51~7.39(m,1H),7.16(dd,J=9.2,6.7 Hz,1H),7.00(s,1H).
1k:7-Fluoro-3-phenyl-1H-isochromen-1-one.
1H NMR(400 MHz,CDCl3)δ 7.97(dd,J=8.5,2.6 Hz,1H),7.87(dd,J=8.0,1.6 Hz,2H),7.58~7.43(m,5H),6.96(s,1H).
1l:3-(Pyridine-3-yl)-1H-isochromen-1-one.
1H NMR(400 MHz,CDCl3)δ 8.35(dd,J=7.9,1.5 Hz,1H),7.98(d,J=7.7 Hz,1H),7.89(d,J=7.8 Hz,1H),7.79(dd,J=11.6,4.4 Hz,1H),7.62(t,J=7.2 Hz,1H),7.46(d,J=8.0 Hz,1H),7.37(t,J=7.1 Hz,1H),7.31~7.26(m,1H),6.94(s,1H).
2a:(Z)-3-Benzylideneisobenzofuran-1(3H)-one.
1H NMR(400 MHz,CDCl3)δ 7.97(d,J=7.7 Hz,1H),7.88(d,J=7.6 Hz,2H),7.85~7.72(m,2H),7.58(t,J=7.1 Hz,1H),7.44(t,J=7.6 Hz,2H),7.35(t,J=7.4 Hz,1H),6.46(s,1H).

2b:(Z)-3-(4-Methoxybenzylidene)isobenzofuran-1(3H)-one.
1H NMR(400 MHz,CDCl3)δ 7.95(d,J=7.7 Hz,1H),7.84(d,J=8.8 Hz,2H),7.80~7.69(m,2H),7.54(t,J=6.7 Hz,1H),6.98(t,J=6.0 Hz,2H),6.41(s,1H),3.86(d,J=14.9 Hz,3H).
2c:(Z)-3-(4-Ethylbenzylidene)isobenzofuran-1(3H)-one.
1H NMR(400 MHz,CDCl3)δ 7.92(d,J=7.7 Hz,1H),7.78(d,J=8.2 Hz,2H),7.75~7.67(m,2H),7.52(t,J=7.3 Hz,1H),7.31~7.22(m,2H),6.40(s,1H),2.73~2.67(m,2H),1.29(d,J=7.6 Hz,3H).
2d:(Z)-3-(4-N-propylbenzylidene)isobenzofuran-1(3H)-one.
1H NMR(400 MHz,CDCl3)δ 7.95(d,J=7.7 Hz,1H),7.82~7.76(m,3H),7.73(t,J=7.5 Hz,1H),7.55(t,J=7.4 Hz,1H),7.25(d,J=8.1 Hz,2H),6.43(s,1H),2.67~2.61(m,2H),1.69(dd,J=15.1,7.5 Hz,2H),0.98(t,J=7.3 Hz,3H).
2e:(Z)-3-(4-Butylbenzylidene)isobenzofuran-1(3H)-one.
1H NMR(400 MHz,CDCl3)δ 7.96(d,J=7.7 Hz,1H),7.80(d,J=8.4 Hz,3H),7.74(t,J=7.0 Hz,1H),7.56(t,J=7.4 Hz,1H),7.29~7.22(m,2H),6.44(s,1H),2.70~2.62(m,2H),1.68~1.60(m,2H),1.40(t,J=11.2 Hz,2H),0.96(d,J=5.7 Hz,3H).
2f:(Z)-3-(2-Fluorobenzylidene)isobenzofuran-1(3H)-one.
1H NMR(400 MHz,CDCl3)δ 8.41~8.29(m,1H),7.97(d,J=7.7 Hz,1H),7.85(d,J=7.9 Hz,1H),7.77(dd,J=9.7,5.4 Hz,1H),7.60(t,J=7.5 Hz,1H),7.34~7.29(m,1H),7.28~7.22(m,1H),7.18~7.07(m,1H),6.75(s,1H).
2g:(Z)-3-benzylidene-7-fluoroisobenzofuran-1(3H)-one.
1H NMR(400 MHz,CDCl3)δ 7.85(d,J=8.6 Hz,2H),7.72(td,J=8.0,4.6 Hz,1H),7.58(d,J=7.7 Hz,1H),7.49~7.39(m,2H),7.39~7.32(m,1H),7.18(t,J=8.4 Hz,1H),6.48(s,1H).
2h:(Z)-3-(4-Fluorobenzylidene)isobenzofuran-1(3H)-one.
1H NMR(400 MHz,CDCl3)δ 7.99(d,J=7.7 Hz,1H),7.79(dt,J=14.8,7.3 Hz,2H),7.62(dd,J=20.1,9.5 Hz,3H),7.40(dd,J=14.1,8.0 Hz,1H),7.05(t,J=8.7 Hz,1H),6.42(s,1H).
2.4 Cu(Ⅱ)-AOFs催化剂的重复使用性能研究
在确定最佳的工艺条件之后,进一步探究了Cu(Ⅱ)-AOFs 催化剂的重复使用性能, 在最佳条件下,反应结束后经抽滤操作,取出反应后的催化剂,经乙酸乙酯和蒸馏水反复洗涤数次后干燥处理,用作下一次反应的催化剂,不断重复,直至催化性能消失或明显降低时即可,通过每一次催化得到的产率评估催化剂的重复使用性能。Cu(Ⅱ)-AOFs 催化剂的重复使用性能如图5所示。由图5可以看出,Cu(Ⅱ)-AOFs 催化剂在重复使用3次之后仍然具有良好的催化效果,但是随着使用次数增加,催化效果有着不同幅度的下降,可能是由于纤维上的铜离子逐渐脱落,导致了催化效率的降低。

图5 Cu(Ⅱ)-AOFs 催化剂的重复使用性能
3 结论
研究使用Cu(Ⅱ)-AOFs作为催化剂催化苯乙炔与邻碘苯甲酸的环化反应。实验结果表明,Cu(Ⅱ)-AOFs 作为催化剂具有优异的催化性能,无需添加任何其他配体,通过控制反应条件,高效高区域选择性地合成了异香豆素类化合物和苯酞类化合物,具有良好的底物适应性,且催化剂制备简单易回收,重复使用3次之后依然具有较好的催化效果。该类反应具有很好的工业应用前景。
