钌负载型二氧化铈纳米棒对水中Hg(Ⅱ)的电化学检测性能研究
2020-10-13李静静孙宇峰
李静静,孙宇峰
(安徽工程大学 机械与汽车工程学院,安徽 芜湖 241000)
正如其他微污染物一样,重金属污染物也会对人体健康[1]和环境产生很大影响。重金属污染物是公认的高毒性、生物累积性和抗降解性的污染物之一[2]。随着化工行业的发展,重金属污染物给数亿人带来了巨大的风险。众所周知,离子在生命中起着重要的作用,然而重金属离子的高毒性对人体健康和环境构成了严重威胁。其中,像Hg(Ⅱ)这样的重金属离子对大多数生物的毒性最大[3]。汞毒性的主要来源是饮用水中不稳定的Hg(Ⅱ)形式的无机汞污染。摄入浓度很低的Hg(Ⅱ)都会扰乱大脑、肾脏、免疫系统和神经系统[4]。因此,对于环境中Hg(Ⅱ)的现场、实时、高灵敏度监测是至关重要的。近年来,电感耦合等离子体质谱法(ICP-MS)、荧光光谱法、原子发射光谱法(AES)等[5-7]方法被广泛应用于各种样品基体中重金属污染物的检测。然而,上述方法存在无法进行原位化学形态测量、需熟练的操作/维护人员等问题。相比之下,电化学分析方法因具有检测速度快、灵敏度高、操作简单、选择性好等优点而得以广泛应用[8]。
许多纳米材料因具有较大的比表面积而对重金属离子(HMIs)表现出优异的吸附能力,而且制备工艺简单方便[9];另外,很多纳米材料因形貌的不同而具有不同的暴露晶面,从而导致对HMIs的氧化还原性能不同[10]。这些特性使它们非常适合作为电化学分析中工作电极的修饰材料。然而,纳米材料(例如二氧化钛、二氧化锡、氧化锆等)电催化活性的不理想性限制了大多数纳米材料在电化学检测中的应用。因此,如何提高纳米材料在电化学检测过程中的灵敏度是近年来科学家们研究的热点。不同材料(金属、合金和金属氧化物)所暴露的平面及表面缺陷对各种催化反应有相当大的贡献[11-12]。通过科学的选择并设计具有特定形貌的纳米材料作为电极修饰材料,可以在很大程度上提高对HMIs的电化学检测效果。
二氧化铈(CeO2)纳米材料的形貌对暴露的晶面有深远的影响。在纳米尺度上对氧化铈材料的形貌进行细致的控制,已被证明是提高氧化铈材料在许多氧化反应中催化活性的有效策略。CeO2纳米材料的高能量平面如(100)和(110)的选择性暴露有利于晶格氧空位的形成,从而增加氧的迁移率[13];由(111)和(100)小平面包裹的二氧化铈棒表现出最高浓度的氧空位簇(VCs),它的存在促进了分子氧的吸附[14];纳米材料的形貌控制也会有效地影响其电化学性能。到目前为止,已经制备出各种形貌的CeO2[15],其形貌主要有纳米棒、纳米立方体、纳米八面体等几种。其中CeO2纳米棒由于其独特的结构,如新颖的尺寸效应、增强的动力学等,引起了人们极大的兴趣,成为纳米器件和传感器的重要组成部分。计算机模拟研究表明,CeO2纳米材料低指数(111)面表面能最低,是稳定性最好的晶面,其次是(110)面,而(100)、(210)和(310)面表面能较高。平面表面能与它们的氧化反应活性间接相关。因此,反应性较强的是表面(100),其次是(110)表面,能够促进氧空位的形成,且在较低的温度下表现出更强的储氧能力和更高的还原能力。实验结果还表明,(100)和(110)表面也促进了晶格氧从体到表面[16]的迁移。因此,铈的还原性从大到依次为:棒状、粒子、立方体。此外,CeO2纳米棒表面由于其封闭的(110)和(100)晶面即{110}面而具有较高浓度的氧空位,从而表现出较高的催化活性[17]。例如:Wu[18]等研究了表面平面清晰的CeO2纳米材料对CO氧化反应的活性,从大到小依次为:纳米棒、纳米立方体、纳米八面体;Wang[19]等研究了CeO2对2-氰基吡啶直接合成DMC形貌的影响,发现CeO2纳米棒由于具有高密度的缺陷位点和酸碱位点,其活性较高。近年来,CeO2纳米材料因Ce3+和Ce4+间的快速转换而显示出更好的应用前景,CeO2纳米棒表面存在丰富的缺陷,主要是氧空位或Ce3+,被作为多相催化的活性位点[20]。此外,研究表明,钌(Ru)基催化剂因具有很强的活性和稳定性而被广泛应用于电化学、催化析氢、氨分解等催化领域[21]。例如:Chen[22]等采用经Ba改性的Ru-MgZrO2催化剂,通过控制催化剂的碱度,实现了催化活性高、皂化率低的无氢异构化反应。Wang[23]等通过将孤立的Ru原子和Ru纳米颗粒掺杂到Pt 3 Mn纳米管的表层(Pt 3 Mn-Ru CNCs)以构建一种结构稳定的催化剂。研究结果表明,与Pt 3 Mn@Ru CNCs和纯Pt 3 Mn CNCs相比,Pt 3 Mn-Ru CNCs对乙二醇氧化反应的催化活性、耐久性和CO抗中毒能力最佳。Muhler[24]等证明了Ru催化剂在氧化介质中的催化活性高于Pt、Rh和Pd。而且,由于CeO2独特的电子结构使得Ru与CeO2之间产生一种强烈的金属-支撑物的相互作用,从而促使Ru更加稳定。在此基础上,研究了Ru/CeO2纳米棒在电化学检测Hg(Ⅱ)中的催化效果。
通过简单的水热法制备了主要暴露面为{110}面、富含氧空位的CeO2纳米棒,并通过水浴加热法在其表面负载Ru纳米粒子。用TEM、XPS、XRD、FT-IR、EPR对其进行结构、化学特性表征。此外,将其用于水中Hg(Ⅱ)的检测,获得了较高的检测灵敏度,研究了其检测机理;并通过XPS研究了其对多种重金属离子吸附性能的特点,同时也对其在实际水样中的检测研究做了详细分析。
1 实验部分
1.1 实验试剂
研究所涉及的试剂均属于分析级,可直接用于材料合成。六水合硝酸铈(Ce(NO3)3·6H2O)(99%,萨恩化学技术有限公司);氢氧化钠(96%)、无水氯化钌(98%)、六氨基己酸(99%,阿拉丁试剂有限公司);硼氢化钠(96%,国药控股集团);电阻率为18.25 MΩ的超纯水;纯度为97%的乙醇;氨水-氯化铵(NH3H2O-NH4Cl)(将0.1 M的氨水、氯化铵溶液按比例配制)、磷酸(PBS)(将0.1 M的磷酸二氢钾、磷酸二氢钠按配比制得)、醋酸-醋酸钠(HAC-NaAC)(将0.1 M的醋酸、醋酸钠缓冲液按固定配比制得)缓冲液;通过将一定浓度的铅、铜硝酸盐溶液、八水合硫酸镉、氯化汞溶液溶解在所需体积的超纯水中得到不同浓度的Pb(Ⅱ)、Cu(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)溶液。
1.2 实验仪器
采用扫描电镜(SEM)和高分辨透射电镜(HRTEM)(JEM-2010,JEOL)观察CeO2纳米棒和Ru/CeO2(纳米棒)的形貌和结构特征,并通过EDS明确材料中Ru纳米粒子的含量。利用X射线衍射(XRD)确定材料的物相组成。采用X射线光电子能谱(XPS)(美国Thermo-VG Scientific)分析材料元素组成及含量。采用电子顺磁共振(EPR)(JES-FA200,JEOL)分析材料的化学信息。借助红外(FT-IR)光谱仪(美国Nicolet仪器公司Magna-IR750)研究材料表面官能团的分布。
1.3 二氧化铈纳米棒、钌负载型二氧化铈纳米棒的合成
(1)二氧化铈纳米棒的合成。通过水热法制备CeO2纳米棒[25]。首先,将1.736 mg的Ce(NO3)3·6H2O和19.2 mg的NaOH分别溶解在含有10 mL、70 mL的超纯水的烧杯中,在剧烈搅拌下得到完全溶解的Ce(NO3)3·6H2O和NaOH溶液。然后将Ce(NO3)3·6H2O溶液均匀滴加到剧烈搅拌的NaOH溶液中,并持续搅拌1 h。反应完全后,得到浅紫色悬浊液。再将上述溶液转移到高压反应釜中,并在100 ℃下反应24 h。待温度降至室温后取出,产物为浅紫色絮状沉淀。将产物取出,用去离子水、酒精分别洗4~5次并以6 000 rmp转速离心,得到白色沉淀物。然后在真空干燥箱中干燥12 h,最终产物为CeO2纳米棒淡黄色粉末。
(2)钌负载型二氧化铈纳米棒的合成。采用水浴加热法合成钌负载型二氧化铈(Ru/CeO2)纳米棒[26]。取100 mg CeO2纳米棒粉末溶解在7 mL的超纯水中,然后在上述溶液中分别加入28 mg的RuCl3和34 mg 6-氨基己酸(AHA),待完全溶解后,将其在剧烈搅拌下加热至90 ℃。再将溶解在3 mL超纯水中的30 mg NaBH4粉末所获得的NaBH4溶液逐滴加到上述反应溶液中。之后将混合物在强烈搅拌、90 ℃下保持3 h,待反应结束后冷却至室温。最后,将产物用水和丙酮离心洗6~9次,并经冷冻干燥8 h后得到Ru/CeO2(纳米棒)样品。
1.4 修饰电极的制备
在修饰裸玻碳电极(GCE)之前,先用氧化铝粉(0.3 μM,0.05 μM)抛光,之后用1∶1的HNO3、酒精、超纯水洗15 s,最后在N2气氛下干燥。然后从制备好的电化学样品(将1 mg的Ru/CeO2纳米棒粉末分散于1 mL的超纯水中,并超声处理10 mins后形成悬浮液)中取5 μL滴加到上述准备好的GCE表面,然后在室温下静置24 h,最后制得Ru/CeO2(纳米棒)修饰电极。同样,根据上述方法制备CeO2纳米棒修饰电极。
1.5 电化学实验
电化学实验所使用的仪器是“CHI 660D计算机控制电位计”(陈华,上海,中国)。在优化之后的实验参数下,用方波阳极溶出伏安法实现对HMIs的检测。将NH3·H2O-NH4Cl (pH 5.0)作为实验用缓冲液,设定工作电极的吸附电位为-1.0 V,搅拌时间为120 s。将Hg(Ⅱ)的阳极剥离电位范围设为-0.1~0.55 V。最后,将解吸附时间确定为120 s,解吸电位设定为0.8 V。
1.6 吸附实验
在“水浴恒温振动仪”(SHZ-82A)中进行吸附实验。首先,将10 mg的Ru/CeO2(纳米棒)分散在含有6 mL的NH3·H2O-NH4Cl (pH 5.0)(0.1 M)电解质溶液和浓度均为1 mM的1 mL Hg(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)混合溶液中。然后将上述溶液在水浴恒温振动仪中摇24 h (200 rpm)。待实验结束后,取出样品并以5 000 rpm转速离心1 min,最后放在冷冻干燥机中干燥。将得到的吸附样品进行XPS测试并分析吸附结果。
2 结果与讨论
2.1 二氧化铈纳米棒、钌负载型二氧化铈纳米棒的形貌和结构
通过水热法合成的CeO2纳米棒及Ru/CeO2(纳米棒)的SEM和HR-TEM图如图1所示。由图1a可知,均相CeO2纳米棒的直径平均约为13 nm。由图1c可知,HR-TEM图像显示了排列良好的晶体平面,表明了CeO2纳米棒的单晶结构性质。图1c中所显示的约0.31 nm的平面间距被认为是(111)面。因此,所制备的CeO2纳米棒是一个包含{110}和{111}切面的棒状结构,而且在Z轴方向被(100)和(001)面截断。由图1b、图1d可知,在CeO2纳米棒表面均匀地分散着粒径约为5 nm的Ru纳米粒子,且Ru纳米粒子与CeO2纳米棒的晶格条纹界面清晰,表明Ru在其表面属于物理生长。

图1 CeO2纳米棒、Ru/CeO2(纳米棒)的SEM和HR-TEM图
为明晰所合成的CeO2纳米棒和Ru/CeO2(纳米棒)的物相结构,通过XRD分别对其进行了表征,结果如图2a所示。从XRD图谱中得到了合成样品的晶相纯度和结构信息,可以清晰地观察到所有的衍射峰均与CeO2立方萤石结构(JCPDS 43-1002)相对应。CeO2的XRD峰分别为28.54°、33.08°、47.48°、56.33°、59.08°、69.69°和79.06°,2θ分别对应着(111)、(200)、(220)、(311)、(222)、(400)、(331)和(420)晶面[27],而且并无其他杂质峰,说明成功合成了CeO2纳米棒。很明显,通过XRD图谱的对比发现,负载有Ru纳米粒子的CeO2纳米棒的特征衍射峰并未发生变化。这一观察结果表明,Ce在Ru3+还原后仍保持完整;换句话说,晶格中并未发生变化。同时,Ru纳米粒子对应的峰值也并未被检测到,这一结果很可能是Ru负载量较低而导致的[28]。

图2 CeO2纳米棒和Ru/CeO2(纳米棒)的XRD和FT-IR图
为进一步探究CeO2纳米棒和Ru/CeO2纳米棒表面的微观信息,还进行了红外(FT-IR)表征,如图2b所示。FTIR谱显示出在3 430.076 nm-1和1 630.036 nm-1处有明显的-OH拉伸振动,表明存在氧空位;同时,-OH的存在有利于对HMIs的吸附[29]。在1 180 nm-1和1 384.30 nm-1处有弯曲振动,为CeO2振动模式(Ce-O-Ce)峰[30]。
2.2 二氧化铈纳米棒、钌负载型二氧化铈纳米棒修饰后电极的电化学表征及实验条件优化
通过循环伏安法(CV)和电化学阻抗法(EIS)分别对CeO2纳米棒、二氧化铈纳米棒(Ru/CeO2(纳米棒))进行了表征。实验在含有0.1 M KCl的5 mM Fe(CN)63-/4-中进行。裸玻碳、CeO2纳米棒和Ru/CeO2(纳米棒)的CV和EIS图如图3所示。由图3可知,通过比较两种材料的CV、EIS可以发现,钌负载后材料的CV的电流值显著升高;而Ru/CeO2(纳米棒)纳米复合材料的EIS值明显降低。表明当CeO2纳米棒表面负载有Ru后,材料的导电性显著增强。
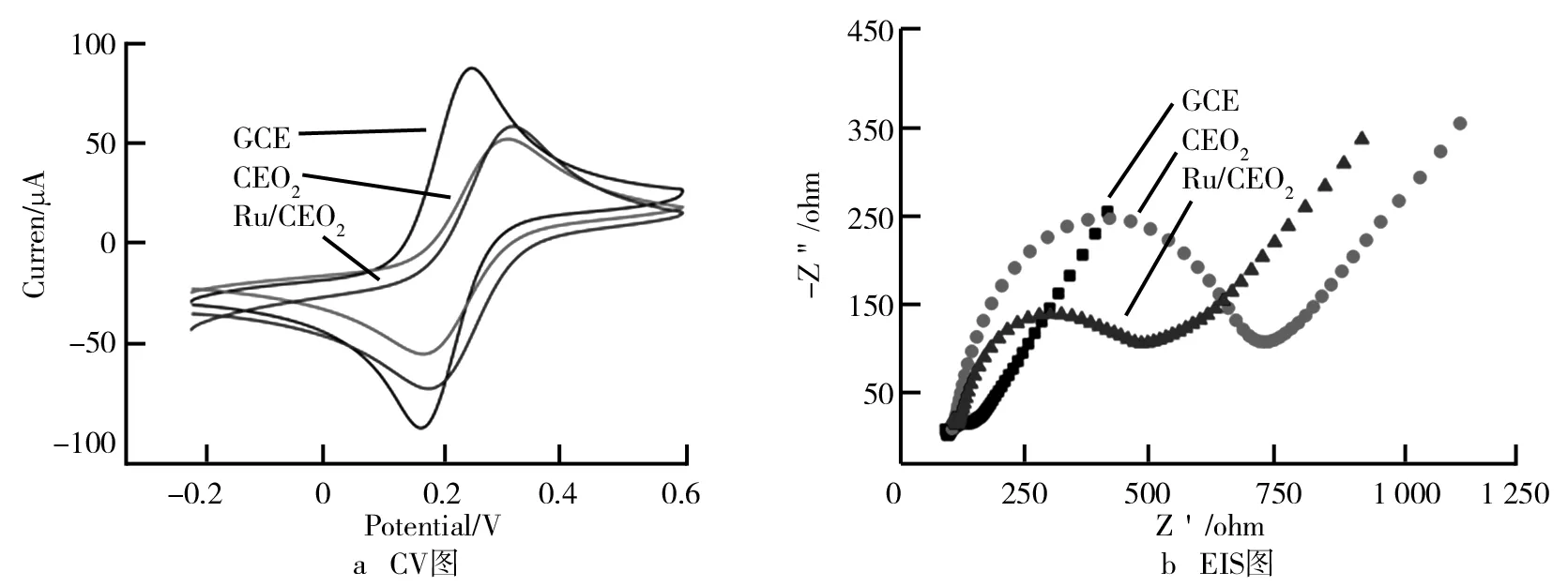
图3 裸玻碳、CeO2纳米棒和Ru/CeO2(纳米棒)的CV和EIS图
另外,对裸玻碳(GCE)、CeO2纳米棒、Ru/CeO2(纳米棒)纳米复合材料的电活性面积分别在0.1 M KCl 的5 mM Fe(CN)63-/4-中进行了表征,结果如图4所示。由图4可见,经钌负载型CeO2纳米棒修饰后的电极活性面积较CeO2纳米棒增大。经带入公式(ip=2.69×105n3/2ACD1/2v1/2)计算得到三者活性面积分别为0.061 3 cm2、0.044 7 cm2、0.051 1 cm2。由此表明,Ru/CeO2(纳米棒)相比CeO2纳米棒的电活性面积较大,能提供较大的吸附表面和较多的活性位点。

图4 裸玻碳、CeO2纳米棒和Ru/CeO2(纳米棒)的CV以及EIS图
对实验参数(电解质、pH值、沉积电位和时间)的优化是电化学检测HMIs必不可少的。为研究缓冲液对电化学检测HMIs的影响,对其展开了仔细的实验探究(见图5a)。用SWASV分别在0.1 M的PBS、NH3·H2O-NH4Cl、HAc-NaAc三种缓冲液中检测Hg(Ⅱ)(0.4 μM)。结果发现在NH3·H2O-NH4Cl中溶出峰现象较为明显,因此将NH3·H2O-NH4Cl选定为实验用电解质。由图5b可知,pH对实验结果也有很大影响,pH值为5.0时,Hg(Ⅱ)的溶出信号最强。另外,沉积电位也是值得探究的一个因素。由图5c可知,当沉积电位从-0.7 V逐步降为-1.2 V时,电流响应出现先增大后降低现象,这种现象发生的原因是当电位过低时,材料表面会析氢,从而阻断电极表面HMIs氧化还原的进行。因此,沉积电位为-1.0 V较合适。除以上条件外,沉积时间也是影响电化学实验的重要因素,因此将其从80 s增加到140 s,结果显示(见图5d),Hg(Ⅱ)的溶出峰强度先逐步增大后趋于平稳,为提高实验效率,最终将沉积时间定为120 s。在优化好的实验条件下,采用SWASV进行水中的Hg(Ⅱ)的研究。
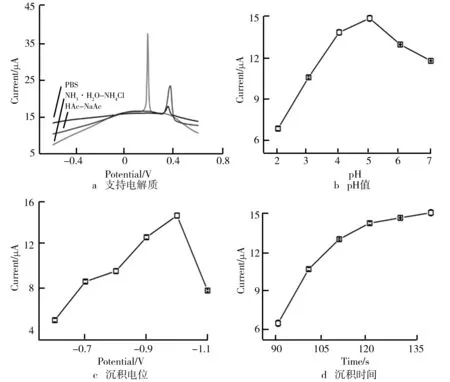
图5 通过SWASV用Ru/CeO2/GCE电极检测Hg(Ⅱ)的条件优化
2.3 电化学检测重金属离子
在相同的实验条件下(0.1 M NH3H2O-NH4Cl,pH 5.0,-1.0 V,120 s),利用SWASV将CeO2纳米棒、Ru/CeO2(纳米棒)运用于Hg(Ⅱ)的检测,结果如图6所示。由图6可知,在沉积电位约为0.17 V处出现Hg(Ⅱ)较明显的溶出峰。经计算得出CeO2纳米棒、Ru/CeO2(纳米棒)单位面积上对于Hg(Ⅱ)的检测灵敏度分别为663 μA·μM-1·cm-2和1 655 μA·μM-1·cm-2,检测限分别是0.025 μM和0.02 μM。表明Ru/CeO2(纳米棒)对Hg(Ⅱ)的响应较CeO2纳米棒好,且检测限相对较低,远低于世界卫生组织设立的饮用水安全标准(0.03 μM)。

图6 CeO2/GCE和Ru/CeO2/GCE对Hg(Ⅱ)的线性SWASV图以及灵敏度和LOD对比图
同样,对于其他重金属离子的特异性检测也在同样条件下(0.1 M NH3H2O-NH4Cl,pH 5.0,1.0 V,120 s)进行。图7为Ru/CeO2(纳米棒)用于检测Pb(Ⅱ)、Cd(Ⅱ)的SWASV响应曲线和线性方程。显然,材料对于Pb(Ⅱ)、Cd(Ⅱ)的灵敏度较低,但线性较好,其单位面积的检测灵敏度分别为588.47 μA·μM-1·cm-2、404.37 μA·μM-1·cm-2,即材料对Pb(Ⅱ)、Cd(Ⅱ)的敏感性远远低于Hg(Ⅱ)。说明Ru/CeO2(纳米棒)对Pb(Ⅱ)、Cd(Ⅱ)虽然表现出一定的剥离行为但远不如Hg(Ⅱ)强。对于材料对不同HMIs的不同电化学响应机理尚不明确,后续将通过吸附实验对其展开进一步研究。
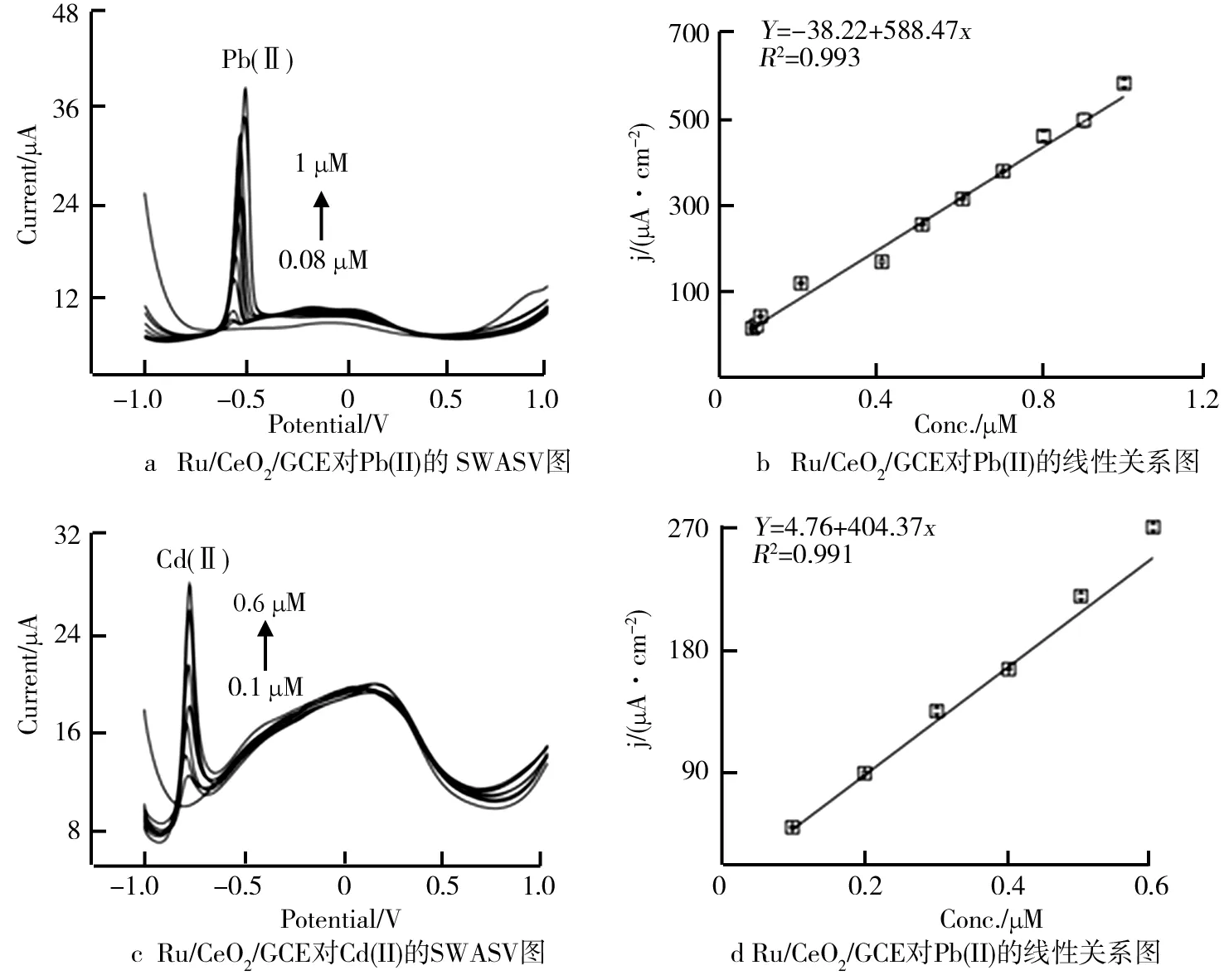
图7 Ru/CeO2/GCE分别对Pb(Ⅱ)、Cd(Ⅱ)的SWASV图以及线性关系图
2.4 电化学检测机理
电化学检测HMIs的过程即其在电极表面发生氧化还原反应的总过程,利用SWASV对Hg(Ⅱ)的电化学分析过程如图8所示。图8中显示了Hg(Ⅱ)在电极材料表面的存在情况,即Hg(Ⅱ)的氧化还原反应:①Hg(Ⅱ)与Ru纳米粒子发生作用;②Hg(Ⅱ)扩散到电极表面而被还原氧化;③Hg(Ⅱ)扩散到氧空位存在处,被其提供的活性位点催化发生氧化还原。Hg(Ⅱ)在Ru/CeO2/GCE表面的氧化还原包括以下途径:首先,在电极材料或玻碳电极的吸附能力,或通过电极修饰材料表面存在的活性位点间的相互作用、氧空位存在的条件下,对工作电极施加恒定电压,将溶液中的Hg(Ⅱ)富集在电极表面。当电极电势超过某种离子的析出电势,溶液中的金属离子被还原为Hg(0);一段时间后,再通过实验参数的调控,使得工作电极电压由负向正扫描,目的是将电极上已经富集的Hg(0)重新氧化为Hg(Ⅱ)溶出。通过上述过程便得到Hg(Ⅱ)的溶出峰电流-电压曲线。
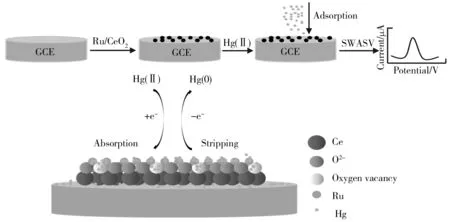
图8 Ru/CeO2/GCE表面通过SWASV检测Hg(Ⅱ)的过程
电子顺磁共振(EPR)光谱非常适合于研究CeO2的氧化态(Ce4+/Ce3+)的性质。因此,为探究Ru/CeO2(纳米棒)中Ce4+/Ce3+即氧空位的相关信息,对其进行了EPR测试。CeO2纳米棒和Ru/CeO2(纳米棒)的EPR谱图如图9所示。由图9可见,CeO2纳米立方体和Ru/CeO2(纳米棒)在g=1.96[31]时均出现Ce4+-O-Ce3+型缺陷位点,而CeO2纳米材料中的氧空位是其中的Ce4+被还原为Ce3+而形成的,所以将Ce4+-O-Ce3+型缺陷位点认为是氧空位。另外,Ru/CeO2(纳米棒)中氧空位的强度较CeO2纳米立方体有所增强。此结果与电化学检测Hg(Ⅱ)一致,说明Ru/CeO2(纳米棒)中氧空位提供的活性位点有助于HMIs在电极表面的氧化还原,对其检测有促进作用。

图9 CeO2纳米棒和Ru/CeO2(纳米棒)的EPR谱图
通过X射线衍射技术(XPS)对材料的表面组成和Ru的氧化态进行表征,结果如图10所示。通过对CeO2纳米棒和Ru/CeO2(纳米棒)的XPS总谱比较可以发现,除了CeO2中的元素(Ce、O)外,Ru是唯一被检测到的元素。图11所示的Ru/CeO2(纳米棒)样品的高分辨率XPS能谱显示,在281.6 eV和284.4 eV处可观察到明显的衍射峰,与钌的衍射峰相比,可以很容易地将其认定为Ru3d5/2。但值得注意的是,Ru的3d3/2峰与284.4 eV的C 1 s峰重合[32]。所以,只有281.56 eV的峰值能确定为Ru3d5/2[33]。
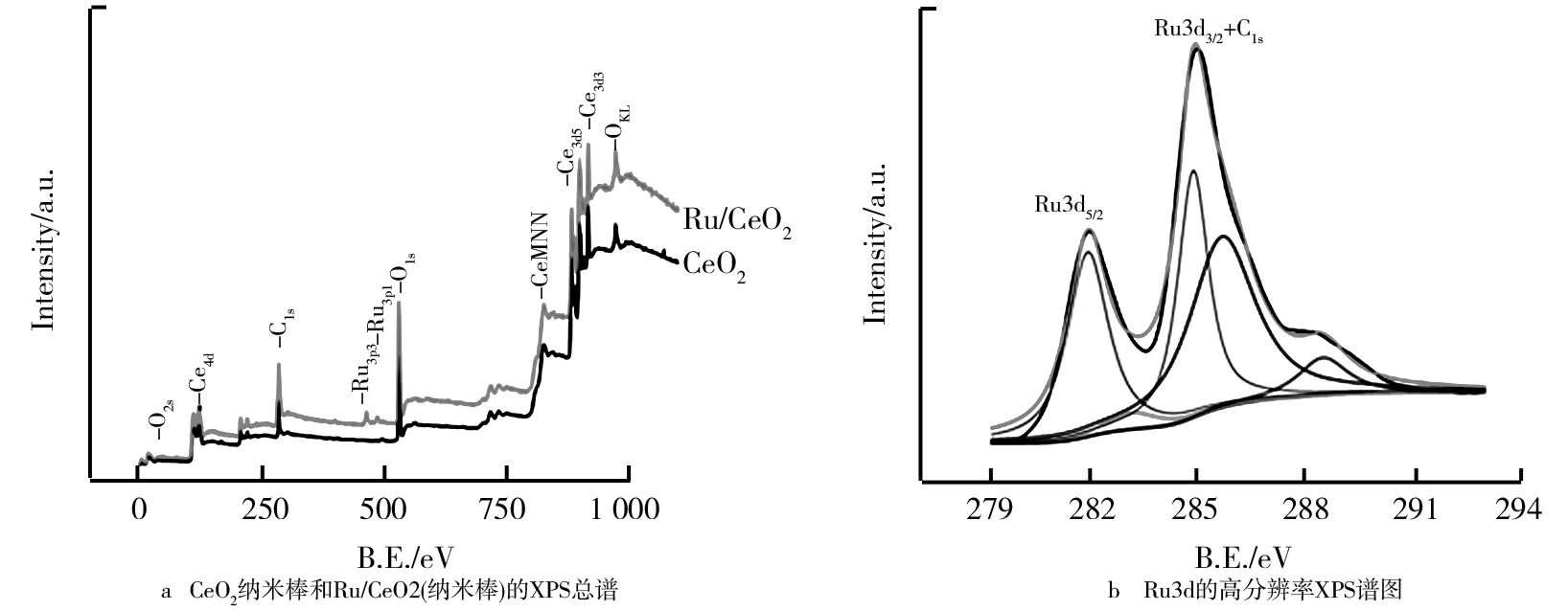
图10 CeO2纳米棒和Ru/CeO2(纳米棒)的XPS总谱以及Ru3d的高分辨率XPS谱图
为了明确Ru/CeO2(纳米棒)对HMIs(Hg(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ))的特异性作用,通过吸附实验探讨了其与材料暴露面、氧空位间的相互作用。利用XPS在原子水平上进一步研究了在多种HMIs(Hg(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)、Cu(Ⅱ))共存环境下材料对其的吸附能力(见图11)。显然,在共存离子的环境中,Hg(Ⅱ)信号仍然较为明显。高分辨XPS谱显示了样品对HMIs吸附能力的差异。吸附后的XPS总谱图中出现了明显的Hg4f7、Pb4f7/2、Pb4f5/2峰,且Hg(Ⅱ)的吸附量远大于Pb(Ⅱ)(0.211%>0.047%)(见表1),且并未发现Cd(Ⅱ)的高分辨XPS谱。由此表明,Pb(Ⅱ)、Cd(Ⅱ)的沉积量远小于Hg(Ⅱ),即Hg(Ⅱ)>Pb(Ⅱ)>Cd(Ⅱ),它们扩散到玻碳电极表面的面积有限。因此,它们参与氧化还原反应的量相对较小,从而导致它们的电流信号非常微弱,这可能是它们电化学敏感性较低的原因之一。说明Ru/CeO2(纳米棒)对HMIs的吸附具有较强的选择性,这与上面提到的电化学分析结果一致。
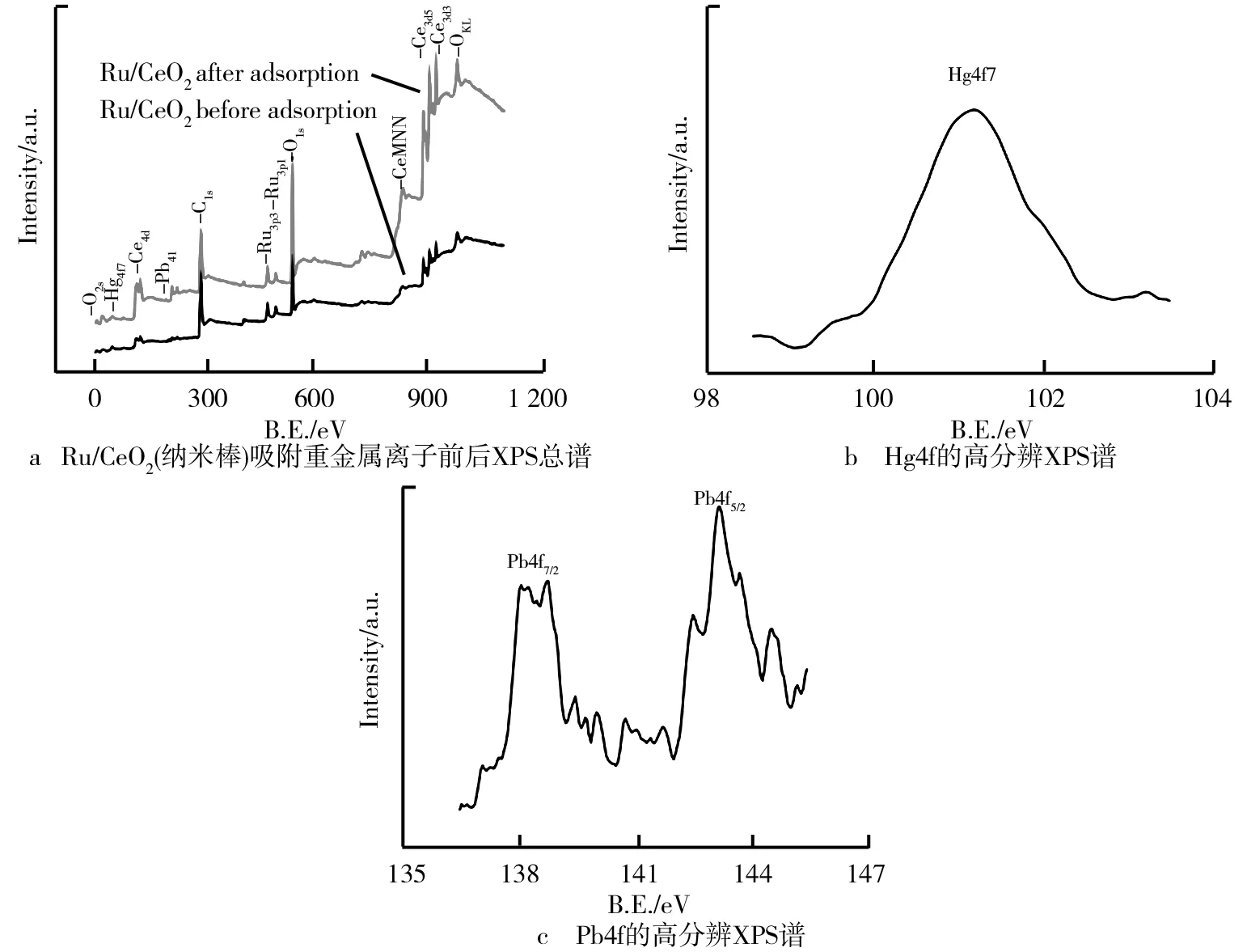
图11 Ru/CeO2(纳米棒)吸附重金属离子前后XPS总谱、Hg4f的高分辨XPS谱以及Pb4f的高分辨XPS谱

ElementHg/%Pb/%Atomic raction0.2110.047
2.5 实际水样
为证明Ru/CeO2(纳米棒)的潜在应用价值,对实际水的检测也进行了研究。选用的水取自安徽省合肥市董铺水库。将水经过滤去除不溶性物质后,用0.1 M NH3H2O-NH4Cl缓冲液按1∶9的体积比稀释。在实际复杂水环境下,Ru/CeO2/GCE对Hg(II)的SWASV响应及线性方程如图12所示。在掺有0.1~1.65 μM Hg(Ⅱ)的实际水样中,相应的线性关系(R2=0.998)和灵敏度均较好,检测灵敏度为1 562 μA·μM-1·cm-2,和标准实验结果较为接近。说明Ru/CeO2(纳米棒)具有较大的实际应用价值。
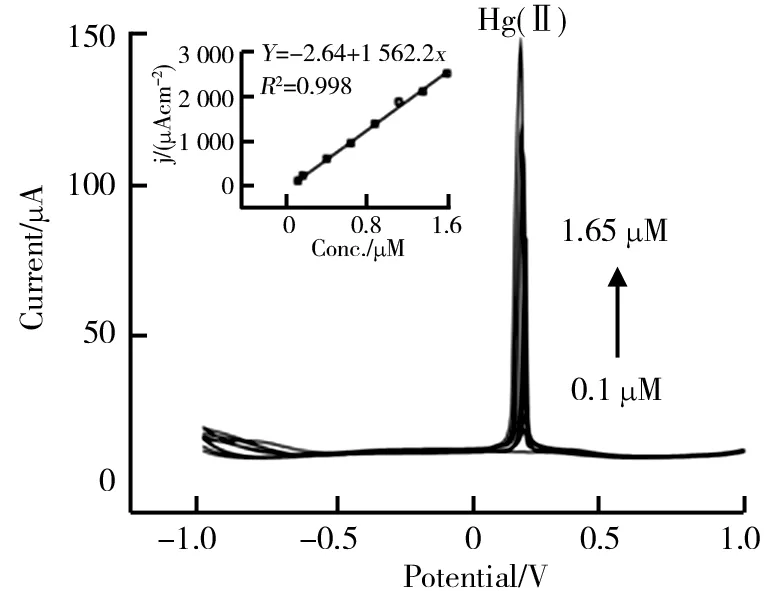
图12 Ru/CeO2/GCE对Hg(Ⅱ)的SWASV响应及线性方程
3 结论
综上所述,通过证明CeO2纳米棒的特性(暴露{110}面、氧空位)及Ru纳米粒子的协同作用实现了Ru/CeO2(纳米棒)对Hg(Ⅱ)的高灵敏检测。检测灵敏度为1 655.0 μA·μM-1·cm-2,检测限为0.02 μM,相比其他半导体金属氧化物和贵金属材料,效果有所提高。TEM结果表明CeO2纳米棒主要暴露{110}面,经电化学实验证实具有较高的催化活性。XPS、FT-IR、EPR结果表明,Ru/CeO2纳米棒表面存在-OH,有较强的吸附能力;其表面具有丰富的氧空位,大大增强材料的导电性,并提供大量的活性位点,以催化电化学反应中的氧化还原过程。电化学结果证实Ru/CeO2(纳米棒)对于不同的HMIs具有较强的选择性,同时XPS结果也证实了其对Hg(Ⅱ)的吸附能力较强,与电化学分析结果一致。此外,Ru/CeO2(纳米棒)已成功用于实际水样中Hg(Ⅱ)的分析,具有巨大的实际应用潜力。
