miR-181b-5p靶向PDCD4基因调控高糖诱导血管内皮细胞增殖和凋亡的机制
2020-10-12吴源白淑荣任红梅尹彩君魏述军
吴源 白淑荣 任红梅 尹彩君 魏述军
(宁夏回族自治区人民医院 1心血管中心,宁夏 银川 750021;2呼吸科;3心内科;4内分泌科)
糖尿病是一种常见的内分泌疾病,致病因素很多,长期糖尿病可引起动脉硬化、冠心病、高血压、肾病、足溃疡等多种慢性并发症,严重危害患者生命〔1〕。血管内皮细胞(VEC)是位于血管最内层的一层细胞,作为功能异常活跃的内分泌器官可合成及分泌大量的血管活性物质,维持血管正常生理功能〔2〕。糖尿病血管病变是糖尿病人最常见的并发症,是糖尿病致死、致残的主要原因〔3〕。程序性细胞死亡因子(PDCD)4是一个细胞凋亡因子,可以抑制细胞凋亡的发生,位于染色体10q24〔4〕。研究表明,PDCD4蛋白在高浓度葡萄糖诱导的VEC中上调表达,参与高糖诱导的VEC凋亡过程,并影响细胞的增殖〔5〕。微小RNA(miRNA)是在生物体内发现的一类由19~25个碱基构成的内源性小分子RNA,通过连接于靶基因mRNA的3′UTR,降解靶基因mRNA或阻止其蛋白翻译〔6〕。高糖环境可上调人脐静脉内皮细胞(HUVEC)中miRNA-503表达,通过抑制胰岛素样生长因子1的表达,减少HUVEC的增殖,促进其凋亡〔7〕。在血栓素的刺激下,HUVEC中miR-181b的表达迅速下调,保护VEC损伤〔8〕。miR-181b-5p在VEC的研究尚未清楚,因此,本研究采用体外培养人血管脐静脉内皮细胞的方法,探究miR-181b-5p对高糖诱导的HUVEC增殖和凋亡的影响及调控机制。
1 材料与方法
1.1材料 HUVEC购自美国ATCC公司;胎牛血清、DMEM培养液、胰蛋白酶购自Gibco公司;葡萄糖购自北京百欧博伟生物技术有限公司;LipofectamineTM2000转染试剂购于美国Invitrogen公司;噻唑蓝(MTT)、二甲基亚砜(DMSO)购于美国Sigma公司;Trizol试剂、聚偏氟乙烯(PVDF)膜、电化学发光液、双荧光素酶报告基因检测试剂盒购自北京Solarbio公司;放射免疫沉淀法(RIPA)裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒、二喹啉甲酸(BCA)试剂盒购自上海碧云天生物技术有限公司;Annexin V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)凋亡检测试剂盒购自美国Coulter公司;反转录试剂盒、实时荧光定量试剂盒购于TaKaRa公司;兔多克隆抗体PDCD4购自美国Bioworld公司;兔多克隆抗体GAPDH、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白(Ig)G购自Abcam公司;control mimic、miR-181b-5p mimic、control inhibitor、miR-181b-5p inhibitor由上海吉玛公司设计合成;pcDNA-PDCD4过表达载体由金瑞斯生物科技公司构建;引物合成由上海生工生物工程股份有限公司合成。
1.2细胞培养 HUVEC细胞使用含10%胎牛血清的DMEM培养基,于37℃ 5%CO2湿度饱和的条件下培养,每隔24 h换液1次,待细胞融和至60%~ 70%时,加入胰蛋白酶进行消化传代。选取对数生长期的细胞进行实验。
1.3细胞转染与分组 收集对数生长期的HUVEC,加入胰酶消化并重悬,以1×105个/孔接种至24孔板,常规培养24 h。参照LipofectamineTM2000转染试剂盒说明书进行转染,miR-NC组转染control mimic,miR-181b-5p组转染miR-181b-5p mimic,anti-miR-NC组转染control inhibitor,anti-miR-181b-5p组转染miR-181b-5p inhibitor,si-PDCD4组转染PDCD4 siRNA,miR-181b-5p+pcDNA组共转染miR-181b-5p mimic和pcDNA,miR-181b-5p+pcDNA-PDCD4组共转染miR-181b-5p mimic和pcDNA-PDCD4,转染至HUVEC细胞。之后对miR-181b-5p组、si-PDCD4组、miR-181b-5p+pcDNA组和miR-181b-5p+pcDNA-PDCD4组给予含33 mmol/L葡萄糖的培养基培养,标记为高糖组。其余用浓度5.5 mmol/L葡萄糖培养的细胞标记为对照组。
1.4实时荧光定量-聚合酶链反应(qRT-PCR)检测 取上述各组对数生长期的细胞,Trizol试剂提取各组HUVEC细胞总RNA,检测RNA纯度和浓度后使用TaKaRa反转录试剂盒将RNA反转录成cDNA,按照TaKaRa 荧光定量试剂盒使用说明配制反应体系,置于实时荧光定量仪上进行PCR扩增,每个样品重复3次。采用F=2-△△Ct法进行结果分析。以GAPDH作为内参,引物如下:GAPDH正义链:5′-GCACCGTCAAGGCTGAGAAC-3′,GAPDH反义链:5′-TGGTGAAGACGCCAGTGGA-3′。
1.5Western印迹检测 取上述各组对数生长期的细胞加入RIPA裂解液,置于冰上裂解细胞,4℃,26 750 r/min离心20 min,收集上清。将蛋白样品进行SDS-PAGE电泳后转至PVDF膜上,5%脱脂奶粉封闭液室温封闭1 h。分别加入PDCD4抗体(1∶1 000)和GAPDH抗体(1∶1 000),4℃孵育过夜,TBST洗膜3次,每次10 min;加入HRP标记的二抗(1∶5 000)室温孵育2 h,TBST洗涤;电化学发光显影,每个蛋白样品重复3次。
1.6MTT检测细胞增殖 取上述各组对数生长期的细胞,将其制备成1×104个/ml的单细胞悬液后,每孔100 μl接种至96孔板中,培养于37℃、5%CO2饱和湿度条件下。在各组细胞培养至24 h、48 h、72 h时加入20 μl(5 g/ L)的MTT溶液,培养4 h,弃上清,每孔加入150 μl DMSO,震荡使结晶溶解,在490 nm波长下检测细胞吸光度值(OD)。细胞活性与吸光值呈正比。
1.7流式细胞仪检测细胞凋亡 取上述各组细胞,加入预冷的PBS洗涤细胞,胰蛋白酶消化细胞,调整细胞浓度为 1×106个/ml,使用Annexin V-FITC/PI细胞凋亡检测试剂盒依次加入5 μl Annexin V-FITC和10 μl PI,轻轻混匀,室温避光孵育15 min,流式细胞仪检测细胞凋亡。
1.8双荧光素酶报告基因实验 Targetscan在线预测发现PDCD4 3′-非翻译区(UTR)上存在miR-181b-5p的结合位点,为进一步验证PDCD4是否是miR-181b-5p的靶基因,按照LipofectamineTM2000使用说明书,将野生型PDCD4表达载体(3′-UTR-WT)和突变型PDCD4表达载体(3′-UTR-MUT)分别与miR-181b-5p mimic共转染至HUVEC细胞,培养48 h后检测荧光素酶活性,相对荧光强度=萤火虫荧光强度/海肾荧光强度。
1.9统计学分析 采用SPSS20.0软件进行独立样本t检验、单因素方差分析。
2 结 果
2.1高糖对HUVEC增殖和凋亡的影响 与对照组相比,高糖组HUVEC在培养至48 h、72 h时活性显著降低,细胞凋亡率显著升高(P<0.01、P<0.001)。见表1。

表1 高糖对培养不同时间HUVEC增殖和凋亡的影响
2.2高糖对HUVEC中miR-181b-5p和PDCD4蛋白表达的影响 与对照组相比,高糖组的miR-181b-5p呈显著低表达,PDCD4 mRNA和蛋白表达水平显著升高(P<0.05)。见图1,表2。

图1 高糖对HUVEC中PDCD4蛋白表达的影响

表2 高糖对HUVEC中miR-181b-5p和PDCD4蛋白表达的影响
2.3过表达miR-181b-5p对高糖诱导的HUVEC增殖、凋亡的影响 与高糖组相比,高糖+miR-181b-5p组miR-181b-5p的表达量显著升高(P<0.001),HUVEC在培养至48 h和72 h时细胞活性显著增加(P<0.05,P<0.01),细胞凋亡率显著降低(P<0.01)。见表3。

表3 过表达miR-181b-5p对高糖诱导的培养不同时间HUVEC增殖、凋亡的影响
2.4抑制PDCD4蛋白表达对高糖诱导的HUVEC增殖、凋亡的影响 与高糖组相比,高糖+si-PDCD4组的PDCD4蛋白表达量显著降低(P<0.01),48 h、72 h HUVEC的细胞活性显著增加(P<0.05,P<0.01),凋亡率显著降低(P<0.01)。见表4,图2。

表4 抑制PDCD4蛋白表达对高糖诱导的培养不同时间HUVEC增殖、凋亡的影响

图2 抑制PDCD4蛋白表达对高糖诱导的HUVEC中PDCD4蛋白表达的影响
2.5miR-181b-5p靶向调控PDCD4蛋白的表达 PDCD4 3′-UTR上存在miR-181b-5p的结合位点(图3);将miR-181b-5p mimic与PDCD4 3′-UTR-WT质粒共转染后细胞荧光素酶活性显著下降(P<0.001);与PDCD4 3′-UTR-MUT质粒共转染后细胞荧光素酶活性无明显变化(P>0.05),见表5。与miR-NC组(0.45±0.05)相比,miR-181b-5p组HUVEC的PDCD4蛋白表达(0.21±0.03)显著下调(P<0.05),与anti-miR-NC组(0.41±0.04)相比,anti-miR-181b-5p组HUVEC的PDCD4蛋白表达(0.76±0.08)显著上调(P<0.05)。见图4。
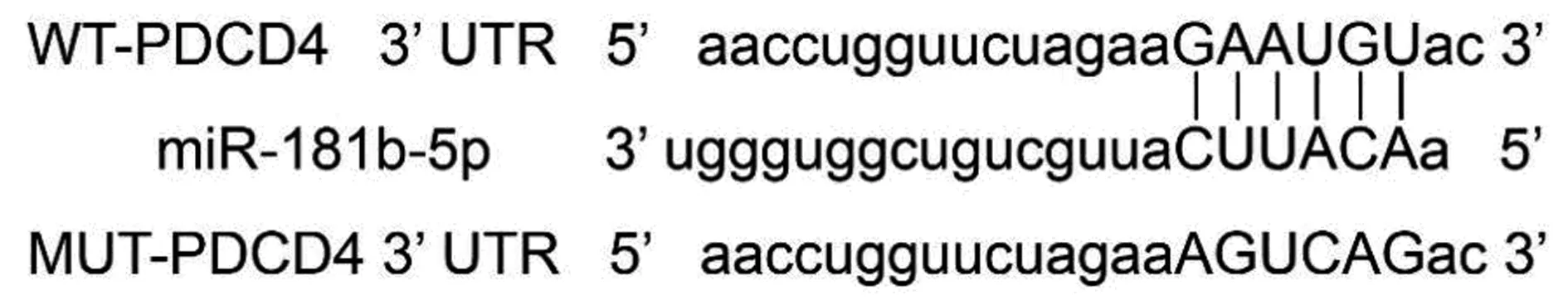
图3 PDCD4的3′UTR中含有与miR-181b-5p互补的核苷酸序列

表5 双荧光素酶报告实验

1~4:miR-NC组,miR-181b-5p组,anti-miR-NC组,anti-miR-181b-5p组图4 miR-181b-5p调控PDCD4蛋白的表达
2.6过表达PDCD4逆转了过表达miR-181b-5p对高糖诱导的HUVEC细胞凋亡的影响 将miR-181b-5p和PDCD4共转染至HUVEC细胞,并用葡萄糖浓度为33 mmol/L的培养基培养。与高糖组相比,培养48 h、72 h时高糖+miR-181b-5p组HUVEC细胞的细胞活性显著提高,细胞凋亡率显著降低(均P<0.05);与高糖+miR-181b-5p+pcDNA组相比,培养48 h、72 h时高糖+miR-181b-5p+pcDNA-PDCD4组HUVEC细胞的细胞活性显著降低,细胞凋亡率显著升高(均P<0.05)。提示过表达PDCD4逆转了上调miR-181b-5p表达对高糖诱导的HUVEC细胞增殖和凋亡的影响。见表7。

表7 过表达PDCD4逆转过表达miR-181b-5p对高糖诱导的培养不同时间HUVEC细胞增殖及凋亡的影响
3 讨 论
糖尿病患者的死亡与其并发症和合并疾病直接相关,据统计〔9〕,80%的糖尿病患者死于心血管疾病。研究表明,糖尿病患者心血管疾病的发病机制与血管内皮损伤有关,血管内皮损伤是糖尿病血管病变的重要机制〔10,11〕。因此,寻找有效的基因靶点保护VEC对预防糖尿病血管病变具有重要意义。
miRNA与靶基因之间的关系是复杂的,一个miRNA可以调控许多靶基因的表达,一个靶基因也可以被许多miRNA所调控,miRNA在各个领域的功能不断被认识〔12〕。研究表明,miRNA参与调节VEC的增殖、迁移和凋亡等过程,进而影响VEC介导的血管生成,在心血管疾病的发生过程中起到调控作用〔13~15〕。在肿瘤细胞生物学功能上关于miR-181b-5p的研究较多,如miR-181b-5p在卡波西肉瘤组织中的表达水平高于癌旁组织,miR-181b-5p可促进卡波西肉瘤细胞增殖,抑制其凋亡〔16,17〕。在胃癌细胞中miR-181b-5p的表达呈显著升高水平,促进细胞增殖,抑制细胞凋亡,miR-181b-5p在胃癌中可能起到癌基因的作用〔18〕。miR-181b在动脉粥样硬化患者血清中低表达,可能通过阻断VEC中核转录因子-κB信号途径和抑制血管平滑肌细胞的增殖和迁移起到抗动脉粥样硬化的作用〔19〕。本研究显示,高糖诱导的HUVEC中miR-181b-5p表达明显降低,细胞增殖能力降低,细胞凋亡率明显升高。上调miR-181b-5p的表达,可促进HUVEC的增殖,降低细胞凋亡率。
PDCD4是一种细胞凋亡基因,在正常组织中广泛表达,起到调节细胞程序性死亡的功能,也作为一种抑癌基因,通过抑制基因的转录和翻译来抑制肿瘤的生长〔20〕。有研究发现,血小板源性生长因子刺激的血管平滑肌细胞中PDCD4显著下调,过表达PDCD4可抑制血管平滑肌细胞增殖〔21〕。研究发现,PDCD4是VEC中miR-155的重要靶基因,miR-155通过调节PDCD4表达参与了高糖诱导的VEC的凋亡过程〔22〕。本研究提示,过表达PDCD4逆转了上调miR-181b-5p表达对高糖诱导的HUVEC增殖和凋亡的影响。
综上,miR-181b-5p在高糖诱导的HUVEC中呈低表达,上调miR-181b-5p可促进HUVEC增殖,抑制其凋亡,其机制可能与miR-181b-5p靶向调控PDCD4有关,为高血糖引起的血管病变提供了新的治疗靶点。
