LncRNA ZBTB20-AS1靶向miR-132-3p/MAPT轴影响阿尔茨海默病的发生发展
2020-10-12李文玲陈伯华徐新王静吉顺莉高捷殷晓芹孟相营
李文玲 陈伯华 徐新 王静 吉顺莉 高捷 殷晓芹 孟相营
(南通大学 1附属医院药剂科,江苏 南通 226001;2附属瑞慈医院药剂科)
阿尔茨海默病(AD)是一种以进行性记忆丧失和认知功能障碍为特征的慢性神经退行性疾病,约占所有痴呆病例的60%〔1〕。AD的病理学改变包括淀粉样病变、细胞内神经纤维缠结、小胶质细胞活化和大量神经元死亡〔2〕。据统计,2015年全球约3 500万人患有AD,已造成严重的社会和经济负担〔3〕。但AD发病机制尚不明确,且至今也未发现有效的AD治疗药物和策略。长链非编码(Lnc)RNA是一类新型的非编码RNA,具有广泛的生物学调控和修饰功能〔4〕。近年来,LncRNA在AD中的作用逐渐被揭示。LncRNA早期B细胞因子3反义RNA(EBF3-AS)在AD患者的脑组织中表达异常,具有促进AD模型细胞凋亡的作用〔5〕;LncRNA核富集转录本(NEAT)1通过靶向miR-107可加剧β淀粉样蛋白对AD神经元的损伤〔6〕。李蒙蒙〔7〕采用基因芯片技术筛选AD差异表达LncRNA发现,lncRNA锌指蛋白ZBTB20反义RNA1(ZBTB20-AS1)在AD细胞模型中表达上调,但ZBTB20-AS1在AD进展中的作用尚未可知。β淀粉样蛋白(Aβ)25~35可引起神经毒性和氧化应激,其诱导的神经细胞损伤是研究AD的常用模型〔8〕。本研究旨在阐明ZBTB20-AS1在AD进展中的作用和分子机制。
1 材料与方法
1.1实验材料 人神经母细胞瘤细胞SH-SY5Y购于美国ATCC;DMEM培养液和胎牛血清购于美国Hyclone公司;青链霉素溶液、噻唑蓝(MTT)试剂盒及膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒购于北京索莱宝生物科技有限公司;Aβ25~35购于美国Sigma公司;si-con、si-ZBTB20-AS1、miR-con、miR-132-3p mimics、si-MAPT、pcDNA-con、pcDNA-MAPT、WT-ZBTB20-AS1、MUT-ZBTB20-AS1、WT--MAPT、MUT-MAPT的设计和构建由广西锐博生物科技有限公司提供;TRIzol试剂购于美国Invitrogen公司;PrimeScript反转录试剂盒、miRNA cDNA第一链合成试剂盒及有关定量PCR试剂盒购于大连Takara生物科技有限公司;聚偏二氟乙烯(PVDF)膜和二喹啉甲酸(BCA)试剂盒购于上海碧云天生物科技有限公司;兔源MAPT抗体、兔源细胞周期蛋白(Cyclin)D1抗体、兔源活化的半胱氨酸天冬氨酸蛋白酶(Cleaved caspase)-3抗体、鼠源β-actin抗体及辣根过氧化物酶(HRP)标记的Ⅱ抗均购于美国Abcam公司;增强型ECL化学发光检测试剂盒购于南京诺唯赞生物科技有限公司。
1.2细胞培养和处理 采用胎牛血清含量为10%、青霉素含量为100 U/ml和链霉素含量为100 μg/ml的DMEM培养基,在37℃、CO2体积分数为5%的湿化细胞培养箱培养SH-SY5Y细胞。采用20 μmol/L的Aβ25~35处理SK-N-SH细胞构建AD细胞模型〔7〕。采用脂质体转染法进行细胞转染。将生长状态良好的SH-SY5Y细胞按照每孔2×105个细胞的密度接种于6孔板,利用LipofectamineTM2000将si-con、si-ZBTB20-AS1、miR-con、miR-132-3p mimics、si-MAPT分别转染至生长汇合度为50%的SH-SY5Y细胞,转染48 h检测转染效果,进行细胞活力和凋亡情况检测。为进一步证实ZBTB20-AS1调控miR-132-3p/MAPT轴参与对Aβ25~35诱导的SK-N-SH细胞活力和凋亡的调控,将si-ZBTB20-AS1分别与anti-miR-132-3p、anti-miR-con、pcDNA-MAPT或pcDNA-con分别共转染至SK-N-SH细胞,经Aβ25~35处理后,检测SK-N-SH细胞活力和凋亡情况。
1.3实验分组 实验分为以下几组:NC组、Aβ25~35组、Aβ25~35+si-con组、Aβ25~35+si-ZBTB20-AS1组、Aβ25~35+miR-con组、Aβ25~35+miR-132-3p组、Aβ25~35+si-con组、Aβ25~35+si-MAPT组、Aβ25~35+si-ZBTB20-AS1+anti-miR-con组、Aβ25~35+si-ZBTB20-AS1+anti-miR-132-3p组、Aβ25~35+si-ZBTB20-AS1+pcDNA-con组和Aβ25~35+si-ZBTB20-AS1+pcDNA-MAPT组。NC组为正常培养的SK-N-SH细胞。
1.4RT-qPCR检测 采用TRIzol试剂提取各组细胞总RNA,测定其浓度和纯度。为检测ZBTB20-AS1和MAPT的表达水平,利用PrimeScript反转录试剂盒将RNA逆转录为cDNA;为检测miR-132-3p,使用miRNA cDNA第一链合成试剂盒进行逆转录;采用TB Green Fast qPCR Mix在ABI7900进行荧光定量PCR扩增。用2-ΔΔCt法计算基因的相对表达水平。ZBTB20-AS1和MAPT的检测以β-actin为内参,miR-132-3p的检测以U6为内参。引物序列(5′-3′):ZBTB20-AS1上游引物TTAGCCATTGTACAGTTTGTGAAA,下游引物TCCTGAGGACTTTTGCTTGTCA;MAPT上游引物CCAAGTGTGGCTCAT TAGGCA,下游引物GCAATGTTGGACTGGACTCTGT;β-actin上游引物:GAAGTGTGACGTGGACATC-C,下游引物CCGATCCACACGGAGTACTT;miR-132-3p上游引物GCAACGTAACAGTC-TACAGCC,下游引物CCAGTGCAGGGTCCGAGGTA;U6上游引物CTCGCTTCGGCAG-CACA,下游引物AACGCTTCACGAATTTGCGT。
1.5双荧光素酶报告基因检测 Starbase在线预测显示,ZBTB20-AS1和MAPT的3′-UTR含有miR-132-3p的结合位点。猜测ZBTB20-AS1和MAPT与miR-132-3p之间存在靶向调控关系并进行验证。将miR-132-3p mimics和miR-con分别与野生型荧光素酶报告基因载体WT-ZBTB20-AS1(或者WT-MAPT)和突变型荧光素酶报告基因载体MUT-ZBTB20-AS1(或者MUT-MAPT)共转染至转染SH-SY5Y细胞,转染48 h,收集各组细胞,采用双荧光素酶报告基因检测系统进行荧光素酶活性检测。
1.6MTT法检测细胞活力 将SH-SY5Y细胞按照每孔2×104个细胞的密度接种于96孔板,按照1.3实验分组进行干预处理后,每孔加入20 μl的MTT试剂(5 mg/ml)室温下孵育4 h,弃去培养基后,每孔加入150 μl的DMSO,室温孵育2 h,当结晶完全溶解后,使用酶标仪测定490 nm波长处各孔的吸光度值。
1.7流式细胞术检测细胞凋亡 收集按照1.3实验分组进行干预处理的SH-SY5Y细胞,采用磷酸盐缓冲液(PBS)漂洗细胞2次,随后加入1倍结合缓冲液重悬细胞,调整细胞浓度。取100 μl细胞悬液(细胞数约为1×105)加入流式管内,室温避光条件加入5 μl的Annexin V-FITC,混匀10 min,加入5 μl的PI,室温避光孵育5 min后,补加1倍结合缓冲液至500 μl,混匀后,1 h内采用流式细胞仪检测细胞凋亡情况。
1.8Western印迹检测 采用预冷的PBS液洗涤按照1.3实验分组进行干预处理的SH-SY5Y细胞,RIPA裂解缓冲液SH-SY5Y细胞,12 000 r/min离心5 min,采用BCA试剂盒对细胞上清液中总蛋白进行定量。取适量细胞蛋白与上样缓冲液等体积混合,经煮沸变性后直接上样至凝胶加样孔进行十二烷基磺酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离细胞蛋白。利用湿法转膜转至将细胞蛋白转移至聚偏氟乙烯(PVDF)膜,室温条件下用5%脱脂牛奶封闭1 h,分别加入已稀释的MAPT抗体、CyclinD1抗体、Cleaved-caspase-3抗体、β-actin抗体4℃孵育过夜,然后与HRP标记的Ⅱ抗室温孵育2 h,利用增强型化学发光试剂盒进行显影,放于X光胶片暗盒内曝光后,图像处理软件分析目的条带的灰度值。
1.9统计学方法 采用SPSS18.0软件进行t检验、单因素方差分析、SNK-q检验。
2 结 果
2.1LncRNA ZBTB20-AS1、miR-132-3p和MAPT在AD细胞模型中的表达 表1和图1显示,与NC组比较,AD细胞模型(Aβ25~35组)中LncRNA ZBTB20-AS1、MAPT mRNA和MAPT蛋白的表达水平显著升高,miR-132-3p的表达水平显著降低(P<0.05)。

表1 AD细胞模型中LncRNA ZBTB20-AS1、MAPT和miR-132-3p表达量
2.2LncRNA ZBTB20-AS1靶向调控miR-132-3p表达,miR-132-3p靶向调控MAPT表达 ZBTB20-AS1的3′-UTR和miR-132-3p存在部分连续互补配对的核苷酸序列,MAPT的3′-UTR和miR-132-3p存在部分连续互补配对的核苷酸序列,见图2。表2显示,与miR-con和WT-ZBTB20-AS1共转染组比较,miR-132-3p mimics和WT-ZBTB20-AS1共转染组SK-N-SH细胞对的荧光素酶活性显著降低(P<0.05);与miR-con和MUT-ZBTB20-AS1共转染组比较,miR-132-3p mimics和MUT-ZBTB20-AS1共转染组SK-N-SH细胞对的荧光素酶活性变化差异无统计学意义(P>0.05)。表3显示,与miR-con和WT-MAPT共转染组比较,miR-132-3p mimics和WT-MAPT共转染组SK-N-SH细胞对的荧光素酶活性显著降低(P<0.05);与miR-con和MUT-MAPT共转染组比较,miR-132-3p mimics和MUT-MAPT共转染组SK-N-SH细胞对的荧光素酶活性变化差异无统计学意义(P>0.05)。以上结果提示,miR-132-3p是ZBTB20-AS1的靶基因,MAPT是miR-132-3p的靶基因。

表3 双荧光素酶报告基因实验验证miR-132-3p和MAPT的靶向关系

A:starbase对miR-132-3p和LncRNA ZBTB20-AS1结合进行预测;B:starbase对MAPT和miR-132-3p结合进行预测图2 LncRNA ZBTB20-AS1靶向调控miR-132-3p表达,miR-132-3p靶向调控MAPT表达

表2 双荧光素酶报告基因实验验证ZBTB20-AS1和miR-132-3p的靶向关系
2.3沉默ZBTB20-AS1对Aβ25~35诱导的SK-N-SH细胞增殖、凋亡及miR-132-3p和MAPT表达的影响 与NC组比较,Aβ25~35组SK-N-SH细胞ZBTB20-AS1和MAPT的表达水平显著升高,miR-132-3p的表达水平显著降低,Cleaved-caspase-3蛋白的表达水平显著升高,CyclinD1蛋白的表达水平显著降低,细胞增殖活力显著降低,细胞凋亡率显著升高(均P<0.05);与Aβ25~35+si-con组比较,Aβ25~35+si-ZBTB20-AS1组SK-N-SH细胞ZBTB20-AS1和MAPT的表达水平显著降低,miR-132-3p的表达水平显著升高,Cleaved-caspase-3蛋白的表达水平显著降低,CyclinD1蛋白的表达水平显著升高,细胞增殖活力显著升高,细胞凋亡率显著降低(P<0.05)。见表4、图3。提示沉默ZBTB20-AS1可促进miR-132-3p表达,抑制MAPT表达,促进SK-N-SH细胞增殖,抑制Aβ25~35诱导的SK-N-SH细胞凋亡。

表4 沉默ZBTB20-AS1对Aβ25~35诱导的SK-N-SH细胞增殖、凋亡及相关蛋白表达的影响

1~4:NC组、Aβ25~35组、Aβ25~35+si-con组、Aβ25~35+si-ZBTB20-AS1组图3 沉默ZBTB20-AS1对AD细胞CyclinD1、Cleaved-caspase-3和MAPT蛋白表达的影响
2.4过表达miR-132-3p对Aβ25~35诱导的SK-N-SH细胞增殖、凋亡及MAPT表达的影响 图4和表5显示,与NC组比较,Aβ25~35组SK-N-SH细胞miR-132-3p和CyclinD1的表达水平显著降低,MAPT和Cleaved-caspase-3的表达水平显著升高,细胞增殖活力显著降低,细胞凋亡率显著升高(均P<0.05);与Aβ25~35+miR-con组比较,Aβ25~35+miR-132-3p组

表5 过表达miR-132-3p对Aβ25~35诱导的SK-N-SH细胞增殖、凋亡及相关蛋白表达的影响
SK-N-SH细胞miR-132-3p和CyclinD1的表达水平显著升高,MAPT和Cleaved-caspase-3的表达水平显著降低,细胞增殖活力显著升高,细胞凋亡率显著降低(P<0.05)。提示,过表达miR-132-3p可抑制MAPT表达,促进SK-N-SH细胞增殖,抑制Aβ25~35诱导的SK-N-SH细胞凋亡。

1~4:NC组、Aβ25~35组、Aβ25~35+miR-con组Aβ25~35+miR-132-3p组图4 过表达miR-132-3p后各组Western印迹检测MAPT、CyclinD1、Cleaved-caspase-3蛋白的表达
2.5沉默MAPT对Aβ25~35诱导的SK-N-SH细胞增殖和凋亡的影响 表6和图5显示,与NC组比较,Aβ25~35组SK-N-SH细胞MAPT和Cleaved-caspase-3的表达水平显著升高,CyclinD1的表达水平显著降低,细胞增殖活力显著降低,细胞凋亡率显著升高(P<0.05);与Aβ25~35+si-con组比较,Aβ25~35+si-MAPT组SK-N-SH细胞MAPT和Cleaved-caspase-3的表达水平显著降低,CyclinD1的表达水平显著升高,细胞增殖活力显著升高,细胞凋亡率显著降低(P<0.05)。

表6 沉默MAPT对Aβ25~35诱导的SK-N-SH细胞增殖和凋亡及相关蛋白表达的影响
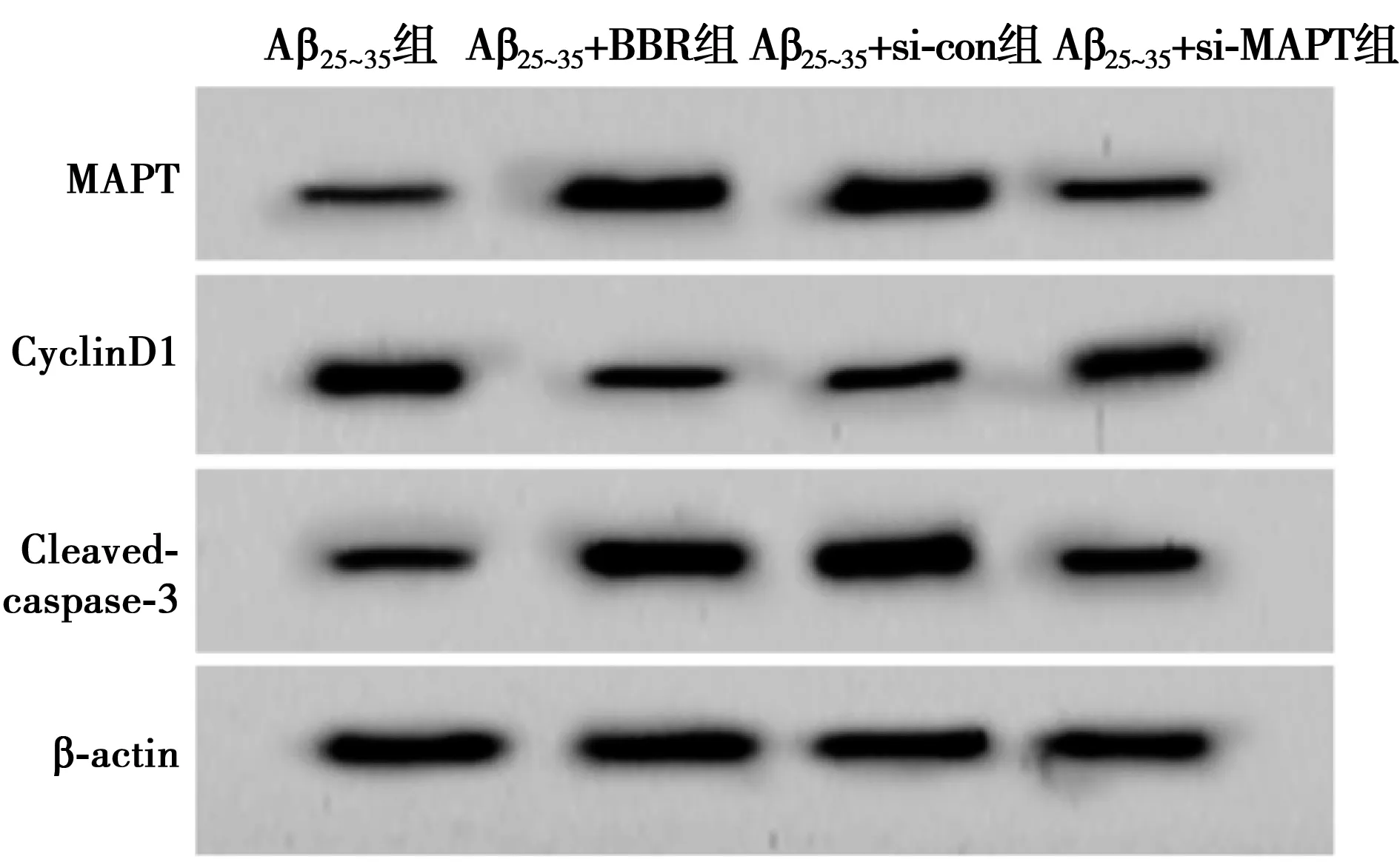
图5 Western印迹检测MAPT、CyclinD1、Cleaved-caspase-3蛋白的表达
2.6抑制miR-132-3p表达可部分逆转沉默ZBTB20-AS1对Aβ25~35诱导的SK-N-SH细胞的增殖和凋亡的影响 图6和表7显示,与Aβ25~35+si-con组比较,Aβ25~35+si-ZBTB20-AS1组SK-N-SH细胞miR-132-3p和CyclinD1的表达水平显著升高,Cleaved-caspase-3的表达水平显著降低,细胞增殖活力显著升高,细胞凋亡率显著降低(P<0.05);与Aβ25~35+si-ZBTB20-AS1+anti-miR-con组比较,Aβ25~35+si-ZBTB20-AS1+anti-miR-132-3p组SK-N-SH细胞miR-132-3p和CyclinD1的表达水平显著降低,Cleaved-caspase-3的表达水平显著升高,细胞增殖活力显著降低,细胞凋亡率显著升高(P<0.05)。提示,抑制miR-132-3p表达可部分逆转沉默ZBTB20-AS1对Aβ25~35诱导的SK-N-SH细胞的增殖和凋亡的影响。

表7 抑制miR-132-3p表达可部分逆转沉默ZBTB20-AS1对Aβ25~35诱导的SK-N-SH细胞的增殖和凋亡和相关蛋白表达的影响

1~4:Aβ25~35+si-con组、Aβ25~35+si-ZBTB20-AS1组、Aβ25~35+si-ZBTB20-AS1+anti-miR-con组、Aβ25~35+si-ZBTB20-AS1+anti-miR-132-3p组图6 Western印迹检测抑制miR-132-3p表达后各组细胞CyclinD1、Cleaved-caspase-3蛋白表达
2.7过表达MAPT可部分逆转沉默ZBTB20-AS1对Aβ25~35诱导的SK-N-SH细胞的增殖和凋亡的影响 表8和图7可见,与Aβ25~35+si-con组比较,Aβ25~35+si-ZBTB20-AS1组SK-N-SH细胞MAPT和Cleaved-caspase-3的表达水平显著降低,CyclinD1的表达水平显著升高,细胞增殖活力显著升高,细胞凋亡率显著降低(P<0.05);与Aβ25~35+si-ZBTB20-AS1+pcDNA-con组比较,Aβ25~35+si-ZBTB20-AS1+pcDNA-MAPT组SK-N-SH细胞MAPT和Cleaved-caspase-3的表达水平显著升高,CyclinD1的表达水平显著降低,细胞增殖活力显著降低,细胞凋亡率显著升高(P<0.05)。提示,过表达MAPT可以部分逆转沉默ZBTB20-AS1对Aβ25~35诱导的SK-N-SH细胞的增殖和凋亡的影响。

表8 过表达MAPT可部分逆转沉默ZBTB20-AS1对Aβ25~35诱导的SK-N-SH细胞增殖和凋亡和相关蛋白表达的影响

1~4:Aβ25~35+si-con组、Aβ25~35+si-ZBTB20-AS1组、Aβ25~35+si-ZBTB20-AS1+pcDNA-con组、Aβ25~35+si-ZBTB20-AS1+pcDNA-MAPT组图7 Western印迹检测MAPT、CyclinD1、Cleaved-caspase-3蛋白表达
3 讨 论
与李蒙蒙〔7〕研究结果相一致,本研究结果提示,ZBTB20-AS1的表达异常与AD的进展密切相关,这是首次关于ZBTB20-AS1基因功能的报道。
lncRNA作为与miRNA竞争性内源RNA发挥作用是其最重要的调控机制之一。本文结果显示miR-132-3p是ZBTB20-AS1的潜在靶基因。miR-132-3p隶属于miR-132/-212簇,已有研究发现,miR-132-3p参与调节突触活性和可塑性〔9,10〕;miR-132-3p还可调节神经元生长,介导新生神经元在成年海马和齿状回中的整合〔11〕;此外,miR-132-3p与突触结构形成和视觉皮质可塑性有关〔12〕。本研究显示,在AD模型细胞中miR-132-3p的表达水平显著降低,与前人miR-132-3p在AD患者海马区和前额叶皮质表达下调的结论相吻合〔13,14〕。进一步研究发现,过表达miR-132-3p能够减缓Aβ25~35对SK-N-SH细胞活力和凋亡的影响,ZBTB20-AS1可靶向负调控miR-132-3p表达,沉默ZBTB20-AS1通过靶向miR-132-3p可提高SK-N-SH细胞增殖活力,抑制Aβ25~35诱导的SK-N-SH细胞凋亡。
MAPT是神经微管相关蛋白Tau的编码基因,而Tau蛋白在神经元中的堆积是AD公认的病理标志之一〔15〕。既往研究表明,AD患者血浆和脑脊液中Tau蛋白表达水平增加,Tau蛋白表达水平是预测AD的发生与进展的生物学标志〔16〕。本研究结果提示,沉默ZBTB20-AS1通过调控miR-132-3p/MAPT轴可拮抗Aβ25~35诱导的SK-N-SH细胞凋亡。然而,在未来研究中,ZBTB20-AS1在AD中的作用还需要进一步的体内研究和临床研究来证实。
