视黄酸对隐睾生精细胞增殖分化及减数分裂的作用及其机制研究
2020-09-25王婷黄永汉杨画黄娟华徐杰伟张清学
王婷,黄永汉,杨画,黄娟华,徐杰伟,张清学
(1.中山大学孙逸仙纪念医院 生殖医学中心 广东 广州 510030;2.佛山市第一人民医院 生殖医学中心 广东 佛山 528000;3.佛山科学技术学院医药工程学院 广东 佛山528225)
隐睾是最常见的男性生殖系统先天畸形之一,又称睾丸下降不全。隐睾周围温度比阴囊内高2~3℃,会导致生精细胞过度凋亡,从而影响生育。隐睾在足月男婴中发病率达3%~4%[1],随着环境污染加剧,食物中各种性激素的滥用,隐睾发病率逐年上升[2]。研究显示,隐睾是男性不育的重要原因之一[3]。在睾丸下降过程中,任何环节出现问题都可能导致隐睾,具体机制尚不清楚,目前有内分泌学说、解剖学说、雄激素受体、遗传因素及环境中的危险因素等多种解释[4]。有文献报道,氟他胺(Flutamide,Flu)能影响睾丸发育,抑制睾丸下降,其机制可能与阻断胚胎期雄性激素有关[3-5]。本研究采用Flu诱导SD大鼠,复制隐睾模型,探讨视黄酸对隐睾生精细胞增殖分化及减数分裂的作用及其机制,为男性不育奠定实验基础。
1 材料与方法
1.1 实验动物
选择210~230 g SPF级SD大鼠60只,购自北京华阜康生物科技股份有限公司,动物许可证号:SCXK(京)2014-0004,单位许可证号:SYXK(翼)2014-0062。大鼠在佛山科学技术学院动物实验中心饲养,饲养室温度控制在22~25℃,相对湿度60%~70%,室内每天通风换气1、2次。大鼠适应性喂养7 d后,将雌雄大鼠按1∶1 合笼,每日观察雌鼠的阴栓。对阴栓脱落雌鼠分笼喂养并标记为妊娠0 d(30只SD孕鼠均怀孕)。所有操作均按照3R 原则给予人道关怀。
1.2 实验分组
将30只SD孕鼠随机分为对照组、模型组、干预组,每组10只。模型组大鼠孕12~20 d 皮下注射Flu 25 mg/(kg·d)(玉米油配制)。干预组在模型组基础上,其子代雄鼠出生后第1~10 天及第28~30 天皮下注射视黄酸1 mg/(kg·d)(玉米油配制)。对照组常规饲养不给任何药物或试剂。每组取10只子代雄鼠进行研究。
1.3 主要试剂与仪器
Stra8、Scp3、c-Kit、PLZF 兔多克隆抗体(美国BD公司,批号分别为orb131626、562530、555714和3032695),BCA试剂盒(北京诺博莱德科技有限公司,批号:P1511),DAB显色试剂盒(福州中杉金桥生物技术有限公司,批号:ZLI-9031),TUNEL System试剂盒(美国Promega公司,批号:230684),分析纯Flu(美国Sigma公司,批号:20160225),RNA 逆转录试剂盒(日本TaKaRa公司,批号:D6110A)。PCR引物由上海博亚生物技术有限公司合成,SP5 激光共聚焦显微镜(德国Leica公司),ABI9700RT-PCR 扩增仪(美国ABI公司)。
1.4 实验方法
1.4.1 睾丸标本采集手术收集3组子代雄性大鼠睾丸,将睾丸用生理盐水洗净后切成数份,一份放置于液氮中保存;另一份在4%多聚甲醛中固定。
1.4.2 大鼠睾丸组织HE染色 将各组睾丸组织用4%多聚甲醛固定,脱水后石蜡包埋,切片行HE染色,观察其组织学形态差异。
1.4.3 TUNEL法取相应的睾丸组织玻片常规脱蜡水化,按照TUNEL System 试剂盒说明书进行操作,在荧光显微镜下观察摄像。每张切片随机选取5个视野进行观察,计算凋亡指数。凋亡指数=视野内阳性细胞数/视野内总细胞数×100%。
1.4.4 免疫组织化学法取大鼠睾丸组织标本,采用免疫组织化学SP 二步法进行检测。组织经4%多聚甲醛溶液固定,石蜡包埋、切片、脱蜡、水化,加热修复,H2O2封闭,滴加适量稀释的大鼠c-Kit、Stra8、Scp3 抗体,4℃过夜,PBS 冲洗,加入生物素标记二抗室温孵育,DAB显色,封片后显微镜下观察。蛋白阳性反应呈棕色。
1.4.5 qRT-PCR采用Trizol 法提取大鼠睾丸组织总RNA,用逆转录试剂盒逆转录合成cDNA 模板,反应体系配制及反应条件严格按照试剂盒说明书进行操作。以cDNA为模板进行qRT-PCR 反应,实验重复3次,采用2-ΔΔCt法计算Stra8、c-Kit、Scp3 mRNA相对表达量。
1.4.6 Western blotting提取大鼠睾丸组织总蛋白,经BCA 法蛋白定量后上样,聚丙烯酰胺凝胶电泳分离、转膜,取出聚偏二氟乙烯膜,丽春红染液,封闭2 h。分别加入一抗稀释液,漂洗,加入二抗孵育2 h后,Tris-HCl 缓冲盐溶液漂洗,最后显影。用Image J 软件分析蛋白条带灰度,以目的蛋白条带灰度值与β-actin 内参条带灰度值的比值表示Stra8、c-Kit、Scp3、PLZF 蛋白相对表达量。
1.5 统计学方法
数据处理采用SPSS 20.0 统计软件。计量资料以均数±标准差 (±s)表示,比较用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 隐睾和合并畸形情况
模型组和干预组隐睾大鼠模型复制成功,睾丸均位于腹股沟区。模型组单侧隐睾6例,双侧隐睾4例,均合并尿道下裂。干预组单侧隐睾5例,双侧隐睾5例,8例合并尿道下裂。
2.2 大鼠睾丸组织学形态差异
与对照组相比,模型组睾丸各级生精细胞数目减少、排列紊乱;管腔中央无絮状精子形成,且曲细精管管腔间隙变大,管腔明显缩窄。对照组和干预组中发现大量精子细胞及絮状精子,且各层生精细胞排列整齐。见图1。

图1 3组子代大鼠睾丸组织学形态 (HE染色×400)
2.3 生精细胞凋亡情况
TUNEL 法检测结果显示,模型组可见大量生精细胞凋亡,而对照组和干预组生精细胞凋亡数较少(见图2)。对照组、模型组、干预组凋亡指数分别为(0.10±0.09)、(0.25±0.11)和(0.11±0.08),经方差分析,差异有统计学意义(F=8.678,P=0.000);对照组和干预组低于模型组(P<0.05)。
2.4 睾丸组织中c-Kit、Stra8、Scp3 蛋白的表达
与对照组相比,模型组c-Kit、Stra8、Scp3 蛋白表达水平下降,而干预组视黄酸干预后c-Kit、Stra8、Scp3 蛋白表达较模型组上升,趋于正常。见图3。
2.5 3组大鼠睾丸组织中Stra8、c-Kit、Scp3 mRNA相对表达量比较
3组大鼠睾丸组织中Stra8、c-Kit、Scp3 mRNA相对表达量比较,经方差分析,差异有统计学意义(P<0.05);对照组和干预组高于模型组(P<0.05)。见表1。
2.6 3组大鼠睾丸组织中Stra8、c-Kit、Scp3、PLZF 蛋白相对表达量比较
3组大鼠睾丸组织中Stra8、c-Kit、Scp3、PLZF蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05);对照组和干预组高于模型组(P<0.05)。见表2和图4。

图2 3组大鼠出生后30 d 睾丸内生精细胞凋亡情况 (TUNEL×400)
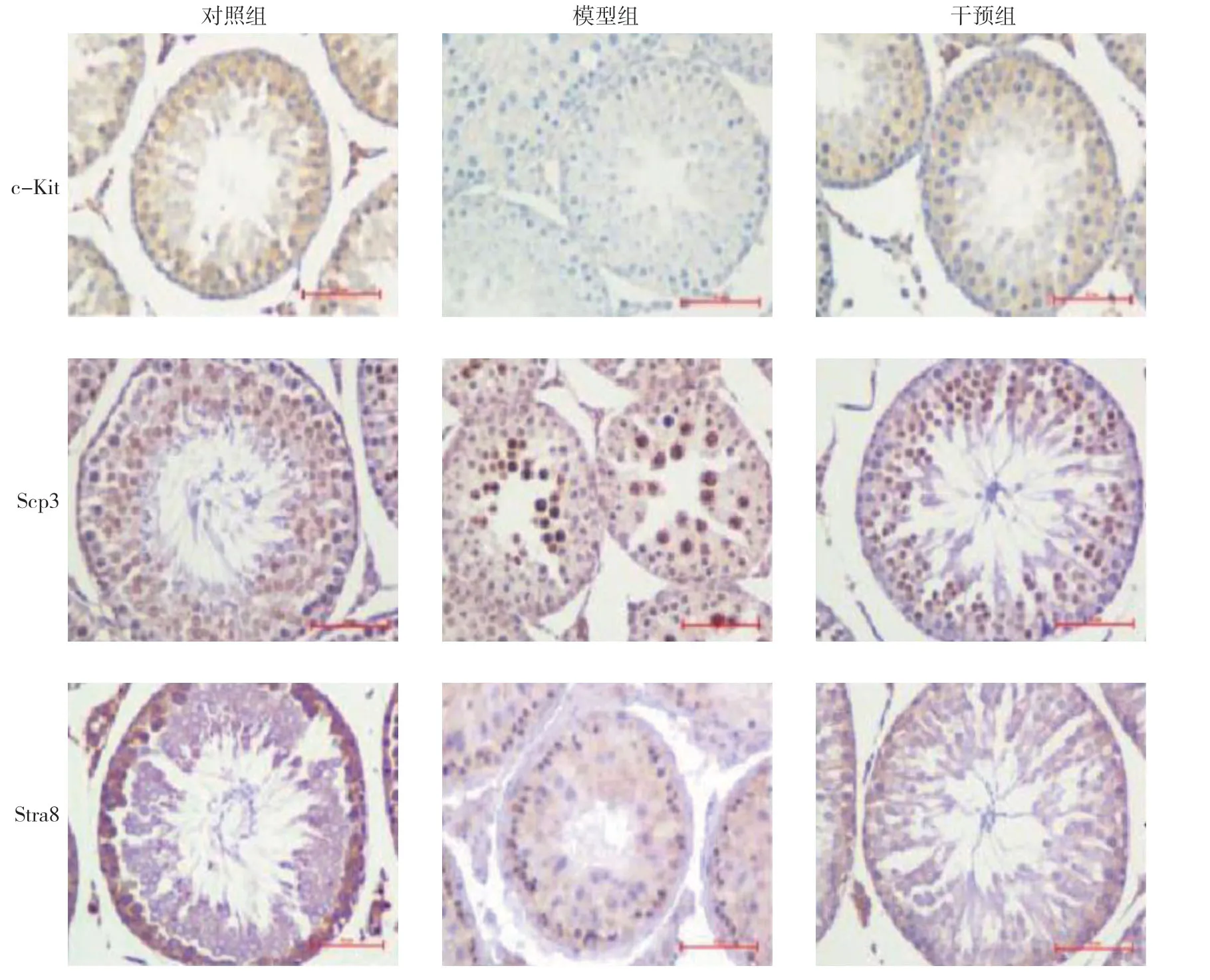
图3 3组大鼠睾丸组织中c-Kit、Stra8、Scp3 蛋白的表达 (免疫组织化学染色×400)
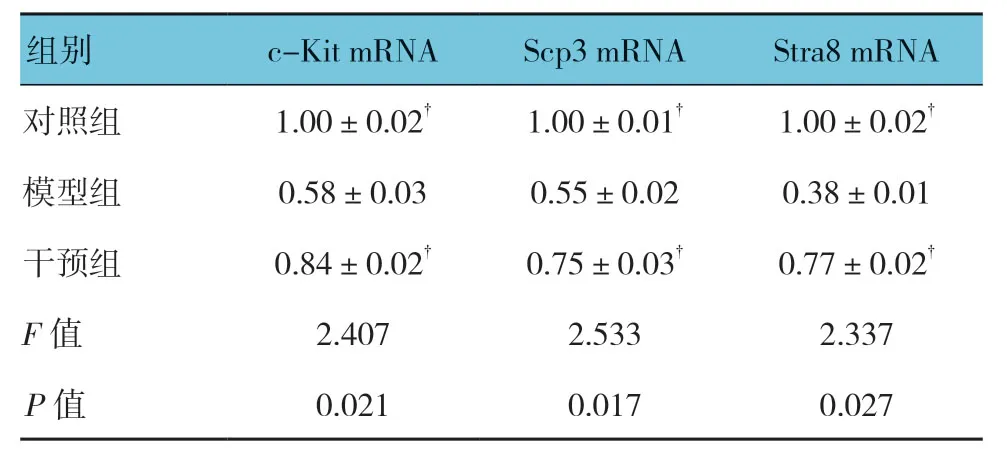
表1 3组大鼠睾丸组织中Stra8、c-Kit、Scp3 mRNA相对表达量比较 (n=10,x±s)
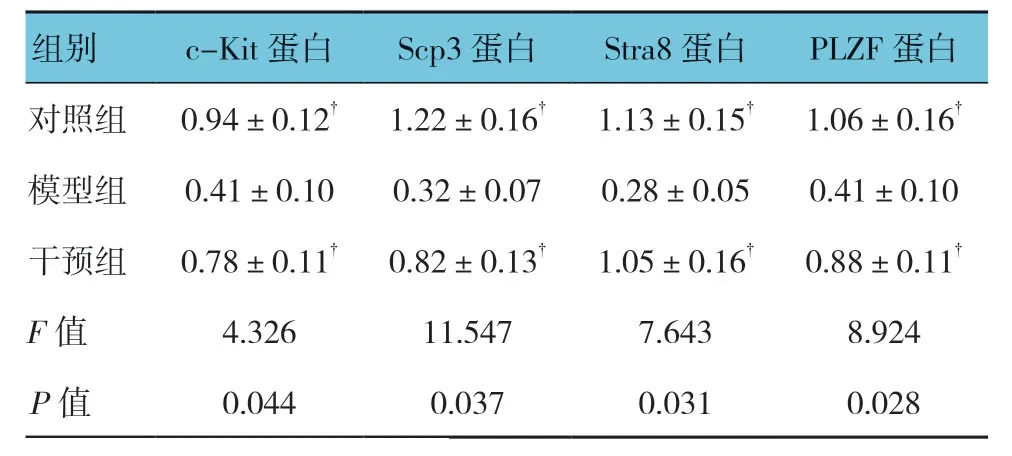
表2 3组大鼠睾丸组织中Stra8、c-Kit、Scp3、PLZF蛋白相对表达量比较 (n=10,x±s)
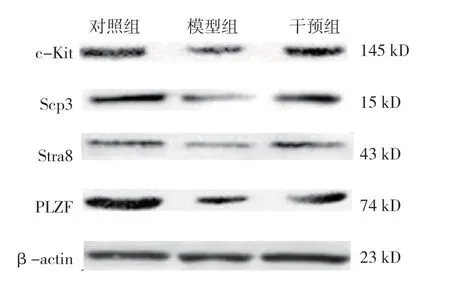
图4 3组大鼠睾丸组织中Stra8、Scp3、c-Kit、PLZF蛋白的表达
3 讨论
隐睾常见并发症包括不育及生育力下降。研究隐睾的病理学变化及隐睾中生精细胞的增殖分化,对治疗男性不育有重要意义。许多隐睾的研究来自于临床活检[6],但来源的限制使研究并不能够完整地反映睾丸组织病变情况。所以本研究采用Flu 孕期给药,成功复制子代隐睾大鼠。视黄酸在生精过程中发挥重要作用,其作为维生素A的活性代谢产物,参与精子形成的各个阶段调控。因此,本研究采用视黄酸作为干预剂,明确视黄酸是否能够调控隐睾生精细胞增殖分化及减数分裂。
本研究中,模型组大鼠睾丸组织形态学改变明显。HE染色结果显示,模型组睾丸各级生精细胞数目减少、排列紊乱;管腔中央无絮状精子形成,且曲细精管管腔间隙变大、管腔明显缩窄,与既往报道相符[7]。而对照组和干预组中发现大量精子细胞及絮状精子,且各层生精细胞排列整齐。TUNEL 检测结果显示,与对照组相比,模型组中可见大量生精细胞凋亡。与模型组相比,干预组生精细胞凋亡指数大幅下降,与HE染色结果基本一致,证实隐睾睾丸出现明显病理改变,生精细胞凋亡增多,支持细胞间的紧密结构被破坏,精子数量下降,这可能是产生生育障碍的重要原因,而视黄酸能够恢复隐睾睾丸的生精环境,抑制生精细胞凋亡。
精原干细胞的分裂具有不对称性,在分化同时自我复制,这样的增殖和分化是生精过程不断持续的基础,但这个过程受到很多因子的调控。目前研究比较多的是Stra8、Scp3、c-Kit和PLZF,其中Stra8、Scp3是减数分裂的关键因子,c-Kit、PLZF与增殖分化关系密切。Stra8是视黄酸的目标基因,被认为是减数分裂的启动基因,其在生精细胞从有丝分裂向减数分裂转换过程中表达上调[8-9]。有报道指出,精母细胞在Stra8 缺失情况下将停留在DNA 复制阶段,减数分裂无法启动,导致精子形成障碍[10]。Scp3是生精细胞减数分裂的标志基因,参与染色体联会复合体的组成[11]。据研究报道,Scp3基因变异可能导致无精症[12]。PLZF在精原干细胞增殖过程中发挥重要作用[13-15],参与精原干细胞的自我复制,维持其数量。c-Kit 在精原细胞分化过程中与其配体SCF 一起发挥重要作用[16-18],其表达水平反映精原细胞分化活动的强弱。本研究中免疫组织化学和qRT-PCR 反应结果显示,与对照组相比,模型组大鼠睾丸组织中c-Kit、Stra8、Scp3 蛋白和mRNA相对表达量降低,而视黄酸干预后大鼠睾丸组织中c-Kit、Stra8、Scp3 蛋白和mRNA相对表达量升高,趋于正常水平;Western blotting 检测结果显示,模型组Stra8、Scp3、c-Kit及PLZF 蛋白相对表达量低于对照组和干预组,与免疫组织化学和qRT-PCR反应结果基本一致。隐睾组织中Stra8、Scp3 蛋白和mRNA表达减少,提示隐睾减数分裂被终止,无法继续进行;在补充视黄酸后Stra8、Scp3表达上升,提示视黄酸能恢复隐睾减数分裂。隐睾组织中PLZF 蛋白、c-Kit 蛋白和mRNA表达下调,表明隐睾精原细胞的增殖、分化出现问题,而视黄酸干预后其蛋白表达上调,与对照组差异不大,说明视黄酸能促进精原细胞增殖、分化。
综上所述,本研究通过隐睾大鼠模型,证实睾丸病理结构的改变可能是其生殖障碍的重要原因。模型组睾丸生精细胞的增殖分化和减数分裂能力较对照组明显下降,而视黄酸干预后Stra8、Scp3、c-Kit、PLZF 蛋白及Stra8、Scp3、c-Kit mRNA表达水平上升,提示视黄酸能促进生精细胞发育,为隐睾生精障碍的预防、治疗带来希望。
