复方小儿退热栓的质量标准提高研究
2020-09-21谢思敏陈家仪汤迎湛顾利红栗建明侯惠婵
谢思敏 陈家仪 汤迎湛 顾利红 栗建明 侯惠婵

摘 要 目的:提高復方小儿退热栓的药品质量标准。方法:在原质量标准的基础上,建立处方中人工牛黄和南板蓝根的薄层色谱(TLC)鉴定方法;建立胆酸、猪去氧胆酸、对乙酰氨基酚含量测定的高效液相色谱(HPLC)法。结果:复方小儿退热栓中人工牛黄和南板蓝根的TLC 图谱均与相应的对照品或对照药材在相同位置上显现相同颜色的斑点,且相应的阴性样品无干扰。HPLC法采用色谱柱分别为Welch Xtimate C18柱(胆酸、猪去氧胆酸)、Agilent ZORBAX SB-C18柱(对乙酰氨基酚);流动相分别为乙腈-0.5%甲酸溶液(梯度洗脱,胆酸、猪去氧胆酸)、甲醇-水溶液(20 ∶ 80,V/V,对乙酰氨基酚);流速为1.0 mL/min;蒸发光散射检测器的漂移管温度为105 ℃,载气流速为2.0 L/min(胆酸、猪去氧胆酸);紫外检测波长为244 nm(对乙酰氨基酚)。胆酸、猪去氧胆酸、对乙酰氨基酚进样量分别在0.150 0~4.500 0、0.212 5~6.375 0、0.081 9~1.638 5 μg范围内线性关系良好(r均大于0.999 2);精密度、重复性、稳定性试验的RSD均小于3%(n=6或n=7);平均加样回收率分别为100.35%、101.39%、98.81%,RSD均小于3%(n=6)。结论:本研究在复方小儿退热栓原质量标准的基础上,增加了人工牛黄和南板蓝根的TLC鉴别方法,并采用HPLC法测定胆酸、猪去氧胆酸、对乙酰氨基酚的含量,能有效地提高该制剂的质量控制标准。
关键词 复方小儿退热栓;薄层色谱;高效液相色谱法;鉴别;含量测定;质量标准
ABSTRACT OBJECTIVE: To improve the quality standard of Compound child antifebrile suppository. METHODS: Based on the previous quality standard, TLC identification methods were established for artificial cow-bezoar and Baphicacanthis Cusiae Rhizoma et Radix. HPLC method was established for content determination of choleic acid (CA), hyodeoxycholic acid (HDCA) and paracetamol. RESULTS: TLC chromatogram of artificial cow-bezoar and Baphicacanthis Cusiae Rhizoma et Radix all showed the same color spots in the same position as the corresponding substance control or reference medicinal material, while the negative samples had no interference. HPLC was performed on Welch Xtimate C18 column (CA, HDCA) or Agilent ZORBAX SB-C18 column (paracetamol) with mobile phase consisted of acetonitrile-0.5% formic acetic acid (by gradient elution, CA and HDCA) or methanol-water (20 ∶ 80,V/V,paracetamol) at the flow rate of 1.0 mL/min. ELSD was used with a nitrogen flow-rate of 2.0 L/min at a drift tube temperature of 105 ℃(CA, HDCA). The detection wavelength was set at 244 nm(paracetamol). The linear ranges of CA, HDCA, paracetamol were 0.150 0-4.500 0, 0.212 5-6.375 0, 0.081 9-1.638 5 μg(all r>0.999 2). RSDs of precision,reproducibility and stability tests were all lower than 3% (n=6 or n=7). The average recoveries were 100.35%, 101.39%, 98.81%(all RSD<3%, n=6). CONCLUSIONS: Based on previous quality standard of Compound child antifebrile suppository, TLC method is used to identify artificial cow-bezoar and Baphicacanthis Cusiae Rhizoma et Radix, and the contents of CA, HDCA and paracetamol are determined by HPLC, which can effectively improve the quality control standard of the preparation.
KEYWORDS Compound child antifebrile suppository; TLC; HPLC; Identification; Content determination; Quality standard
复方小儿退热栓由对乙酰氨基酚、人工牛黄、南板蓝根组成,具有解热镇痛、利咽解毒、祛痰定惊的功效,在治疗小儿发热、上呼吸道感染、支气管炎、惊悸不安、咽喉肿痛、肺热痰多、咳嗽等症方面,具有较好的疗效[1-4],特别是针对小儿高热惊厥症,其临床疗效显著[5-7]。
本品现行质量标准为《中华人民共和国卫生部药品标准中药成方制剂(第14册)》[8]及企业注册标准。各标准中均采用紫外分光光度法测定对乙酰氨基酚含量,采用高效液相色谱法(HPLC)测定人工牛黄中胆红素的含量。但紫外分光光度法的专属性较差,不能完全排除处方中其他成分对测定结果的干扰,具有一定的局限性;另外,胆红素的含量低且性质不稳定,测定其含量来控制人工牛黄的质量意义不大[9-11]。胆酸和猪去氧胆酸为人工牛黄的主要成分,且性质比较稳定[12-14],因此本研究拟以这两种成分作为人工牛黄的质控成分。基于此,本研究在复方小儿退热栓原质量标准的基础上,优化人工牛黄和南板蓝根的薄层色谱(TLC)鉴别方法,建立处方中人工牛黄中胆酸、猪去氧胆酸、对乙酰氨基酚的HPLC含量测定方法,以期为该制剂质量标准的提高提供参考。
1 材料
1.1 仪器
1260 Ⅱ型HPLC仪(包括G7111A型四元泵、G7129A型自動进样器、G7117C型二极管阵列检测器)、Alltech 6000 型蒸发光散射检测器、OpenLab CDS 2.2型色谱工作站均购自美国Agilent公司;XS 204型电子天平、XP26型电子天平(瑞士Mettler-Toledo公司);DigistoreⅡ型薄层色谱数码成像仪(瑞士Camag公司);P300H 型超声波仪(德国Elma公司);TW20型水浴锅(德国Julabo公司)。
1.2 药品与试剂
17批复方小儿退热栓样品(生产企业A,批号分别为:20180301、20181005、20190301、20190604,规格:1.0 g/粒;生产企业B,批号分别为:B05001、B05002、B05003,规格:0.7 g/粒;生产企业C,批号分别为:180301、180302、180303、180401、180402、180403、180601、180602、180603、180604,规格:0.7 g/粒);胆酸对照品(批号:100078-201415,纯度:98.9%)、猪去氧胆酸对照品(批号:100087-201411,纯度:99.7%)、对乙酰氨基酚对照品(批号:100018-201610,纯度:99.9%)、人工牛黄对照药材(批号:121197-201204)、南板蓝根对照药材(批号:120971-201507)均购自中国食品药品检定研究院;甲醇、乙睛为色谱醇,水为超纯水。
2 方法与结果
2.1 TLC鉴别
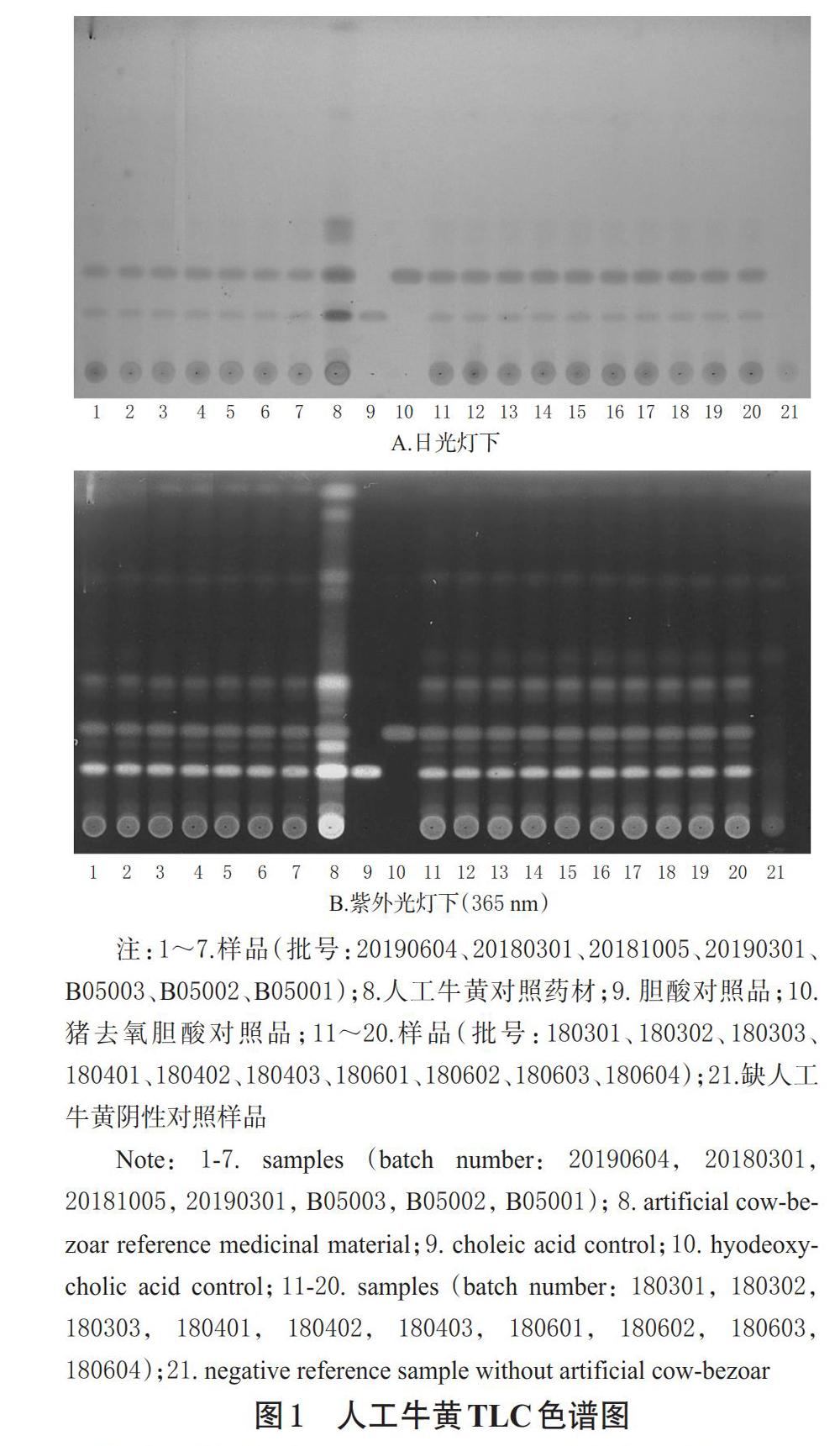
2.1.1 人工牛黄的TLC鉴别 取复方小儿退热栓样品,研匀,取适量(约含对乙酰氨基酚450 mg),精密称定,精密加入甲醇100 mL,称定质量,置于50 ℃水浴中超声(功率:380 W,频率:37 kHz)10 min,取出,放冷至室温,用甲醇补足减失的质量,于0~4 ℃放置1.5 h后,以 3 000 r/min离心5 min,取上清液放至室温。精密量取该上清液50 mL,水浴蒸干,残渣用二氯甲烷-甲醇(1 ∶ 1, V/V)10 mL溶解后,上中性氧化铝柱(100~200目,柱内径为10 mm);先用二氯甲烷20 mL洗脱,弃去洗脱液;再用甲醇30 mL洗脱,弃去洗脱液;继用含20%浓氨液的甲醇溶液80 mL洗脱,收集洗脱液,水浴蒸干,残渣加甲醇溶解后,转移至5 mL量瓶中,加甲醇稀释至刻度,摇匀,滤过,取续滤液,即得供试品溶液。取缺人工牛黄阴性样品(由生产企业C提供,下同),按上述制备方法操作,制得缺人工牛黄阴性对照溶液。取人工牛黄对照药材15 mg,加甲醇2 mL,振摇5 min,静置,取上清液作为人工牛黄对照药材溶液。分别取胆酸、猪去氧胆酸对照品适量,加甲醇制成每1 mL分别含胆酸0.5 mg、猪去氧胆酸0.5 mg的对照品溶液。取上述供试品溶液、缺人工牛黄阴性对照溶液各4 μL,人工牛黄对照药材溶液、胆酸对照品溶液、猪去氧胆酸对照品溶液各2 μL,分别点于同一硅胶G预制薄层板上,以正己烷-乙酸乙酯-甲醇-醋酸(20 ∶ 25 ∶ 3 ∶ 2,V/V/V/V)的上层溶液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105 ℃条件下加热至斑点显色清晰,分别置于日光灯及紫外光灯(365 nm)下检视。结果,在与人工牛黄对照药材、胆酸对照品、猪去氧胆酸对照品色谱相应的位置上,17批样品均呈现相同颜色的斑点和荧光斑点,且缺人工牛黄阴性样品无干扰,详见图1。
2.1.2 南板蓝根的TLC鉴别 取缺南板蓝根阴性样品,按“2.1.1”项下供试品溶液的制备方法操作,制得缺南板蓝根阴性对照溶液。取南板蓝根对照药材2 g,加乙醇50 mL,加热回流1 h,滤过,滤液水浴蒸干,残渣用甲醇2 mL溶解,以3 000 r/min离心5 min,取上清液作为南板蓝根对照药材溶液。取“2.1.1”项下供试品溶液和上述缺南板蓝根阴性对照溶液、南板蓝根对照药材溶液各6 μL,分别点于同一硅胶G预制薄层板上,以乙酸乙酯-甲醇-水(13 ∶ 7 ∶ 5,V/V/V)为展开剂,展开,取出,晾干,喷以5%茚三酮乙醇溶液,在105 ℃条件下加热至斑点显色清晰,置于日光灯下检视。结果,在与南板蓝根对照药材色谱相应的位置上,17批样品均呈现相同颜色的斑点,且缺南板蓝根阴性样品无干扰,详见图 2。
2.2 人工牛黄中胆酸、猪去氧胆酸的含量测定采用HPLC-蒸发光散射法进行测定。
2.2.1 色谱条件 色谱柱为Welch Xtimate-C18(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-0.5%甲酸溶液(B),梯度洗脱(0~20 min,30%A → 60%A; 20~21 min,60%A→ 95%A;21~26 min,95%A;26~27 min,95%A→30%A);流速为1.0 mL/min;柱温为35 ℃;进样量为10 μL。采用蒸发光散射检测器,漂移管温度为105 ℃,载气流速为2.0 L/min。
2.2.2 溶液的制备 称取胆酸对照品2.919 mg、猪去氧胆酸对照品3.555 mg,置于同一25 mL量瓶中,加甲醇溶解并稀释至刻度,制成每1 mL分别含胆酸0.12 mg、猪去氧胆酸0.14 mg的混合溶液,即混合对照品溶液1。称取胆酸对照品3.607 mg、猪去氧胆酸对照品4.233 mg和对乙酰氨基酚对照品1.774 g,置于同一200 mL量瓶中,加甲醇溶解并稀释至刻度,制成每1 mL分别含胆酸17.84 μg、猪去氧胆酸21.10 μg、对乙酰氨基酚8.86 mg的混合溶液,即混合对照品溶液2。
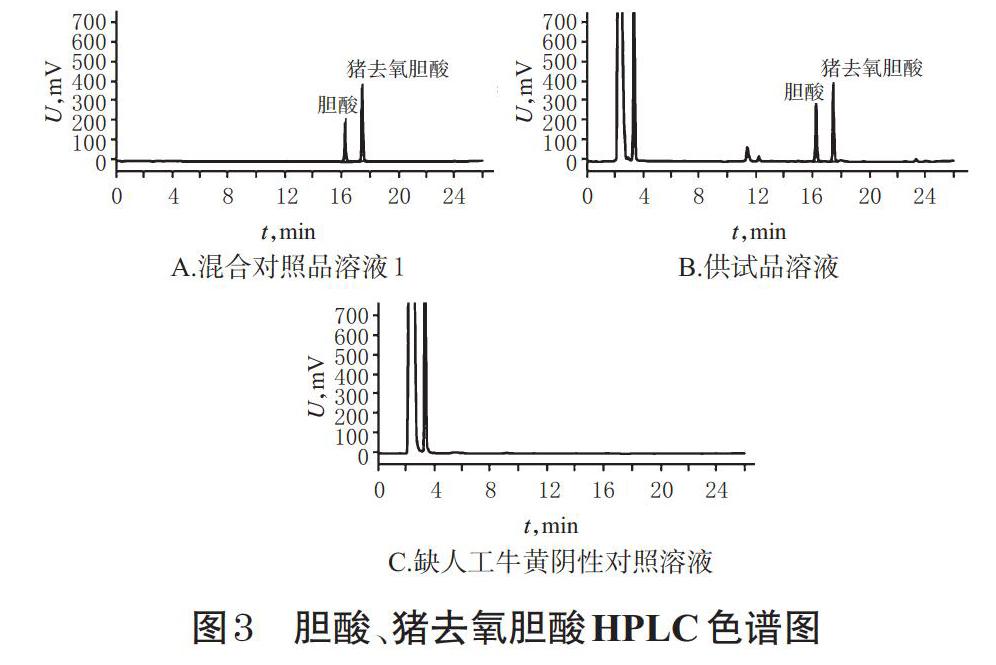
2.2.3 专属性试验 分别取“2.2.2”项下混合对照品溶液1和“2.1.1”项下供试品溶液、缺人工牛黄阴性对照溶液适量,按“2.2.1”项下色谱条件进样测定,记录色谱图。结果,胆酸、猪去氧胆酸与相邻色谱峰分离良好,理论板数按胆酸峰计不低于5 000,且缺人工牛黄阴性样品无干扰,表明本方法专属性良好,详见图3。
2.2.4 线性关系考察 称取胆酸对照品30.113 mg、猪去氧胆酸对照品42.462 mg,置于50 mL量瓶中,加甲醇溶解并稀释至刻度,制成每1 mL分别含胆酸0.60 mg、猪去氧胆酸0.85 mg的混合对照品母液。分别精密吸取该母液0.5、1、2、5、8、10、15 mL,置于20 mL量瓶中,加甲醇稀釋至刻度,摇匀,即得系列混合对照品溶液。分别精密吸取上述系列混合对照品溶液各10 μL,按“2.2.1”项下色谱条件进样测定,记录峰面积。分别以胆酸、猪去氧胆酸峰面积对数值(y)为纵坐标、进样量对数值(x, μg)为横坐标,绘制回归曲线。结果,胆酸的回归方程为y=1.696x+3.091 0(r=0.999 9),猪去氧胆酸的回归方程为y=1.679 2x+3.053 2(r=0.999 3),表明胆酸、猪去氧胆酸进样量分别在0.150 0~4.500 0、0.212 5~6.375 0 μg范围内线性关系良好
2.2.5 检测限与定量限考察 取“2.2.2”项下混合对照品溶液1适量,用甲醇逐级稀释,按“2.2.1”项下色谱条件进样测定,分别以信噪比3 ∶ 1、10 ∶ 1计算检测限和定量限。结果,胆酸、猪去氧胆酸的检测限分别为36、42 ng,定量限分别为72、84 ng。
2.2.6 精密度试验 精密吸取“2.2.2”项下混合对照品溶液1适量,按“2.2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,胆酸、猪去氧胆酸峰面积的 RSD分别为0.84%、0.69%(n=6),表明仪器精密度良好。
2.2.7 稳定性试验 取“2.1.1”项下同一供试品溶液(批号:20190301),于室温下放置0、2、4、6、8、12、24 h 后,按“2.2.1”项下色谱条件进样测定,记录峰面积。结果,胆酸、猪去氧胆酸峰面积的RSD分别为2.59%、0.27%(n=6),表明供试品溶液在室温下放置24 h 内基本稳定。
2.2.8 重复性试验 取复方小儿退热栓样品(批号:20190301)共6份,每份约3.0 g,按“2.1.1”项下“精密称定,……,取续滤液”方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,以外标对数法计算胆酸、猪去氧胆酸含量。结果,胆酸、猪去氧胆酸平均含量分别为0.29、0.36 mg/g,RSD分别为2.49%、2.99%(n=6),表明方法重复性良好。
2.2.9 加样回收率试验 精密称取已知胆酸、猪去氧胆酸含量的样品(批号:20190301)共6份,每份约1.5 g,精密加入25 mL “2.2.2”项下混合对照品溶液2和75 mL甲醇,按“2.1.1”项下“称定质量,……,取续滤液”方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,并计算加样回收率,结果见表1。
2.2.10 样品含量测定 分别取17批复方小儿退热栓样品适量,按“2.1.1”项下“精密称定,……,取续滤液”方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,按外标对数法计算胆酸、猪去氧胆酸含量,平行2份操作,取平均值,结果见表2。
2.3 对乙酰氨基酚的含量测定采用HPLC-紫外法进行测定。
2.3.1 色谱条件 色谱柱为Agilent ZORBAX SB-C18(250 mm×4.6 mm,5 μm);流动相为甲醇-水(20 ∶ 80, V/V);流速为1.0 mL/min;柱温为30 ℃;检测波长为244 nm;进样量为10 μL。
2.3.2 溶液的制备 称取对乙酰氨基酚对照品3.605 mg,置于50 mL量瓶中,加流动相溶解并稀释至刻度,制成每1 mL含72.03 μg对乙酰氨基酚的溶液,即得乙酰氨基酚对照品溶液。取复方小儿退热栓样品适量,按“2.1.1”项下“研匀,取适量……于0~4 ℃放置1.5 h后,以3 000 r/min离心5 min,取上清液放至室温”方法处理。然后取该上清液5 mL,置于25 mL量瓶中,用甲醇稀释至刻度,摇匀;再精密量取该稀释溶液2 mL,置于25 mL量瓶中,用流动相稀释至刻度,摇匀,滤过,取续滤液,即得供试品溶液。取缺对乙酰氨基酚阴性样品,按上述供试品溶液制备方法处理,即得缺对乙酰氨基酚阴性对照溶液。
2.3.3 专属性试验 取“2.3.2”项下对乙酰氨基酚对照品溶液、供试品溶液和缺对乙酰氨基酚阴性对照溶液适量,按“2.3.1”项下色谱条件进样测定,记录色谱图。结果,对乙酰氨基酚色谱峰对称,基线分离良好,理论板数按对乙酰氨基酚峰计应不低于2 000,且阴性对照无干扰,表明本方法专属性良好,详见图4。
2.3.4 线性关系考察 称取对乙酰氨基酚对照品20.502 mg,置于100 mL量瓶中,加流动相溶解并稀释至刻度,制成每1 mL含对乙酰氨基酚204.81 μg的对照品母液;分别精密吸取该母液1、2、5、10、15、20 mL,置于25 mL量瓶中,加流动相稀释至刻度,摇匀,即得系列对照品溶液。分别精密吸取上述系列对照品溶液适量,按“2.3.1”项下色谱条件进样测定。以对乙酰氨基酚峰面积(y)为纵坐标、进样量(x,μg)为横坐标,绘制回归曲线。结果,对乙酰氨基酚的回归方程为y=22 589x-64.731(r=0.999 5),表明对乙酰氨基酚进样量在0.081 9~1.638 5 μg范围内线性关系良好。
2.3.5 检测限与定量限考察 取“2.3.2”项下对乙酰氨基酚对照品溶液适量,以流动相逐级稀释,按“2.3.1”项下色谱条件进样测定,分别以信噪比3 ∶ 1、10 ∶ 1计算检测限和定量限。结果,对乙酰氨基酚的检测限和定量限分别为0.86、2.88 pg。
2.3.6 精密度试验 精密吸取“2.3.2”项下对乙酰氨基酚对照品溶液适量,按“2.3.1”项下色谱条件连续进样 6 次,记录峰面积。结果,对乙酰氨基酚峰面积的 RSD 为0.05%(n=6),表明仪器精密度良好。
2.3.7 稳定性试验 取“2.3.2”项下供试品溶液(批号:20190301),于室温条件下放置0、2、4、6、8、12、24 h 后,按“2.3.1”项下色谱条件进样测定,记录峰面积。结果,对乙酰氨基酚峰面积的RSD为 0.08%(n=7),表明供试品溶液在室温放置 24 h 内稳定性良好。
2.3.8 重复性试验 取复方小儿退热栓样品(批号:20190301)适量,共6份,按“2.3.2”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,以外标法计算对乙酰氨基酚含量。结果,对乙酰氨基酚的平均含量为154.65 mg/g,RSD为1.03%(n=6),表明方法重复性良好。
2.3.9 加样回收率试验 精密称取已知对乙酰氨基酚含量的复方小儿退热栓样品(批号:20190301)共6份,每份约1.5 g,分别置于锥形瓶中,精密加入25 mL “2.2.2”项下混合对照品溶液2和75 mL甲醇,按“2.1.1”项下“称定质量……上清液放至室温”方法处理后,精密吸取上清液5 mL,按“2.3.2”項下“置于25 mL量瓶中用甲醇稀释至刻度……取续滤液”方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,并计算加样回收率,结果见表3。
2.3.10 样品含量测定 分别取17批复方小儿退热栓样品适量,精密称定,按“2.3.2”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,按外标法计算对乙酰氨基酚的含量,平行2份操作,取平均值,结果见表2。
3 讨论
3.1 TLC鉴别方法的改进
为了评价TLC法的适用性,本研究前期对TLC法进行了耐用性试验,分别从温度(4 ℃和室温)、相对湿度(32%~72%)以及不同品牌硅胶G预制板(厂家分别为青岛海洋化工厂、烟台市化学工业研究所、德国Merck公司)等3个方面进行考察。结果发现,本品各项TLC鉴别结果不受温度、相对湿度以及不同品牌硅胶G预制板等条件改变的影响。
本试验前期在进行人工牛黄TLC鉴别时,采用企业标准中胆酸的处理方法,即样品用适量乙醇在60 ℃水浴中加热融化,放冷后滤过,滤液蒸干后用乙酸乙酯溶解作为供试品溶液;然后取适量供试品溶液、胆酸对照品溶液和猪去氧胆酸对照品点样,以10%磷钼酸乙醇溶液为显色剂,以异辛烷-乙酸乙酯-冰醋酸(15 ∶ 7 ∶ 5,V/V/V)为展开剂展开,并于紫外光灯(365 nm)下观察。结果发现,可检出与胆酸对照品相应的斑点,但未检出与猪去氧胆酸对照品相应的斑点。采用本文改进后的方法处理后,则同时检出胆酸和猪去氧胆酸斑点,且斑点更为清晰,色谱分离效果更好,阴性无干扰。在进行南板蓝根TLC鉴别时,按企业注册标准中南板蓝根的处理方法,即样品中加适量三氯甲烷使基质溶解,滤过,残渣挥尽三氯甲烷后,将滤纸和残渣一起置于烧杯中捣碎,加乙醚冷浸1 h,振摇,滤过,滤液置水浴锅上浓缩至1 mL作为供试品溶液,然后进行分析。结果发现,南板蓝根阴性对照有干扰。采用本文改进后的方法处理后,TLC斑点清晰,且阴性对照无干扰。
3.2 含量测定方法的改进
人工牛黄由牛胆粉、胆酸、猪去氧胆酸、牛磺酸、胆红素、胆固醇、微量元素等组成,2015年版《中国药典》(一部)人工牛黄“含量测定”项下采用紫外可见分光光度法测定胆酸和胆红素含量,并规定以干燥品计算,胆酸含量不得低于13.0%,胆红素含量不得低于0.63%[12]。但复方小儿退热栓中胆红素的含量较低,且性质不稳定,制备过程中遇光、热易分解;另外,本品为栓剂,基质干扰较大,前处理方法复杂;而猪去氧胆酸也是人工牛黄中的主要成分,且性质比较稳定[13-14]。因此,笔者通过测定成品中胆酸、猪去氧胆酸的含量来对人工牛黄的质量进行控制。本研究采用甲醇在50 ℃进行超声提取,可将样品中各成分及基质有效地溶解,进一步对提取液进行冷冻处理,可使基质析出,同时采用中性氧化铝柱对待测化合物进行富集纯化,避免了基质对样品测定及色谱柱柱效的影响。
3.3 含量测定结果分析
对不同生产企业来源的17批复方小儿退热栓样品的含量测定结果显示,3家生产企业的样品中胆酸含量分别为0.30~0.33、0.28~0.29、0.36~0.37 mg/粒,猪去氧胆酸含量分别为0.39~0.43、0.34~0.35、0.59~0.62 mg/粒,对乙酰氨基酚的含量分别为147.28~149.57、152.11~155.25、153.00~158.72 mg/粒。各企业产品的批间差异较小,但企业间产品存在一定的差异,这可能与复方小儿退热栓的药材组方原料以及生产工艺有一定的关系。
综上所述,本研究在复方小儿退热栓原质量标准的基础上,增加了人工牛黄和南板蓝根的TLC鉴别方法,并采用HPLC法测定了胆酸、猪去氧胆酸和对乙酰氨基酚的含量,能有效地提高该制剂的质量控制标准。
参考文献
[ 1 ] 侯小瑞.复方小儿退热栓治疗小儿感冒发热的疗效及其安全性[J].当代医学,2014,20(26):116.
[ 2 ] 克有丽.复方小儿退热栓治疗小儿感冒发热的疗效和安全性[J].心血管病防治知识,2014(8):132-133.
[ 3 ] 秦瑞娟,李海莹,张霞.复方小儿退热栓治疗小儿上呼吸道感染发热疗效安全性观察[J].临床合理用药杂志,2014,7(2A):51-52.
[ 4 ] 王茂平.复方小儿退热栓治疗伤风性感冒引起的发热症70例临床观察[J].中医药导报,2013,19(11):54-56.
[ 5 ] 苏家辉.复方小儿退热栓治疗小儿高热惊厥的临床疗效及其安全性[J].临床合理用药杂志,2019,12(5C):61-62.
[ 6 ] 李华蓉,李长金.复方小儿退热栓治疗小儿高热惊厥56例疗效及安全性观察[J].中国药业,2014,23(23):109- 110.
[ 7 ] 王维.复方小儿退热栓治疗小儿高热惊厥的临床效果分析[J].世界最新医学信息文摘,2019,19(2):110-112.
[ 8 ] 卫生部药典委员会.中华人民共和国卫生部药品标准中药成方制剂:第14册[S]. 1997:116.
[ 9 ] 许江红,温琰,陈华敏. HPLC法测定复方小儿退热栓中胆红素的含量[J].江西中医学院学报,2005,17(2):41- 59.
[10] 文为,曾嵘.复方小儿退热栓的质量标准研究[J].山西医药杂志,2008,37(8):720-721.
[11] 曾嵘,文为.高效液相色谱法测定复方小儿退热栓中胆红素的含量[J].中国药师,2009,12(5):616-617.
[12] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:5-8.
[13] 徐陆忠,严莺,周学琴. HPLC-ELSD 法测定人工牛黄甲硝唑胶囊中胆酸和猪去氧胆酸的含量[J].医药导报,2015,34(5):658-660.
[14] 石岩,孙冬梅,熊婧,等.人工牛黄多组分测定及其质量差异标志物的研究[J].中国中药杂志,2018,43(4):659- 664.
(收稿日期:2020-05-07 修回日期:2020-06-28)
(编辑:唐晓莲)
