注册于中国临床试验注册中心的儿科药物临床试验项目特征分析
2020-09-21张冠东杨钰赵瑞玲
张冠东 杨钰 赵瑞玲

摘 要 目的:為规范我国儿科药物临床试验项目开展、促进儿科人群用药的开发与应用提供参考。方法:检索中国临床试验注册中心(Chi CTR)数据库,收集所有研究对象年龄<18周岁的药物临床试验项目,检索时限从建库起至2019年10月1日,对其项目名称、研究所涉疾病/系统、研究所处阶段、注册时间、注册状态、研究负责单位地域分布、经费来源、研究类型、是否设置数据管理委员会、征募研究对象情况、伦理委员会批准情况、是否采用盲法、是否采集人体标本及人体标本去向等信息进行统计分析。结果:共收集到儿科药物临床试验231项,共涉及21个类别的系统/疾病,包括肿瘤及瘤样病变、眼科疾病、变态反应性疾病等;研究所处阶段以上市后药物临床试验的项目有85项(占36.80%),Ⅰ~Ⅳ期药物临床试验共有77项(占33.33%);注册项目数量逐年增加,有179项(77.49%)为预注册,52项(22.51%)为补注册;注册项目较多的前5位地区分别为北京、上海、广东、重庆、浙江,其项目数共占纳入项目总数的66.23%(153/231);经费来源主要为自筹(57.85%)、医院资助(20.18%)、地方财政资金(10.31%);研究类型主要为干预性研究和观察性研究,共占88.31%;有145项(占62.77%)研究暂未确定是否设置数据管理委员会;有201项(占87.01%)研究通过了相关机构的伦理委员会审查;有168项(占72.73%)研究未明确是否采用盲法;有133项(占57.58%)研究采集了人体标本,采集的人体标本去向主要为使用后销毁。结论:注册于Chi CTR的儿科药物临床试验注册数量呈逐年递增趋势,但存在地域不均衡性;我国研究者的药物临床试验注册观念正逐步建立,且已意识到数据管理对研究质量的重要性,对采集的试验标本的管理也较为规范。建议相关部门加大对临床试验注册的宣传,完善临床试验注册管理制度;相关研究者应提高临床试验注册意识,规范进行注册申报和试验项目管理。
关键词 中国临床试验注册中心;儿科人群;药物临床试验;特征
ABSTRACT OBJECTIVE: To provide reference for standardizing pediatric clinical trials and promoting the development and application of pediatric medication in China. METHODS: Chinese Clinical Trial Registry (Chi CTR) database were searched to collect all clinical trials related to pediatric population under 18 years old from the inception to Oct. 1st,2019. Those clinical trials were analyzed statistically in respect of name of registered project, involved disease/system, research stage, registration time, registration status, regional distribution of research institutions, source of funds, research type, whether data management committee was set up,situation of recruited research objects, ethics committee approval status, whether blind method was adopted, whether to collect human specimens and whereabouts of human specimens. RESULTS: A total of 231 pediatric drug clinical trials were included. The clinical trials involved 21 kinds of diseases/systems, mainly were tumors and tumor-like lesions, ophthalmic diseases and allergic disease. The research stage has the most items (85 trials,36.80%) in post-marketing drug clinical trials; there were 77 items of phase Ⅰ-Ⅳ clinical trials (33.33%). The number of pediatric drug clinical trials was increased year by year, and among which 179 trials were pre-registered (77.49%), 52 trials were supplementary registration (22.51%). Beijing, Shanghai, Guangdong, Chongqing and Zhejiang were the major regions where pediatric drug clinical trials were carried out,and the clinical trial projects of which accounted for 66.23% (153/231) of the total number of included projects. The funding sources were mainly self-financing (57.85%), hospital finance(20.18%), and local government finance (10.31%). The main type of research was intervention study and observational study, accounting for 88.31% in total. Totally 145 trials (62.77%) had not yet determined whether to set up a data management committee; 201 trials (87.01%) had passed the review of the ethics committee of the relevant institution; 168 trials (72.73%) did not clarify whether the blind method was used; 133 trials (57.58%) had collected human specimens, and the collected human specimens were mainly destroyed after use. CONCLUSIONS: The number of pediatric drug clinical trials registered in Chi CTR is increasing but there is regional imbalance. Researchers have gradually established the concept of pediatric clinical trial registration, and have realized the importance of data management to research quality, and the management of collected trial specimens is relatively standardized. It is suggested that relevant departments increase the publicity of clinical trial registration and improve the clinical trial registration management system; relevant researchers should increase the awareness of clinical trial registration, standardize registration application and trial project management.
KEYWORDS Chinese Clinical Trials Registry; Pediatric population; Drug clinical trials; Characteristics
“重视用药安全,保障儿童健康”是我国的一项长期卫生工作目标。但儿童用药品种、剂型短缺严重,世界各国普遍存在儿童超说明书用药的情况。与成人临床试验相比,儿科人群临床试验在伦理学、入组操作和评价方法等诸多方面均有明显的特殊性[1],难以利用成人临床试验数据推导儿科人群用药的安全性和有效性,因此有必要在儿科人群中开展临床试验。
临床试验注册是医学研究伦理的需要;公开临床试验的信息,并将其置于公众监督之下,是试验研究者的义务和道德责任。临床试验注册不仅能确保追溯每项临床试验的结果,还可实现试验信息公开透明,提高研究的真实性和科学性,减少发表偏倚和不必要的重复试验,以保障公众健康和合理使用卫生资源[2-3]。药物临床试验是临床试验中的重要组成部分。目前,我国药物临床试验注册主要有两个平台——中国临床试验注册中心(Chinese Clinical Trial Registry,简称为“Chi CTR”)和药物临床试验登记与信息公示平台。其中,药物临床试验登记与信息公示平台主要登记以药品注册上市为目的的药物临床试验项目,登记的临床试验项目范围较窄;而Chi CTR网站的注册项目包含所有在人体中和采用取自人体的标本进行的研究,不以药品注册上市为目的,且由于该平台注册的研究在国际医学期刊发表时将获优先发表,鼓励了不少研究者选择在Chi CTR注册,因此在Chi CTR注册的研究数量更多。为全面了解我国儿科药物临床试验开展情况,笔者收集了Chi CTR目前在册的儿科药物临床试验的项目信息,分析其研究特征及开展状况,以期为规范我国儿科药物临床试验项目开展、促进儿科人群用药的开发与应用提供参考。
1 资料与方法
1.1 资料来源
收集2005年7月25日(Chi CTR建库日)至2019年10月1日在Chi CTR网站注册的研究对象年龄为18岁以下儿科人群的药物临床试验。
1.2 纳入与排除标准
纳入标准:研究对象年龄<18岁;研究目的与药物相关;注册状态、研究所处阶段、研究类型、是否获伦理委员会批准、是否签署知情同意书、征募研究对象情况、是否公开试验结果等均不限(按Chi CTR网站的标准,注册状态分为预注册和补注册两种;研究所处阶段分为Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期、上市后试验、探索性试验、预试验、其他等;研究类型分为干预性研究、观察性研究、病因学/相关因素研究等;征募研究对象情况分为尚未开始、正在进行、暂停或中断、结束等)。
排除标准:研究对象年龄≥18岁的项目;研究内容与儿科人群无关或与药物无关的项目等。
1.3 项目筛选与资料提取
由2名研究者独立筛选项目、提取资料并交叉核对,如遇分歧,通过讨论协商解决。逐条查看注册信息,按上述纳入与排除标准筛选项目,并记录纳入项目的基本资料,包括注册项目的名称、研究所涉疾病/系统、研究所处阶段、注册时间、注册状态、研究负责单位地区分布、经费来源、研究类型、是否设置数据管理委员会、征募研究对象情况、伦理委员会批准情况、是否采用盲法、采集人体标本情况及人体标本去向。
1.4 数据整理及统计学方法
纳入研究所涉疾病/系统参考《诸福棠实用儿科学》(第8版)进行分类;采用Excel 2016软件进行数据录入和整理;采用SPSS 25.0软件对资料进行统计分析,计数资料采取频数及其构成比描述。
2 结果
2.1 项目筛选流程及结果
初始检索共获得707项注册研究,逐条查看注册内容,按照上述纳入與排除标准,最终纳入儿科人群相关的临床试验683项,进一步筛选获得儿科药物临床试验项目共计231项。
2.2 纳入研究所涉疾病/系统分布
本研究纳入的231项儿科药物临床试验共涉及21个类别的系统/疾病,详见表1(另有23项研究为涉及麻醉方法的非疾病研究,故未在表中列出)。
2.3 临床试验所处阶段
按Chi CTR网站的临床试验所处阶段划分标准,231项儿科药物临床试验注册时所处的研究阶段分布详见图1。由图1可见,上市后药物临床试验项目有85项(占36.80%);Ⅰ~Ⅳ期药物临床试验共有77项(占33.33%)。
2.4 注册时间及注册状态
2005-2006年,即Chi CTR建库后最开始2年,未见有儿科人群相关的药物临床试验项目注册,其后各年度的注册项目数量逐渐增加,详见图2。截至2019年10月1日,231项儿科药物临床试验中,有179项(77.49%)为预注册,52项(22.51%)为补注册。
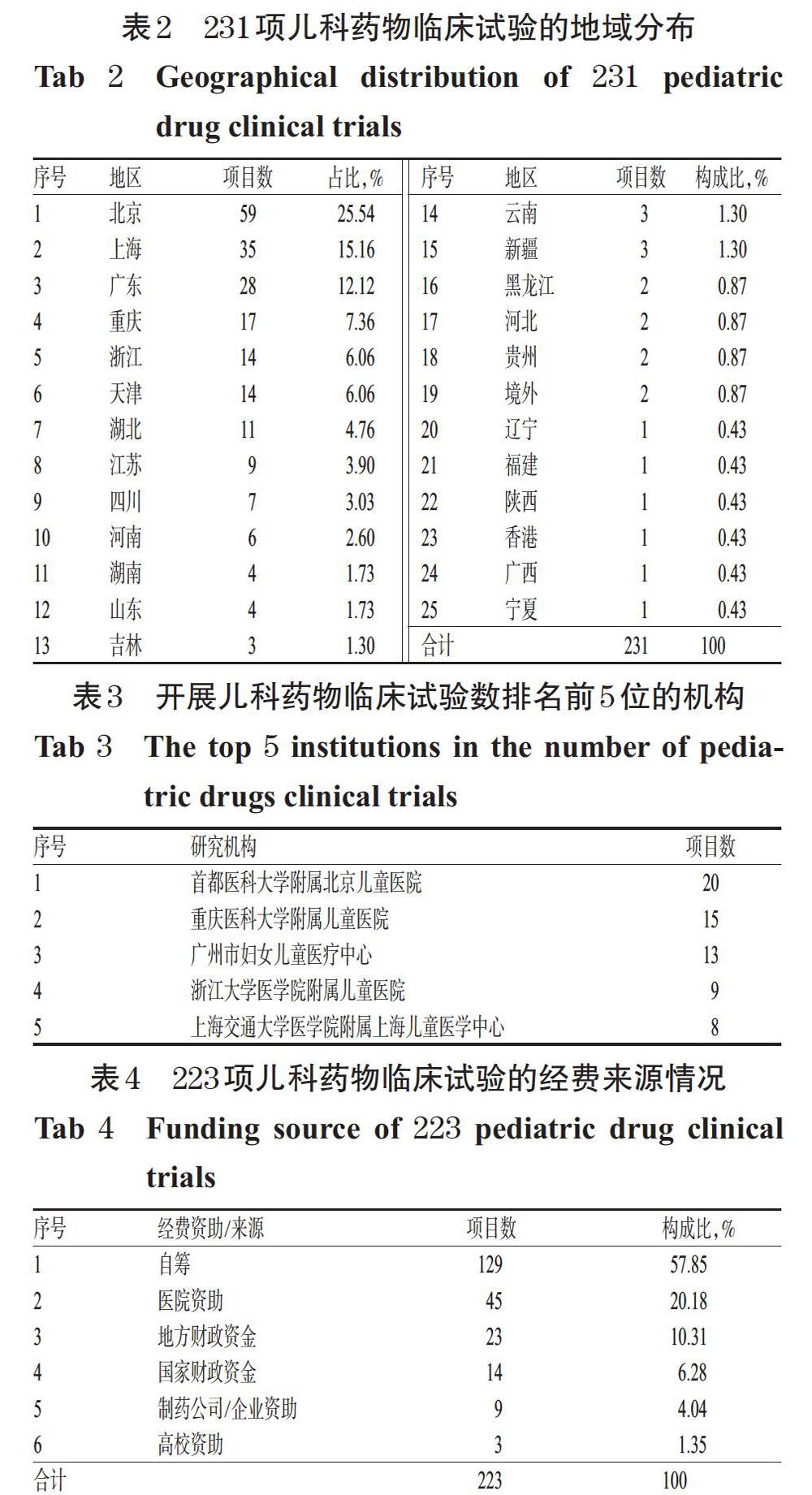
2.5 地域分布
按临床试验项目的组长单位(即主要负责实施的单位)所在地区统计231项儿科药物临床试验的地域分布情况,详见表2。由表2可见,研究注册数较多的前5位地区分别为北京、上海、广东、重庆、浙江,且上述5个省市的临床试验项目数共占纳入临床试验项目总数的66.23%(153/231)。进一步分析开展儿科药物临床试验项目数排名前5位的机构,详见表3。
2.6 经费来源
纳入的231项儿科药物临床试验中,有223项(96.54%)注明了经费来源情况,经费来源分别为自筹、医院资助、地方财政资金、国家财政资金、制药公司/企业资助和高校资助,详见表4。
2.7 研究类型
按照Chi CTR网站关于临床试验研究类型的划分标准,临床研究类型包括干预性研究、观察性研究、病因学/相关因素研究、基础科学研究、流行病学研究、预防性研究、治疗研究、预后研究等8个类别。231项儿科临床试验项目的研究类型分布详见表5。其中,干预性研究和观察性研究项目数共占总项目数的88.31%(204/231)。值得一提的是,在139项干预性研究中,有4项为横断面研究、2项为队列研究,经笔者分析可能为注册人选填错误,因为队列研究及横断面研究应属观察性研究类型;65项观察性研究中,有16项为单臂研究,经笔者分析亦可能为选填错误,因为单臂研究应属于干预性研究。故经笔者校正,231项研究中有149项为干预性研究、55项为观察性研究。
2.8 数据管理委员会设置情况
231项儿科药物临床试验中,有74项(占32.03%)研究设置了数据管理委员会,大部分(145项,占62.77%)的研究暂未确定是否设置数据管理委员会,而另有12项(占5.19%)研究明确说明未设置数据管理委员会。
2.9 征募研究对象情况
231项儿科药物临床试验中,94项(占40.69%)研究正在招募受试对象,78项(占33.77%)研究已经结束招募,59项(占25.54%)研究尚未开始招募。
2.10 伦理委员会批准情况
231项儿科药物临床试验中,有201项(占87.01%)研究通过了相关机构的伦理委员会审查,30项(占12.99%)研究尚未通过伦理委员会的审查。
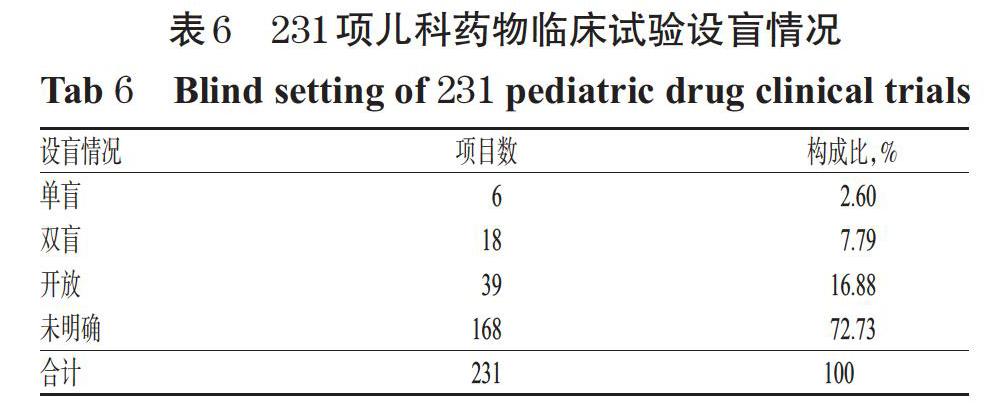
2.11 设盲情况
231项儿科临床试验中,设盲情况共分为3个类别:单盲、双盲、开放。因“设盲”项为研究注册的非必填项,有168项研究未明确是否采用盲法。231项儿科药物临床试验详见表6。
2.12 采集的人体标本类别及标本去向
231项儿科药物临床试验中,有133项(占57.58%)研究采集了人体标本,所采集的人体标本类别主要有血液、尿液、大便、骨髓、唾液等,其中大部分(110项,占82.70%)研究采集的人体标本去向为使用后销毁,详见表7、表8。
3 讨论
3.1 我国研究者的临床试验注册观念逐步建立
临床试验注册是实现临床试验信息透明、提高临床研究质量的有效方法,完整、规范地填写注册信息对提高研究过程的透明度和研究者间的相互交流具有极大的促进作用[4]。我国临床试验注册虽然启动较晚,但临床试验注册正在经历从无注册观念到建立注册观念,再过渡到规范注册的过程[5]。由上文分析数据可见,Chi CTR在册的儿科药物临床试验数量呈现逐年递增的趋势,特别在2016-2019年,注册数目明显增多。Chi CTR规定,临床试验注册的时限为招募第1个受试者之前完成注册,本研究发现,在Chi CTR注册的231项儿科药物临床试验项目中,有179项(77.49%)试验的注册状态为预注册,反映出我国研究者已意识到及时注册试验项目的重要性。然而,实际注册情况仍不容乐观:赵宏杰等[6]统计了中国科学引文数据库(CSCD)收录的影响因子排名前20位的医学期刊发表的临床研究,结果显示,2016-2017年间发表的随机对照试验中,仅有4.8%报告了方案注册信息。可见,我国儿科药物临床研究的注册数量虽逐年增加,但仍有较多临床研究未及时进行注册。
3.2 我国儿科药物临床试验项目所涉疾病/系统情况
近年来,恶性肿瘤患者幼龄化趋势愈来愈明显。白血病是最常见的儿童恶性肿瘤,约占全部病例的30.9%,主要为淋巴细胞白血病(占66.7%),其次为中枢神经系统肿瘤和淋巴瘤(占9.6%)[7]。在儿科常见病中,呼吸系统疾病如肺炎,约占儿科住院患者总数的25%~65%;而小儿消化系统疾病尤其是腹泻,是仅次于呼吸系统疾病的常见病和多发病[8];另外,随着电子产品的普及,儿科群体的眼部疾病发病率也日趋升高。由上文的统计结果可知,Chi CTR在册的儿科药物临床试验项目研究的疾病集中在肿瘤及瘤样病变、眼科疾病、变态反应性疾病、消化系统疾病、呼吸系统疾病等疾病/系统。这些研究的内容与我国临床实际工作中的儿童常见病、多发病吻合。
3.3 我国儿科药物临床试验项目地域分布情況
我国儿科药物临床试验项目数排前5位的地区分别为北京、上海、广东、重庆、浙江,多为经济发达的省市,其项目数共占注册临床试验总数的66.23%(153/231);且中国医院竞争力排行榜[6]靠前的医疗机构开展的临床试验项目较多(如表3所示)。这提示我国儿科人群药物临床试验注册存在较大的地域不均衡性,且与经济发达程度和医疗机构的技术水平密切相关。
3.4 我国儿科药物临床试验项目经费来源情况
由上文的统计结果可知,在Chi CTR注册的我国儿科药物临床试验经费主要来自自筹、医院资助和地方财政资金,以上3类经费来源构成比达88.31%。进一步分析发现,这3类经费来源的研究项目多数由临床医师作为研究者发起。临床医师发起试验项目的目的多是为了探索和研究更好的治疗方案,其研究范围(例如不同的药物治疗方案比较、上市药物新用途等)也常常与制药企业发起的药物临床研究有所不同。由此可见,在我国儿科药物临床试验领域中,临床医师作为研究者发起的临床研究已成为重要的组成部分,与制药企业发起的药物临床研究互为补充,可更好地推进儿童用药研究的深度和广度,为患儿带来更多临床获益[9]。
3.5 我国儿科药物临床试验项目的数据管理委员会设置情况
数据管理委员会是指由研究发起者设立的独立的数据管理机构,用于定期对临床试验的进展、安全性数据和重要的有效性终点进行评估,并向研究者建议是否继续、调整或者停止试验[10]。数据管理委员会主要负责试验的安全性管理、有效性管理、试验质量管理、试验设计调整建议、多区域临床试验的区域疗效评估等。在临床试验中,是否需要设立数据管理委员会,可视研究项目的具体需求而定。例如,对于大多数探索性早期试验、没有重大安全性问题的短期研究,可能不需要设立专门的数据管理委员会;而对确证性临床试验,特别是大样本、安全性风险高、包含适应性特征的复杂设计,或者观察周期较长的临床试验,设立数据管理委员会就显得非常必要[11]。本研究发现,在Chi CTR注册的儿科药物临床试验中大部分(145项,占62.77%)的试验项目暂未确定是否设置数据管理委员会,可能与研究者未能正确认识数据管理委员会在研究中所起的重要作用有关,也可能与本研究纳入的项目中多数项目处于预注册状态、提交注册时尚未确定是否需要设置数据管理委员会有关。
3.6 我国儿科药物临床试验项目伦理审查情况
伦理委员会的职责是保护受试者合法权益,维护受试者尊严,促进生物医学研究规范开展。对风险较大或者比较特殊的涉及人体的生物医学研究伦理审查项目,伦理委员会可以根据需要邀请独立顾问协助,提供咨询意见。伦理委员会还负责对已开展的临床试验项目进行持续的跟踪审查,确保随着项目的研究进展,受试者未置于不合理的风险之中[10]。Chi CTR网站要求,在注册时未获得伦理委员会批准的项目,应在注册完成后尽快上传伦理审查批件,并且只有在伦理审查批准后才可以筛选/纳入受试者。本研究纳入的231项儿科药物临床试验中,有201项通过了研究中心的伦理委员会审查,但仍有30项未通过伦理委员会的审查。
3.7 临床试验采集的人体标本类别及去向
2020年新出版的《药物临床试验质量管理规范》明确规定:禁止实施与伦理委员会同意的试验方案无关的生物样本检测(如基因检测等);临床试验结束后,剩余标本的继续保存或者将来可能被使用等情况,应当由受试者签署知情同意书,并说明保存的时间和数据的保密性问题[10]。血液、骨髓、唾液属于含有人体基因组、基因等遗传物质的生物样本。国家支持合理利用人类遗传资源开展科学研究、发展生物医药产业、提高诊疗技术,但同时要求在使用过程中维护国家安全和社会公共利益。若研究项目涉及采集、保藏、利用、对外提供我国人类遗传资源,应当遵守并执行《人类遗传资源管理条例》。本研究中,有133项(占57.58%)研究采集了人体标本,所采集的人体标本类别主要有血液、尿液、大便、骨髓、唾液等,采集的人体标本去向主要为使用后销毁,仅有4项研究未明确标本去向,表明我国研究者总体较为重视试验采集标本的管理。
3.8 本研究的局限性
本研究具有一定的局限性。其一,仅从Chi CTR 网站收集了目前在册的我国儿科药物临床试验的数据,未纳入注册于其他平台的在我国开展的儿科药物临床试验,因此所得结果结论可能无法全面反映我国儿科药物临床试验的注册情况及开展情况;其二,由于Chi CTR平台由注册者自行填报,平台不能对所有注册信息进行核實,存在数据缺失和填写错误的情况,可能影响本研究部分结果与结论的稳定性。
4 结语
综上所述,注册于Chi CTR的儿科药物临床试验注册数量呈逐年递增趋势,但存在地域不均衡性;我国研究者的药物临床试验注册观念正逐步建立,且已意识到数据管理对研究质量的重要性,对采集的试验标本的管理也较为规范。但部分研究者在临床试验注册时存在资料填写错误、不完整的情况。建议相关部门加大对临床试验注册的宣传,完善临床试验注册管理制度,相关研究者应提高临床试验注册意识,规范进行注册申报和试验项目管理,以促进儿科药物临床试验的高质量开展和儿科人群用药的开发与应用。
参考文献
[ 1 ] 国家食品药品监督管理总局.儿科人群药物临床试验技术指导原则[S]. 2016-03-07.
[ 2 ] 周江华,董碧蓉.通过推进注册提升临床试验研究质量[J].现代临床医学,2016,42(6):469-470.
[ 3 ] 苏艳玲,全柳柳,杨梓钰,等.中国临床试验注册中心注册高血压临床试验的特征分析[J].中国循证医学杂志,2018,18(10):1114-1117.
[ 4 ] 吴泰相,米娜瓦尔·阿不都,卞兆祥,等.基于临床试验注册信息调查影响我国临床试验质量的因素[J].中国循证医学杂志,2018,18(6):526-531.
[ 5 ] 张欣,黄锣,陶丹,等.注册于中国临床试验注册中心的放射治疗临床试验特征分析[J].上海交通大学学报(医学版),2019,39(7):789-794.
[ 6 ] 赵宏杰,张俊华,郭利平,等.我国高影响因子中文医学期刊发表随机对照试验注册、伦理、知情同意报告现状及质量评价分析[J].中国循证医学杂志,2018,18(7):97- 101.
[ 7 ] 胡亚美.诸福棠实用儿科学[M]. 8版.北京:人民卫生出版社,2015:2339.
[ 8 ] 毛萌.儿科学[M].北京:高等教育出版社,2007:242、288.
[ 9 ] 杨志敏,耿莹,高晨燕.对研究者发起的临床研究的认识和思考[J].中国新药杂志,2014,23(4):387-390.
[10] 国家药品监督管理局.国家药监局 国家卫生健康委关于发布药物临床试验质量管理规范的公告(2020年第57号)[Z]. 2020-04-26.
[11] 国家药品监督管理局药品审评中心.临床试验数据监查委员会指导原则:征求意见稿[Z]. 2019-09-25.
(收稿日期:2020-02-24 修回日期:2020-08-03)
(编辑:孙 冰)
