NELL2a在斑马鱼神经丘的表达及其突变模型构建*
2020-09-17陈二方邱阳王人凤刘珍珍石力查定军邱建华
陈二方 邱阳 王人凤 刘珍珍 石力 查定军 邱建华
NELL2(Nel -like type 2 molecule),又称尼尔样2型分子,是一种神经元特异性分泌蛋白,主要在大脑的海马和皮层的神经元中表达,其主要功能是促进神经元的存活和分化[1]。而在哈佛大学内耳基因库检索发现NELL2在内耳也有表达,本课题组前期实验证实NELL2主要表达于耳蜗毛细胞和螺旋神经节细胞[2]。此外,课题组在一个常染色体显性遗传性非综合征型听神经病谱系障碍(auditory neuropathy spectrum disorder,ANSD)家系中,通过全外显子测序和基因连锁分析,也发现了NELL2基因[3],鉴定发现NELL2基因第45 097 607位碱基发生杂合突变,导致NELL2蛋白第457位氨基酸由半胱氨酸(Cys/C)突变为苯丙氨酸(Phe/F)。由此推测NELL2的C457F突变可能导致其结构发生改变,从而导致NELL2保护神经元的功能改变或丧失,最终诱导非综合征型ANSD的发生。
为进一步探讨NELL2在非综合征型ANSD发生发展中的作用及机制,本实验通过CRISPR/Cas9基因编辑技术[4],初步尝试构建NELL2a基因敲除的斑马鱼模型,并比较NELL2a基因在AB野生型斑马鱼和基因敲除斑马鱼中的表型变化,为下一步阐明NELL2在听觉形成中的作用及ANSD的遗传学检测等提供实验依据。
1 材料与方法
1.1实验材料
1.1.1实验动物 AB品系野生型斑马鱼来自西京医院耳鼻咽喉头颈外科全军航空航天医学内耳研究重点实验室,并在本实验室传代;斑马鱼在28.5 ℃恒温环境中生长,光照时间:黑暗时间为14:10,胚胎用egg water培养,养殖方法按照《Zebrafish Book》(http://www.zfin.org)常规进行。
1.1.2质粒 Cas9 mRNA表达质粒pGH-T7-zCas9[5, 6],用来构建gRNA表达质粒的骨架载体gRNA-pMD19-T[7],购自武汉国家斑马鱼资源中心。
1.2实验方法
1.2.1整胚原位杂交 RNA探针制备:斑马鱼成鱼剪尾鳍,用RNA提取试剂盒(RNeasy Micro kit,Qiagen, Cat No./ID: 74004)提取总RNA,然后用QuantiTect Rev. Transcription Kit(Qiagen,Cat No./ID: 205310)将其反转录成cDNA。设计引物,扩增目的片段,克隆到体外转录载体pGEM-T Easy Vector(promega,cat.no.A1360)上。通过体外转录获得斑马鱼反义RNA探 针 ,用NucAwayTM Spin Column(invitrogen,AM10070)纯化探针。收集斑马鱼胚胎,用4%多聚甲醛固定,杂交步骤参照文献进行[8]。
1.2.2gRNA靶位点引物设计 在CRISPR/Cas9靶位点设计网站zifit(http://zifit.partners.org/ZiFiT/CSquare9Nuclease.aspx)寻找符合以下要求的gRNA靶位点:①靶点位于翻译起始密码子ATG之后和基因编码序列全长2/3之前的区域,不要选择5-UTR和3-UTR区域;②最好能破坏重要的结构域或所有的转录本;③如果基因含有多个外显子,可能在第一个起始密码子的下游还存在额外的具有相同阅读框的起始密码子,故最好不要在第一个外显子上选择靶点,同时也要避免在最后一个外显子上选择靶点;④如果基因含有多个转录本,最好在其共有外显子区域选择靶点;⑤靶点可设计在外显子和内含子的交界处,打靶破坏掉基因的剪接;⑥避免选择含“TTTT”转录终止序列的靶点。
1.2.3gRNA模板合成 gRNA scaffold克隆到pMD 19-T vector (TakaRa; cat#D102A)(Amp-resistant)。gRNA 模板的合成通过PCR的方式获得,设计引物如下Forward-Primer:TGTAATACGACTCACTATA-gGTCATGACTTCTGTG-GTTTTAGAGCT-AGAAATAGC,Reverse-Primer:AAAAAAAGCACCGACTCGGTGCCACT。PCR体系(50 μl)配制如下: 5×PCR buffer 10 μl,质粒DNA (50 ng/μl) 1 μl,Forward Primer (10 μM) 2 μl,Reverse-Primer (10 μM) 2 μl,Taq DNA Polymerases 1 μl,dNTP 4 μl,H2O 30 μl。PCR程序设置如下:①98 ℃ 5 mins;②98 ℃ 10,65 ℃ 15,68 ℃ 1 min,35 cycles;③72 ℃ 7 mins;④4 ℃ ∞;使用Fermentas GeneJETTMPCR Purification Kit对PCR产物进行纯化。
1.2.4体外转录合成gRNA和Cas9 mRNA ①制备gRNA: 用T7 RNA Polymerase (NEB; cat#M0251S)体外合成 gRNA;体外转录体系(20 μl)配制:2.5 mM NTP 4 μl,10× Reaction Buffer 2 μl,gRNA template 0.5~1 μg,T7 RNA Pol 2 μl,Nuclease-free water补足20 μl;37 ℃水浴孵育一个小时以上;用SigmaSpinTMSequencing Reaction Clean-Up(S5059-70EA),对体外转录产物进行纯化。②制备Cas9 mRNA:首先用XbaI (NEB; cat#R0145T),对pGH-T7-zCas9质粒进行线性化,酶切体系如下:DNA (10 μg),10×cutsmart,10 μl, XbaI 40 U, H2O补足100 μl;37 ℃,水浴放置3~5 h;然后用Fermentas GeneJETTMPCR Purification Kit,对酶切产物进行回收;体外转录体系(20 μl)配制:2×NTP/CAP 10 μl,10×Reaction Buffer 2 μl,linear template DNA 0.5~1 μg,Enzyme Mix 2 μl,Nuclease-free water补足20 μl;37 ℃水浴2~2.5 h;然后使用Ambion mMESSAGE mMACHINE kit,纯化Cas 9 mRNA纯化。
1.2.5显微注射制备F0代斑马鱼 将gRNA、Cas9mRNA按照合适的浓度和10%酚红混匀后,共同注射到单细胞期的野生型斑马鱼胚胎卵黄囊中。每颗受精卵注射量为1~2 nl,留取适量同批未注射的胚胎作为对照。
1.2.6检测gRNA效果 待胚胎发育至24 h后,分别收集对照组和显微注射组胚胎各20枚,用FOREGENE Zebra Fish Direct PCR Kit(Cat.No.TP-01412)提取基因组,设计引物如下Forward-Primer:5′-AGTGAAGTTTCTCCTCCTGACG-3′Reverse-Primer: 5′-CTCAACTTTGATCATCAGCTGTG-3′。PCR,扩增靶序列,送测序(北京擎科新业生物技术有限公司)确认突变。如果测序峰图显示在靶位点附近,对照组为干净的单一峰,而显微注射组出现双峰或套峰,则能确定该gRNA有效,可以造成斑马鱼NELL2a基因突变。
1.2.7筛选有可遗传突变的NELL2a F0代斑马鱼 F0代斑马鱼饲养至性成熟后(约3个月)即可进行阳性个体的筛选和传代,取10~15条成鱼与野生型成鱼侧交,注意此处需一对一交配,分别收集胚胎,单独培养。待胚胎发育至24 hpf后,即可每组随机挑选10枚胚胎,低温用研磨棒研磨,用Foregene(Zebra Fish Direct PCR Kit)提取基因组DNA,作为模板,经PCR扩增后,送测序。如果在靶位点附近测序峰图出现双峰或套峰,说明该条鱼的突变发生在原始生殖细胞,可遗传到F1代。如果靶位点附近的测序峰图为干净的单一峰,说明突变发生在体细胞,不能遗传到F1代,则把该条鱼淘汰。选取有可遗传突变的F0代成鱼与野生型斑马鱼侧交,收集胚胎,标准条件下培养,用于筛选携带可遗传突变的F1斑马鱼。
1.2.8获得携带可稳定遗传的NELL2a杂合突变斑马鱼品系 将获得的F1代斑马鱼饲养到1~2月龄,对每条鱼分别剪尾鳍后,提取基因组DNA,作为模板,利用鉴定引物PCR扩增后,送测序。剪尾鳍后的每条鱼独立养殖;如果在靶位点附近出现双峰,说明该条鱼为NELL2a杂合突变。随后可以将杂合突变的PCR产物,做TA克隆,确定每条鱼的具体突变类型。选取可造成NELL2a基因移码突变的F1代杂合(NELL2a+/-)成鱼,与野生型斑马鱼侧交,后代经过剪尾鳍,测序筛选,获得批量可稳定遗传的F2代NELL2a+/-斑马鱼。待F2代NELL2a+/-斑马鱼性成熟后,将雌鱼与雄鱼自交,获得NELL2a纯合突变斑马鱼(NELL2a-/-)。
1.2.9NELL2a-/-斑马鱼的听觉诱发电位(AEP)检测 采用斑马鱼AEP检测水箱,应用美国TDT公司RZ6仪器检测和记录15条4月龄斑马鱼的AEP,将斑马鱼分为2组:野生型(WT)斑马鱼,6条; NELL2a-/-斑马鱼9条。因为斑马鱼听力最佳范围在600~1 000 Hz[9],本实验检测频率为600、800、1 000和2 000 Hz。
2 结果
2.1NELL2a基因在斑马鱼侧线神经丘表达 探针设计如下:NELL2a-ISH-up:CTTCAGTGCGAACGGAGAGT,NELL2a-ISH-down:CCGTGTTCGTCTATGCAGGT。原位杂交结果示NELL2a基因在斑马鱼侧线神经丘有表达(图1)。
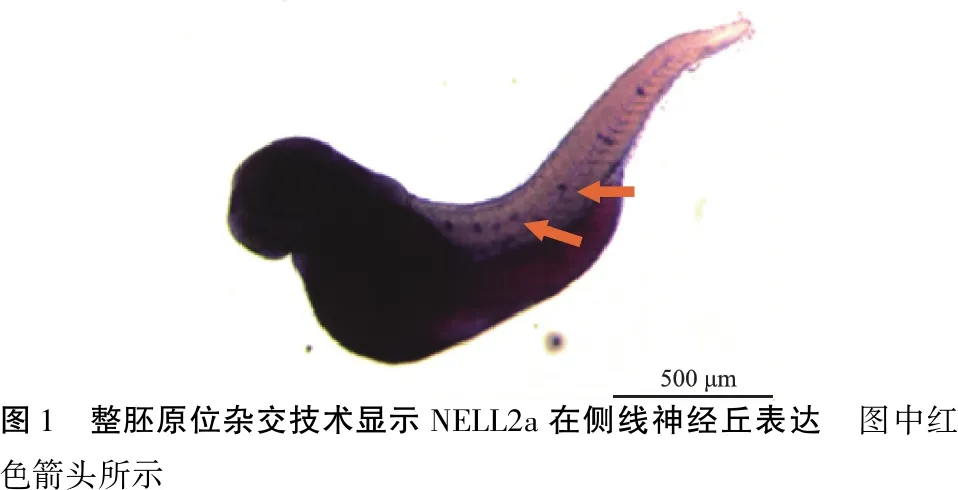
图1 整胚原位杂交技术显示NELL2a在侧线神经丘表达 图中红色箭头所示
2.2gRNA靶位点选择 根据gRNA设计要求,从候选序列中选择第12Exon设计了gRNA的靶点,序列为5′-gGTCATGACTTCTGTG-3′。gRNA突变鉴定引物,Forward-Primer:(Nell2a-PF2)5′-AGTGAAGTTTCTCCTCCTGACG-3′,Reverse-Primer:(Nell2a-PR2)5′-CTCAACTTTGATCATCAGCTGTG-3′,产物长度为473 bp,可通过PCR产物,送测序,检测斑马鱼突变。
2.3gRNA效果检测 分别收集F0代斑马鱼及对照组斑马鱼胚胎,提取基因组DNA,经PCR扩增后,送测序发现gRNA有效(图2);同时收集足够数量的胚胎,饲养用于筛选有可遗传突变的F0代斑马鱼。
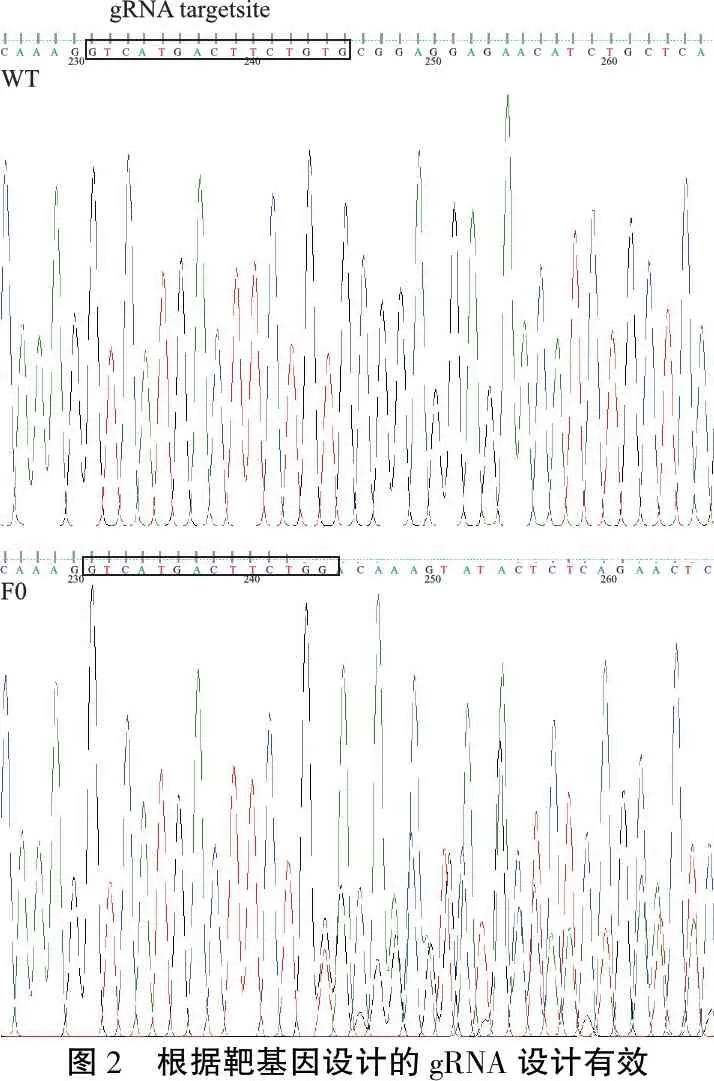
图2 根据靶基因设计的gRNA设计有效
2.4获得稳定遗传的NELL2a+/-斑马鱼 F1代斑马鱼经TA克隆,筛选出三种可遗传的NELL2a基因突变类型,分别为基因组缺失4个碱基(Δ4)的一种和2种基因组缺失2个碱基(Δ2)的NELL2a+/-突变(图3)。Δ4缺失4个碱基,导致后面的阅读框移码,并使得第17号外显子上编码缬氨酸的密码子突变成终止密码子,造成整个蛋白质翻译提前终止,原有蛋白功能丧失,从而实现基因敲除的目的(图3a)。Δ2缺失2个碱基,导致后面的阅读框移码,并使得第18号外显子上编码异亮氨酸的密码子突变成终止密码子,造成整个蛋白质翻译提前终止,原有蛋白功能丧失,从而实现基因敲除的目的(图3b、3c)。

图3 通过CRISPR/Cas9技术获得3种基因突变杂合子 a. ΔTGCG4碱基缺失杂合子; b. ΔGC 2碱基缺失杂合子; c. ΔCG2碱基缺失杂合子
2.5获得稳定遗传的NELL2a-/-斑马鱼 将获得的NELL2a+/-(ΔGC)的斑马鱼自交,胚胎养至≥2月,剪尾鳍,提取基因组DNA,送测序,获得NELL2a-/-纯合突变斑马鱼(图4)。NELL2a-/-成鱼与野生型斑马鱼侧交得到的NELL2a+/-(ΔGC)、NELL2a-/-成鱼自交获得NELL2a-/-(ΔGC)表型均和野生型无异(图5)。
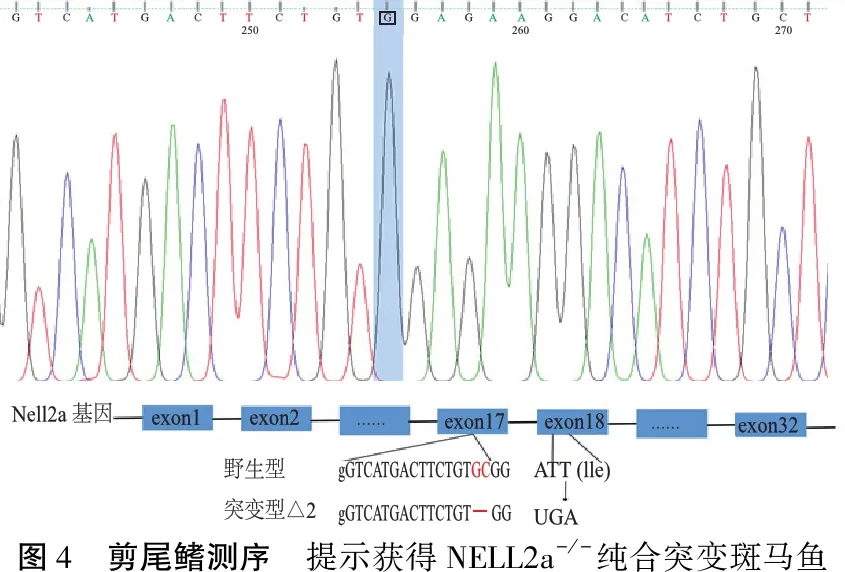
图4 剪尾鳍测序 提示获得NELL2a-/-纯合突变斑马鱼

图5 2dpf斑马鱼内耳发育 a. AB品系; b. NELL2a+/-(ΔGC); c. NELL2a-/-(ΔGC)
将获得的NELL2a+/-(ΔTGCG)的斑马鱼自交,胚胎在24 hpf内和野生型表型无明显差异,24 hpf后后代出现畸形,包括体轴弯曲、心肌包水及耳石异常(图6、7),胚胎发育至3 dpf开始死亡,7 dpf几乎完全死亡,因此无法获得NELL2a-/-(ΔTGCG)纯合子。

图6 野生型及NELL2a+/-(ΔTGCG)斑马鱼的发育过程 左图示野生型斑马鱼发育过程;右图示NELL2a+/-(ΔTGCG)斑马鱼发育,可见从48 hpf开始出现畸形
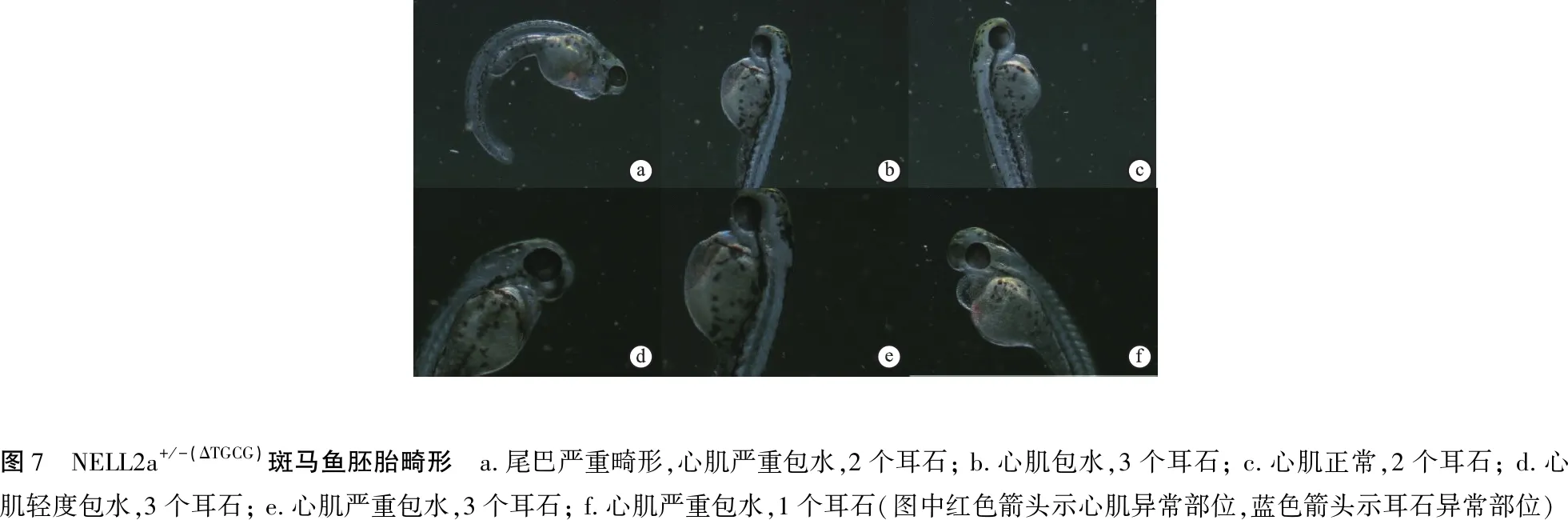
图7 NELL2a+/-(ΔTGCG)斑马鱼胚胎畸形 a.尾巴严重畸形,心肌严重包水,2个耳石; b.心肌包水,3个耳石; c.心肌正常,2个耳石; d.心肌轻度包水,3个耳石; e.心肌严重包水,3个耳石; f.心肌严重包水,1个耳石(图中红色箭头示心肌异常部位,蓝色箭头示耳石异常部位)
2.6斑马鱼的AEP检测结果 NELL2a-/-斑马鱼在600、800、1 000和2 000 Hz声刺激频率,其AEP的阈值均显著高于野生型斑马鱼(表1)。
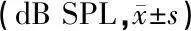
表1 不同品系斑马鱼各频率AEP阈值
3 讨论
听神经病的病因很广泛,致病机理尚不明确,可以有先天或后天的原因,可能包括早产、高胆红素血症、缺氧、先天性脑异常、耳毒性药物暴露和遗传因素等[10],亟待建立动物模型,进行进一步研究。有研究对ANSD家系患者进行测序分析发现NELL2基因的45 097 607位碱基发生杂合突变,同时基因库的数据也显示内耳存在NELL的表达。NELL2是一种特异性的分泌型的糖蛋白,由神经元分泌,在神经元的分化中起到重要作用;已有的研究证实NELL2在谷氨酸神经元上表达较多,谷氨酸神经元通过谷氨酸受体发挥作用,这种调节机制也存在于听觉系统中[11]。对小鼠的研究发现NELL2在耳蜗结构成熟与发育过程中起到重要作用,随着发育的进行,Corti器上的NELL2蛋白逐渐积累[12]。上述研究结果表明NELL2在内耳及听力发育过程及生理功能中起重要作用,因此建立NELL2a的基因突变模型对研究其在听力发育及障碍中的作用至关重要。
斑马鱼侧线系统(lateral line system,LL)是由皮肤衍生的机械感受器官,具有感觉周围环境中的水流、强度以及方向等功能,便于探测到身体不同区域水流的差异[13]。侧线系统以神经丘为基本单位,分为前部侧线系统和后部侧线系统,成熟的神经丘包括位于中间的功能性毛细胞和周围的支持细胞及mentle 细胞构成[14, 15],侧线神经丘毛细胞在结构和功能上与哺乳动物内耳毛细胞几乎相同,都是通过立体纤毛的偏转来感知运动[16],是研究毛细胞发育、凋亡及再生的重要模型。NELL2 mRNA在大鼠胚胎期主要表达在中枢神经系统,出生后主要表达在脑组织的神经元内,与粗糙内质网相伴存在[17],其功能可以参与神经生长与分化,参与突触的形成和囊泡释放以及下丘脑促性腺激素释放激素(GnRH)的分泌[18]。
本研究通过整胚原位杂交技术,证明了NELL2基因在斑马鱼侧线神经丘有表达;通过CRISPR/Cas9基因编辑技术,获得了2种2 bp缺失(ΔGC、ΔCG),1种4 bp缺失(ΔTGCG),3种均导致基因移码突变,使翻译提前终止,蛋白丧失原有的功能。然而2 bp缺失斑马鱼仔鱼内耳发育正常,4 bp缺失斑马鱼则出现体轴弯曲、心肌包水及耳石异常等畸形,具体的机制有待进一步探讨。
