氧自由基在纳米细菌致肾结石形成过程中的作用
2020-09-16王敬珅郝志强李永乐郑丽英王艳军张志强
王敬珅,郝志强,杨 恒,汪 渊,李永乐,钱 彪,郑丽英,冷 欣,王艳军,张志强
(1石河子大学医学院,新疆 石河子 832000;2赣南医学院第一附属医院泌尿外科,江西 赣州 341000;3赣南医学院第一附属医院科研管理科,江西 赣州 341000;4新疆生产建设兵团第九师医院泌尿外科,新疆 塔城 834601;5新疆生产建设兵团第十三师红星医院泌尿外科,新疆 哈密 839000;6新疆生产建设兵团第七师医院泌尿外科,新疆 奎屯 833200)
纳米细菌(Nanobacteria,NB)是直径为纳米级的革兰阴性菌,呈球杆状,无荚膜和鞭毛[1-3]。Kajander研究发现95%以上肾结石患者的血液、尿液和结石中存在NB[4]。由于体内NB的清除是通过肾脏完成的,且NB具备生物矿化能力,可黏附血液中的钙磷离子形成结石,因此,关于NB与肾结石形成的研究越来越成为热点[5-7]。
褚浩等证明了NB可通过早期损伤肾脏诱导结晶形成[8]。肾小管损伤是结石形成的重要原因,损伤后基底膜暴露于小管液中,细胞的晶体黏附性明显增强,细胞与细菌的黏附量增加,从而形成结石[7,9]。刘鑫总结认为是氧自由基介导肾小管上皮细胞结构改变,胞膜破坏,细胞碎片脱落入管腔,促进了钙盐晶体的聚集、成核和生长[10]。本试验研究探讨氧自由基与肾结石形成的关系,并探究四环素是否有助于肾结石的防治。
1 材料与方法
1.1主要试剂及仪器:人肾小管上皮细胞HK-2购自武汉大学保藏中心。DMEM培养基,1640培养基,胎牛血清,PBS缓冲液,一水草酸钙(Calcium oxalate monohydrate,COM),纳米级羟基磷灰石(Nanograde hydroxuapatite,nHAP),四环素,过氧化氢(H2O2)试剂盒、丙二醛(MDA)试剂盒、乳酸脱氢酶(LDH)试剂盒、Na+/K+ATP酶试剂盒、Ca2+/Mg2+ATP酶试剂盒,phalloidin-FITC。细胞孵育箱,倒置相差显微镜,透射电子显微镜,激光扫描共聚焦显微镜,酶标仪。本次研究经过本院医学伦理委员会同意。
1.2NB培养与鉴定:于新疆石河子大学医学院第一附属医院泌尿外科收集临床确诊肾结石且未应用药物或手术治疗患者的尿液,将无菌条件下获得的尿液2 ml用生理盐水稀释5倍,4℃离心45 min(14 000 g);取管底2 ml混匀,以0.45 μm滤纸过滤后,再以生理盐水稀释5倍,4℃离心45 min(14 000 g);取管底1 ml液体充分混匀后,经0.22 μm的滤纸加压过滤。将滤液1 ml注入含DMEM培养液、10%γ-FBS和1%HEPES缓冲液的细胞培养瓶中,37℃、5% CO2条件下培养,5~7 d换1次液。倒置相差显微镜观察NB生长,筛选出无污染的标本,用吸管吹打均匀后,吸入EP管。12 000 r/min,离心20 min,弃上清液,再加入无菌注射用水1.5 ml吹打混匀。重复上面步骤共计清洗NB 3次,应用透射电镜扫描(负染法)鉴定。
1.3实验分组:选取HK-2细胞,随机分为五组,空白对照组(胎牛血清、1640培养液+HK-2细胞),NB组(NB菌液、胎牛血清、1640培养液+HK-2细胞),一水草酸钙(Calcium oxalate monohydrate,COM)组(5 mmol/L COM悬液、胎牛血清、1640培养液+HK-2细胞),纳米级羟基磷灰石(Nanograde hydroxuapatite,nHAP)组(nHAP、胎牛血清、1640培养液+HK-2细胞)和四环素组(四环素、NB菌液、胎牛血清、1640培养液+HK-2细胞)。
1.4各组细胞透射电子显微镜观察:分别于6 h、12 h、24 h提取各组细胞制成细胞悬液,离心后转移至EP管内,PBS浸泡10 min后弃上清;加入预冷的3%戊二醛固定2 h,PBS洗2次,3 min/次;再加入1%锇酸固定2 h,PBS洗2次,3 min/次;梯度酒精脱水,经Epon812:环氧丙烷=1∶1浸透,包埋后80℃聚合过夜。行超薄切片、染色。于透射电子显微镜下观察细胞形态与超微结构变化。
1.5细胞损伤因子指标检测:分别在6 h、12 h、24 h取各组细胞上清液,按照试剂盒说明书分别检测H2O2、MDA、LDH含量;向吸尽培养液的细胞中加入0.25%胰蛋白酶并反复吹打将细胞消化,转移至EP管中,分别加入PBS缓冲液400 μl。用超声粉碎机粉碎,ATP酶试剂盒比色法测定各组细胞Na+/K+ATP酶和Ca2+/Mg2+ATP酶活性。
1.6激光共聚焦显微镜检测晶体滞留实验:将HK-2细胞接种于铺有清洁盖玻片的24孔板内,共同培养6 h、12 h、24 h后取出各组样本,加入COM悬液(每孔内COM浓度200 mg/L),轻摇5~10 s,使COM晶体与底部细胞充分接触。3 min后吸净盖玻片上方液体,加入饱和草酸钠溶液漂洗3次。将盖玻片从孔板中取出,4%多聚甲醛固定20 min,PBS洗2次,5 min/次,摇床轻晃;加入5 mg/L的phalloidin-FITC 50 μl,室温避光孵育20 min;PBS洗2次,5 min/次;甘油封片。在488 nm和633 nm激发光下逐一观察各组玻片并进行图像采集。
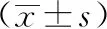
2 结果
2.1各组细胞透射电子显微镜观察结果:电镜结果见图1。实验过程中,空白对照组(图2A,B,C和D)细胞膜结构完整正常,膜外微绒毛(黑色箭头)数量丰富,排列规则;双层核膜(黄色箭头)结构正常,核周隙正常;线粒体(红色箭头)形态正常,未见肿胀或萎缩;细胞亚显微结构正常。

对照组:A,B,C,D;NB组:E,F,G,H;COM组:I,J,K,L;nHAP组:M,N,O,P;四环素组:Q,R,S,T
实验开始12 h后,NB组细胞膜结构完整,微绒毛结构稍紊乱,局部绒毛消失(黑色箭头,图2E);细胞核畸形,染色质轻度分布不均,局部染色质凝集(黄色箭头,图2E);核外膜局部区域降解(蓝色箭头,图2E);部分线粒体结构轻度肿胀,脊结构模糊不清(红色箭头,图2F);胞浆中偶见髓样小体(图2F)。nHAP组细胞膜局部区域结构破损,微绒毛结构消失(黑色箭头,图2M),绒毛结构消失;部分线粒体结构轻度肿胀,脊结构模糊不清(红色箭头图2N)。胞浆中见髓样小体(绿色箭头,图2N)。四环素组细胞膜结构完整,微绒毛结构稍紊乱,局部绒毛消失(图2Q,黑色箭头),绒毛结构消失;细胞核畸形,染色质轻度分布不均,局部染色质凝集(图2Q,黄色箭头);核外膜局部区域降解(图2R,蓝色箭头);部分线粒体结构轻度肿胀,脊结构模糊不清(图2R,红色箭头)。胞浆中偶见髓样小体(图2R,绿色箭头)。COM组细胞膜局部区域结构紊乱,微绒毛分布不均,局部区域绒毛消失(图2I,黑色箭头);细胞核染色质边集(图2I,蓝色箭头);线粒体结构正常,脊结构清晰。胞浆中偶见自噬小体。
实验开始24 h后,NB组细胞膜结构破损,胞核裸露在外(粉色箭头,图2G);微绒毛基本消失(黑色箭头,图2G),线粒体数量较少,结构肿胀,脊模糊不清(红色箭头,图2H);胞浆中可见较多髓样小体(绿色箭头,图2H),胞浆中自噬小体数量较多(棕黄色箭头,图2H)。nHAP组细胞膜结构完整,核膜结构正常;微绒毛分布不均,局部区域绒毛消失(图2O,黑色箭头);细胞核染色质边集(图2O,蓝色箭头);线粒体结构肿胀,脊模糊不清,局部区域降解(图2P,蓝色箭头)。胞浆中偶见髓样小体(图2P,绿色箭头);胞浆中可见自噬小体(图2P,棕黄色箭头)。四环素组细胞膜结构完整,微绒毛基本消失(图2S,黑色箭头);线粒体数量较少,结构肿胀,脊模糊不清(图2S,红色箭头)。胞浆中可见较多髓样小体(图2T,绿色箭头);胞浆中自噬小体数量较多(图2T,棕黄色箭头)。COM组细胞膜结构破损,微绒毛分布紊乱,绒毛消失;细胞核膜阶段性溶解,核膜结构模糊不清(图2L,蓝色箭头);线粒体结构肿胀,脊模糊不清(图2L,红色箭头)。胞浆中见髓样小体(图2L,绿色箭头)及自噬小体(图2L,黄色箭头)。

图2 激光共聚焦显示细胞晶体黏附情况(×100)
2.2各组细胞细胞损伤因子指标检测结果:如表1所示,共培养12 h和24 h后,NB组和COM组细胞的Na+/K+ATP酶和Ca2+/Mg2+ATP酶活性均低于对照组(P<0.05),而nHAP组仅在12h时低于空白对照组(P<0.05),四环素组细胞在各时间点的酶活性均高于NB组(P<0.05)。

表1 各时间点各组Na+/K+ATP和Ca2+/Mg2+ATP酶活性比较
如表2所示,在各时间点,COM组LDH含量均高于对照组(P<0.05),NB组、nHAP组、四环素组的LDH含量显著低于COM组(P<0.05)。共培养12 h和24 h后,NB组和COM组培养液中H2O2和MDA的含量显著高于对照组(P<0.05),nHAP组中H2O2和MDA的含量与对照组无明显差异(P>0.05),干扰组中H2O2和MDA的含量显著低于NB组(P<0.05)。

表2 各时间点各组培养液LDH、H2O2和MDA含量比较
2.3激光共聚焦显微镜观察结果:如图2所示,培养6 h时,NB组、COM组可观察到少量晶体黏附,随着共培养时间延长,两组细胞晶体黏附量进一步增加。共培养6 h和12 h时,nHAP组未观察到明显的晶体黏附现象,当共培养24 h时,可观察到少量晶体黏附。各时间点,干扰组中晶体黏附量均显著少于NB组。
3 讨论
肾结石发病率居高不下,大量研究证实肾结石的形成是一个复杂的过程,涉及尿过饱和度、晶体的形成和晶体的生长成熟等多种因素,其中晶体与尿上皮细胞的黏附是肾结石形成的关键步骤[5,7,9,11,12]。
本实验结果表明,NB对HK-2细胞的损伤程度与nHAP组相似(透射电镜观察和ATP酶活性检测),12 h时两组细胞膜结构完整,但NB组细胞核已经出现畸形;24 h时NB组线粒体肿胀、核膜溶解和胞核裸露的细胞数较nHAP组明显增多,NB和nHAP对细胞的损伤程度也随着作用时间而加重,主要表现为刷状缘排列紊乱,细胞膜逐渐破坏,说明NB对HK-2细胞的损伤并不仅仅是羟基磷灰石壳损伤。NB组和COM组细胞的Na+/K+ATP酶和Ca2+/Mg2+ATP酶活性均低于nHAP组,而LDH水平升高,说明细胞膜的完整性和连续性遭到破坏,NB组和COM组H2O2和MDA水平显著升高说明损伤过程有脂质过氧化反应的参与。这一结果与既往的研究结果相同,Hong Xin[7]通过比色法检测发现,在12 h和24 h,NB组CAT比对照组和nHAP组均高,在24 h时,CAT含量比COM组含量更高,MDA 和Na+/K+ATP酶活性检测结果与本文类似。因此可以认为,氧化反应介导了NB对HK-2细胞的损伤。而在激光共聚焦显微镜的观察下,随着时间的增加,NB组和COM组的晶体黏附量逐渐增高,但nHAP组未观察到明显的晶体黏附,进一步说明单纯的形成纳米羟基磷灰石壳不足形成结石,而氧化反应可能是NB损伤HK-2细胞的重要因素。目前文献[10,13]归纳氧化反应参与NB形成肾结石的依据是氧自由基通过过氧化反应增强COM晶体与细胞膜的黏附,同时可损伤线粒体,肾脏细胞损伤时发生的氧化应激反应会进一步加重肾损伤,另外氧自由基还可干扰肾小管上皮细胞膜极性,加速钙盐晶体沉积,促使结石生长。甘琼枝等[14](肾上皮细胞损伤使草酸钙晶体黏附增强的分子机制)通过共聚焦显微镜观察研究非洲绿猴肾上皮细胞(Vero)在损伤后晶体黏附分子透明质酸的表达增强,透明质酸不但可以通过静电作用力与草酸钙晶体结合,而且可以通过氢键与草酸钙中的草酸根(Oxalate)作用,导致损伤细胞对晶体的滞留能力大大增强,从而增加了结石形成的危险。
四环素是可以穿透NB的钙质外壳从而杀灭NB的抗菌药,在治疗牙周病、慢性前列腺炎等NB相关的疾病方面取得一定成效[15-16]。Shoskes[16]等探讨NB在Ⅲ型慢性前列腺炎/慢性盆腔疼痛综合征发病机制中的作用,结果表明,comET治疗[四环素+乙二胺四乙酸(EDTA)+营养素]3个月后,国家卫生研究院慢性前列腺炎症状指数显示,12例(80%)患者病情改善率达25%,其中8例(53%)指数改善率超过50%。表明四环素在治疗NB相关的慢性前列腺炎方面有效。胡卫国[17]通过尾静脉注射NB建立大鼠肾结石模型,发现四环素灌胃可以减少大鼠24 h尿LDH以及肾小管结晶数,推测四环素可能有抑制肾结石形成的作用。但目前为止,尚缺乏相关体外实验的证据。本研究通过体外共培养NB和HK-2细胞,在同一时间节点,四环素组的细胞膜损伤和线粒体肿胀程度均较NB组轻,Na+/K+ATP酶和Ca2+/Mg2+ATP酶活性的抑制程度低,晶体滞留量少,发现四环素可以抑制NB对HK-2细胞的损伤并减少损伤后的晶体滞留。这一结果进一步确认了四环素在肾结石的预防和治疗方面的有效性,对于该病在临床上的诊治具有积极的意义。
综上所述,NB导致肾结石形成的过程为:肾小管上皮细胞损伤后引起细胞膜结构发生变化,为钙盐晶体的黏附提供有效位点;同时,释放氧自由基物质,改变细胞膜结构,损伤线粒体,加重过氧化反应,干扰胞膜极性;并且,损伤后的细胞表达出透明质酸等负电荷晶体黏附分子与钙磷晶体等阳性离子结合,进一步促进了钙盐晶体的黏附、聚集和生长,最终形成结石。进一步实验研究可探讨,NB对动物或人体产生的炎性反应是否与肾结石形成相关,同时四环素能否预防早中期肾结石的进展有待进一步确定。
