miR-320e靶向调控FHIT对前列腺癌细胞增殖、凋亡的影响
2020-09-09罗清勇冯鹏张宗平
罗清勇 冯鹏 张宗平
前列腺癌占全球所有癌症病例的12%,是男性中第二常见的癌症[1]。对于前列腺癌的治疗,主要使用放射疗法或根治性前列腺切除术和激素消融疗法,然而,这些方法不能提高患者的存活率,并且近30%的患者经历了根治性前列腺切除术后复发[2],因此,与前列腺癌发生相关分子机制的全面表征是十分必要的[3],有助于提高患者的生存和增加当前治疗选择。微小RNA(microRNA,miRNA/miR)是转录后调控基因表达的小型非编码RNA,是非编码基因组的一部分。大量数据表明,miRNA是许多疾病(包括癌症)的潜在生物标志物,其异常表达与前列腺癌的潜在机制有关[4,5]。有研究用miRNA芯片技术对正常前列腺组织和前列腺癌组织进行筛选,发现miR-320e在前列腺癌组织中的表达明显上调[6,7],并发现miR-320e高表达可增强胰腺癌细胞耐药性、促进细胞增殖[8],但miR-320e对前列腺癌细胞生物学行为的影响及其机制尚不清楚。基于此,本研究以体外培养的前列腺癌细胞DU145为对象,评价miR-320e在前列腺癌细胞增殖和凋亡中的作用,并利用生物学信息预测其可能的靶基因脆性组氨酸三联体(fragile histidine triad,FHIT),旨在揭示miR-320e影响前列腺癌细胞增殖和凋亡的相关机制。
1 材料与方法
1.1 主要试剂 前列腺癌细胞DU145和前列腺正常上皮细胞RWPE-1购自中国科学院上海生命科学研究院细胞资源中心,RPMI1640培养基、胎牛血清购自美国Hyclone公司,噻唑蓝(methyl thiazolyl tetrazolium,MTT)、RIPA裂解液购自美国Sigma公司,miR-320e、anti-miR-320e、pcDNA3.1-FHIT、si-FHIT、双荧光素酶载体购自上海GenePharma公司,TRIzol、逆转录试剂盒、Lipofectamine 2000购自美国Invitrogen公司,qPCR试剂盒购自日本TaKaRa公司,SDS-PAGE蛋白上样缓冲液、双萤光素酶报告基因检测试剂盒购自上海碧云天生物技术研究所,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自美国Millipore公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、细胞周期蛋白D1(CyclinD1)、P21、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)蛋白抗体购自美国Cellular Signaling Technology公司,FHIT抗体购自Abcam公司,辣根过氧化物酶标记二抗购自博士德生物公司,Annexin V-FITC/PI细胞凋亡检测试剂盒购自江苏凯基生物公司。
1.2 细胞培养 DU145和RWPE-1细胞复苏后,加入含10%胎牛血清的RPMI1640培养基,放在73℃、5%CO2的培养箱中培养,每周换液2~3次。细胞密度为70%左右时,使用胰酶消化、传代。
1.3 实时荧光定量PCR(quantitative real-time polymerase chain reaction,qPCR)检测miR-320e表达 利用TRIzol试剂提取DU145和RWPE-1细胞总RNA,按照逆转录试剂盒说明书的指示,合成cDNA,在ABI 7500荧光定量PCR仪中检测miR-320e水平,收集Ct值,以2-ΔΔCt法计算miR-320e表达量。miR-320e正向引物序列5’-GGCCTTCTCTTCCCAGTTCTT-3’,反向引物序列5’-TCACCTTCTCAACCCAGCTTT-3’。内参U6正向引物序列5’-GCTTCGGCAGCACATATACTAAAAT-3’,反向引物序列5’-CGCTTCACGAATTTGCGTGTCAT-3’。
1.4 细胞转染 选取处于对数生长期的DU145细胞,以1×105个/ml的密度接种于6孔板。细胞密度为约70%时,根据Lipofectamine 2000试剂说明书,将miR-320e、anti-miR-320e、pcDNA3.1-FHIT、si-FHIT和相应的阴性对照转染入DU145细胞,转染4~6 h,更换为含10%胎牛血清的新鲜培养基继续培养,备用。
1.5 靶基因预测及双荧光素酶报告基因实验 TargetScan网站(http://www.targetscan.org/)预测发现FHIT的3’非编码区(3’untranslated region,3’UTR)部分碱基可与miR-320e形成互补配对。为了证实miR-320e与FHIT的靶向关系,分别构建含有miR-320e结合位点的野生型FHIT(WT- FHIT)和突变型(MUT- FHIT)3’UTR荧光素酶报告载体,并分别与miR-320e或anti-miR-320e共转染,培养48h后,检测双荧光素酶活性。
1.6 蛋白质印迹法(Western blot)检测目的蛋白表达 为检测目的蛋白表达,使用RIPA裂解液充分提取DU145细胞总蛋白,取等量蛋白样品上样,经10%的SDS-PAGE分离蛋白,转移到PVDF膜,室温条件下5%脱脂奶粉封闭1 h,加入CyclinD1、P21、Bcl-2、Bax、FHIT蛋白一抗(稀释度为1∶1 000),4℃条件下孵育过夜,次日用Tris-HCl-Tween缓冲盐溶液(Tris buffered saline with Tween,TBST)洗膜15 min,漂洗3次,加入二抗(稀释度为1∶5 000),室温条件下孵育1 h,TBST洗膜15 min,漂洗3次,加入化学发光液显影,以GAPDH作为内参,分析CyclinD1、P21、Bcl-2、Bax、FHIT蛋白表达。
1.7 MTT法检测细胞增殖 DU145细胞按5×104个/ml的密度接种于96孔板,在培养箱中分别孵育24 h、48 h、72 h,培养结束后,每孔加入20 μl MTT溶液(5 mg/ml),培养箱孵育4 h,加入150 μl二甲基亚砜,37℃摇床震荡10 min,酶标仪读取DU145细胞吸光值(波长为490 nm),以吸光值表示细胞活性(490 nm)。
1.8 细胞凋亡实验 细胞凋亡率的检测依据Annexin V-FITC/PI 细胞凋亡检测试剂盒说明书的步骤进行。转染后的DU145细胞使用胰酶消化,离心收集1×105个细胞,加入500 μl缓冲液使细胞悬浮,加入5 μl Annexin V-FITC混匀,加入5 μl PI混匀,避光反应15 min,进行流式细胞仪的观察和检测。
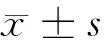
2 结果
2.1 miR-320e在前列腺正常上皮细胞RWPE-1和前列腺癌细胞DU145中的表达 qPCR检测结果发现,与前列腺正常上皮细胞RWPE-1相比,前列腺癌细胞DU145中miR-320e表达量明显升高(P<0.05)。见表1。
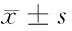
表1 miR-320e在细胞RWPE-1和细胞DU145中的表达
2.2 抑制miR-320e表达对细胞DU145增殖、凋亡的影响 在DU145细胞中转染anti-miR-320e,miR-320e表达量远低于anti-miR-NC组(P<0.05),表明成功构建抑制miR-320e表达的细胞。MTT检测细胞DU145增殖,数据显示,抑制miR-320e表达较anti-miR-NC组明显降低DU145细胞24 h、48 h、72 h时的细胞活性(P<0.05)。流式细胞术检测结果表明,抑制miR-320e表达较anti-miR-NC组明显增加细胞DU145的凋亡率(P<0.05)。Western blot测定增殖、凋亡相关蛋白表达,发现与anti-miR-NC组比较,抑制miR-320e表达明显减少Cyclin D1、Bcl-2蛋白表达量,显著提高P21、Bax蛋白水平(P<0.05)。见图1,表2、3。

图1 抑制miR-320e表达对细胞DU145增殖、凋亡的影响;A:抑制miR-320e表达对细胞DU145凋亡的影响;B:抑制miR-320e表达对细胞DU145增殖、凋亡蛋白表达的影响
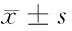
表2 抑制miR-320e表达对细胞DU145增殖、凋亡的影响
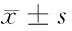
表3 抑制miR-320e表达对细胞DU145增殖、凋亡蛋白表达的影响
2.3 miR-320e靶向调控FHIT的表达 生物信息学预测结果显示,FHIT的3’UTR含有与miR-320e互补的核苷酸序列,提示FHIT可能是miR-320e的下游靶基因。双荧光素酶报告实验进行验证,结果表明,与miR-NC和WT- FHIT共转染比较,miR-320e和WT- FHIT共转染明显降低DU145细胞的双荧光素酶相对活性(P<0.05),而与miR-NC、miR-320e分别与MUT- FHIT共转染后,DU145细胞的双荧光素酶相对活性无明显变化。Western blot检测结果发现,同miR-NC组相比,miR-320e组FHIT蛋白表达量明显减少(P<0.05),anti-miR-320e组FHIT蛋白表达量比anti-miR-NC组显著增加(P<0.05)。见图2,表4、5。

图2 miR-320e靶向调控FHIT;A FHIT的3’UTR含有miR-320e的互补序列;B miR-320e调控FHIT的表达

表4 双荧光素酶报告实验

表5 miR-320e调控FHIT的表达
2.4 过表达FHIT对细胞DU145增殖、凋亡的影响 将pcDNA3.1-FHIT转染入细胞DU145,发现FHIT蛋白表达量明显高于pcDNA3.1组(P<0.05),说明过表达FHIT的DU145细胞构建成功。与pcDNA3.1组相比,过表达FHIT明显降低24 h、48 h、72 h的细胞活性(P<0.05),增加细胞凋亡率(P<0.05),减少Cyclin D1、Bcl-2蛋白表达量,而提高P21、Bax蛋白水平(P<0.05)。见图3,表6、7。

图3 过表达FHIT对细胞DU145增殖、凋亡蛋白表达的影响
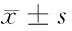
表6 过表达FHIT对细胞DU145增殖、凋亡的影响
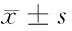
表7 过表达FHIT对细胞DU145增殖、凋亡蛋白表达的影响
2.5 抑制FHIT能逆转抑制miR-320e对细胞DU145增殖、凋亡的影响 与anti-miR-NC组比较,anti-miR-320e明显影响细胞DU145中FHIT、Cyclin D1、P21、Bax、Bcl-2蛋白表达量、细胞活性和细胞凋亡率(P<0.05)。与anti-miR-320e+si-NC组比较,anti-miR-320e与si-FHIT共转染明显减少FHIT、P21、Bax蛋白表达量,而提高Cyclin D1、Bcl-2蛋白水平,提高24 h、48 h、72 h的细胞活性,并且减少细胞凋亡率,差异均有统计学意义(P<0.05)。见图4,表8、9。

图4 抑制FHIT能逆转抑制miR-320e对细胞DU145增殖、凋亡蛋白表达的影响
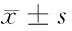
表8 抑制FHIT能逆转抑制miR-320e表达对细胞DU145增殖、凋亡的影响
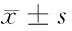
表9 抑制FHIT能逆转抑制miR-320e表达对细胞DU145增殖、凋亡蛋白表达的影响
3 讨论
miRNA是一类高度保守和内源性的基因表达调节因子,它们是长度通常为18~22个核苷酸的单链非编码RNA分子[9]。miRNA与特定mRNA的3,UTR中的靶位点发生互补性结合,使mRNA降解或翻译抑制。miRNA参与许多重要的细胞过程,包括增殖,细胞周期,细胞凋亡,粘附和转移,其中大多数构成癌症的关键标志[10]。近年来,miRNA已被发现在不同类型的人类癌症中异常表达,通过充当癌基因或抑癌基因参与肿瘤进展,包括前列腺癌[11-13]。miR-320e属于miR-320家族,总共包含37个序列,miR-320e位于PRKD2基因内含子-3内的染色体19 q13.32处[14]。与miR-320家族的其他成员相比,miR-320e在人类癌症中的功能作用知之甚少。研究表明,miR-320e在脊索瘤中异常表达,可作为肺癌发展的早期预测因子[15,16]。Perez-Carbonell等[14]学者首次报道了miR-320e在结直肠癌(colorectal cancer,CRC)患者中的临床表达水平和预后相关性,发现miR-320e经常在CRC患者中表达上调,尤其是在晚期肿瘤中,并且miR-320e与肿瘤大小呈正相关趋势(P=0.1047)并伴有淋巴结转移,证实高水平的miR-320e与CRC患者预后不良相关。本研究中,miR-320e在前列腺癌细胞DU145内的表达明显上调(P<0.05),与前人[6,7]研究结果一致。考察miR-320e失调时的细胞功能,结果发现,抑制miR-320e表达显著降低DU145细胞活性、Cyclin D1、Bcl-2蛋白表达,而提高细胞凋亡率、P21、Bax蛋白水平(P<0.05),下调miR-320e表现出对前列腺癌的抑制作用。
为了阐明miR-320e的作用机制,miRNA基因靶标的鉴定对于理解miR-320e在前列腺癌中的作用至关重要。本实验利用生物信息学工具TargetScan筛选出miR-320e的预测靶标FHIT。FHIT是一种小的细胞质蛋白,在体外切割三磷酸腺苷(Ap3A)以产生ADP和AMP,并且Ap3A在FHIT缺陷细胞中逐渐积累[17]。FHIT在超过一半的人类癌症中缺失,FHIT的损失可能会改变人恶性肿瘤多种生物学功能,包括凋亡减少,上皮-间质转化(EMT)增加,提高了耐基因毒性剂,改变活性氧的产生和基因组不稳定性,当恢复其表达时,可以诱导细胞凋亡并抑制致瘤性[18-20]。既往研究表明,FHIT参与多种人类恶性肿瘤的肿瘤发生,包括肺癌,乳腺癌,胰腺癌,肾癌等,起着肿瘤抑制作用[21,22]。FHIT在前列腺癌中的表达明显低于癌旁正常组织,FHIT表达与前列腺癌的发生发展有一定的联系[23,24]。Xu等[25]研究了FHIT基因对骨肉瘤细胞增殖和凋亡的调控作用,发现骨肉瘤细胞系Saos2中FHIT mRNA和蛋白表达明显下调,过表达FHIT明显抑制细胞增殖,而增加细胞凋亡率,这与本实验的结果一致,即FHIT基因抑制前列腺癌细胞增殖并促进其凋亡,说明FHIT扮演着抑癌因子的角色参与前列腺癌的发生发展。另外,本项研究运用双荧光素酶报告实验证实miR-320e可以靶向调控FHIT的表达,抑制FHIT表达可以逆转抑制miR-320e表达对前列腺癌细胞增殖和凋亡的影响。这些结果表明,靶向FHIT表达可能是miR-320e调节前列腺癌细胞增殖、凋亡的重要途径。
总之,本研究观察到miR-320e在前列腺癌细胞中表达上调,抑制miR-320e表达会抑制前列腺癌细胞增殖并诱导细胞凋亡,而miR-320e通过直接靶向调控FHIT的表达在前列腺癌细胞增殖和凋亡中发挥重要作用,证明了miR-320e对前列腺癌发生和进展的影响。因此,miR-320e可能成为前列腺癌患者的新型治疗靶点。
