黑面神雌花气味传粉前后的变化及其生态意义
2020-08-26黄代红王志博杨丽芳石福臣李后魂
黄代红 王志博 杨丽芳 石福臣 李后魂


摘 要:該文以与头细蛾传粉相关的叶下珠科植物黑面神为材料,采用动态顶空吸附法分别收集了该物种雌花传粉前后释放的挥发物,利用气相色谱-质谱联用技术分析了其化学成分,探索了三者间花气味的异同,并对其生态意义进行了讨论。结果表明:从该物种传粉前、传粉期和传粉后的雌花气味中共分离出22种挥发物(传粉前12种,传粉期15种和传粉后13种),以脂肪族衍生物和萜类物质为主。3-己烯醛、反-2-己烯醛、顺-3-己烯-1-醇、顺-乙酸-3-己烯酯、反-β-罗勒烯、β-石竹烯、β-蛇麻烯、反,反-α-金合欢烯和长叶烯是其主要挥发物。传粉前后雌花气味的化学种类及组成发生了显著分化,且这种变化主要是由于各时期主要挥发物发生改变而引起的。反-β-罗勒烯在传粉期含量最高,而在传粉后显著下降,3-己烯、反-2-己烯醛、顺-3-己烯-1-醇和顺-乙酸-3-己烯酯在传粉前含量均最高,β-石竹烯含量在传粉后显著升高,且长叶烯仅在传粉后出现。在传粉期和传粉后β-蛇麻烯和反,反-α-金合欢烯的含量均显著上升。同时,传粉期雌花的释放量明显高于传粉前和传粉后的。综上结果显示,黑面神雌花传粉前后花气味发生了质与量的改变。初步推测黑面神雌花传粉前后花气味的分化可能会有效阻止头细蛾对其进行再次访问,限制头细蛾在其雌花中过度产卵,进而来减少传粉头细蛾对宿主种子的取食,这无疑对维持叶下珠科植物-头细蛾专性传粉互利共生体系的稳定性具有重要的化学生态意义。
关键词:花气味,气相色谱-质谱联用法,传粉前后,黑面神,头细蛾,专性传粉互利共生关系
中图分类号:Q946.8
文献标识码:A
文章编号:1000-3142(2020)07-1010-11
Abstract:The floral scent is the key chemical signals for maintaining nursery pollination mutualisms between Phyllantheae plants and Epicephala moths. At pollination stage,the floral scent could guide obligate pollinators to encounter their host plants for pollination service and laying eggs. Until post-pollination,it also plays other potential ecological functions. Here,floral volatiles of female flowers of Breynia fruticosa(Phyllanthaceae) at pre-pollination,pollination and post-pollination stages were collected by dynamic headspace absorption technique,respectively,then chemical components using gas chromatography-mass spectrometry(GC-MS). We have determined whether there are variations of floral scent at pre-pollination,pollination and post-pollination stages by conducting principal component analysis. The results showed that a total of 22 volatile compounds were detected from the floral scent of female flowers of B. fruticosa at pre-pollination stage(12 compounds),pollination stage(15 compounds),and post-pollination stage(13 compounds),which were mainly contained fatty acid derivatives and terpenoids. 3-Hexenal,(E)-2-Hexenal,(Z)-3-Hexen-1-ol,(Z)-3-Hexenyl acetate,(E)-β-Ocimene,β-Caryophyllene,β-Humulene,(E,E)-α-Farnesene and Longiborneol were considered as the major scent component(the relative amount>5% ). Multivariate statistical analysis showed there were obviously qualitative differences in chemical compositions of the floral scents from female flowers at pre-pollination,pollination and post-pollination stages,and such differences were result from changes of the main scents compounds among different flowering stages. For example,the content of (E)-β-Ocimene is the highest at pollination stage,whereas it significantly decreased after pollination. 3-Hexenal,(E)-2-Hexenal,(Z)-3-Hexen-1-ol and (Z)-3-Hexenyl acetate are the four most abundant compounds at pre-pollination stage. β-Caryophyllene obviously increased and Longiborneol newly appeared at post-pollination stage. Both β-Humulene and (E,E)-α-Farnesene sigificantly increased at pollination and post-pollination stages. In addition,the volatile release amount of female flowers at pollination stage emitted significantly more volatiles than that at pre- and post-pollination stages,respectively. The strong reduced emission of floral bouquet and significant variation in the chemical composition in female flower scents at post-pollination stage may be a function as post-pollination mechanisms to efficiently reduce further flowers visit,thereby to limit seed predation. It was specultated that such qualitative and quantity differentiation in floral scent from Phyllantheae plants at pre-pollination,pollination and post-pollination stages might have the important chemical ecological significance for maintaining in stability of nursery pollination mutualisms between Phyllantheae species and Epicephala moths.
Key words:floral scent,GC-MS,pre- and post-pollination stage,Breynia fruticosa,Epicephala moth,obligate pollination mutualisms
在植物与昆虫专性传粉互利共生关系中,叶下珠科(Phyllanthaceae)植物和头细蛾属(Epicep-hala)昆虫共生系统最近成了关注热点(Kawakita & Kato,2006;Hembry et al.,2013),头细蛾专门在该科植物的雄花上积极采集花粉,主动为雌花传粉,同时在子房里产卵,其孵化的幼虫仅消耗宿主完整果实中的部分种子即可完成发育,其余种子用来保证宿主正常繁衍后代,这样两者之间就建立了专性传粉互利共生关系(Kawakita & Kato 2004a,b;Zhang et al.,2012a,b)。花气味是一类低分子量、易挥发的有机化合物(Schiestl,2010),它作为一类重要化学信号,可以诱导传粉者迅速、准确定位到植物,促使双方相遇,进而从各自搭档中获取相应报酬。因此,它在植物与昆虫专性传粉互利共生关系中起着非常关键的作用(Hossaert-McKey et al.,2010)。
目前,有关花气味在叶下珠科植物-头细蛾专性传粉互利共生体系中的研究主要集中于三个方面:(一)花气味挥发物的化学分析及吸引传粉头细蛾的活性挥发物的鉴定。据统计,与头细蛾存在专性传粉共生关系的叶下珠科植物有600多种,主要集中在算盘子属(Glochidion)、叶下珠属(Phyllanthus)和黑面神属(Breynia)中(Kawakita et al.,2010)。目前研究仅报道了11种宿主植物的花气味化学组成,包括算盘子属植物9种(Okamoto et al.,2007;Huang et al.,2015;黄代红等,2015;张振国等,2016)、叶下珠属植物1种(小果叶下珠Phyllanthus reticulates)(黄代红等,2016)和黑面神属植物1种(小叶黑面神Breynia vitis-idaea)(Svensson et al.,2010)。花气味化学分析发现,已报道的算盘子属和叶下珠属植物主要以萜类物质为主,黑面神属植物主要为芳香族化合物,如算盘子(Glochidion puberum)花气味中的主要成分为芳樟醇和β-榄香烯(黄代红等,2015),披针叶算盘子(G. lanceolatum)以芳樟醇为主(Okamoto et al.,2007),小果葉下珠中顺-β-罗勒烯含量最高(黄代红等,2016),2-苯乙腈和2-苯乙醇在小叶黑面神(Breynia vitis-idaea)中所占比例高达80%,且进一步通过昆虫电生理学和行为学实验证明,这两种化合物的混合物对传粉头细蛾具有强烈的吸引作用,是引发头细蛾传粉行为反应的重要生理活性物质(Svensson et al.,2010)。(二)花气味的种间特异性。多元统计分析表明,由不同头细蛾传粉的算盘子属植物间花释放的挥发物出现了分化,即具有种间差异性。相反,由相同头细蛾传粉的香港算盘子(Glochidion zeylanicum)和厚叶算盘子(G. hirsutum)植物的花产生的气味并未发生分歧,即具有种间保守性(Okamoto et al.,2007;Huang et al.,2015)。昆虫行为学实验发现,种特异性头细蛾能够区分出种间气味的差异,从而识别出自己的宿主植物(Okamoto et al.,2007)。因此,花气味的种间特异性可以使种特异性头细蛾与各自宿主植物相遇,是两者建立互利共生关系的前提保证。(三)雌雄花间气味的差异性,即两性异型性。研究显示,与头细蛾传粉相关的叶下珠科植物的雌雄花产生的气味具有明显的差异性,不仅在化学组成上有所不同,而且雄花的释放量显著高于雌花(Svensson et al.,2010;Okamoto et al.,2013;Huang et al.,2015;黄代红等,2016)。昆虫行为学实验发现,传粉头细蛾可以识别宿主植物两性间花气味的差异,且偏向选择雄花,从而触发头细蛾积极主动的传粉行为(Okamoto et al.,2013)。因此,花气味两性异型性有助于传粉头细蛾分别在宿主的雌雄花上完成不同且有序的主动传粉行为:首先在雄花上积极采集花粉,然后主动为雌花传粉,目的是为了获取不同的传粉报酬。雄花可为头细蛾提供花粉作为食物,雌花可提供子房作为传粉者的产卵地,从而双方之间形成了这种互利共生关系(Svensson et al.,2010;Okamoto et al.,2013)。
在互利共生体系的维持过程中,共生双方尽量减少自身利益受到损失是该系统稳定性维持的重要机制之一。只有在双方自身均具有防止搭档过度消耗自身资源的机制下,才能保证该系统的稳定,否则,互利共生体系就会面临崩溃(Herre et al.,2008)。对于植物而言,一旦种子寄生性传粉昆虫过度访问其雌花而产卵,就会导致其果实内寄生过多的传粉者幼虫,一方面会增加果实里传粉者幼虫间的竞争性,降低其后代的成活率,从而会影响传粉者种群的延续;另一方面过多的幼虫会完全消耗掉宿主果实内的全部种子,无法确保宿主植物来繁衍后代,从而影响该共生体系的稳定性(胡冰冰等,2011)。因此,在植物-昆虫专性互利共生关系的长期进化中,宿主植物为了防止种子寄生性传粉者对其资源,尤其是雌花资源的过度开采,演变出的一种可能的适应策略就是传粉前后花气味的变化。宿主利用传粉后花气味的变化来减少其对传粉者的吸引,降低宿主果实内的产卵率,这样可以有效阻止传粉者对宿主资源的过度消耗。目前,专性传粉互利共生系统中宿主植物传粉前后花气味变化的研究主要集中在榕树(Proffit et al.,2008;Chen et al.,2009)、丝兰(Svensson et al.,2011)、兰花(Schiestl et al.,1997;Schiestl & Ayasse 2001)以及蝇子草(Muhlemann et al.,2006;Horn & Holland.,2010)等植物中。除丝兰外,这些植物传粉前后花气味均发生了改变,该变化主要体现在一些传粉期活性物质含量的下降以及传粉后一些排斥物质的增加。然而,目前关于与头细蛾传粉相关的叶下珠科植物花气味传粉前后变化的研究还缺乏报道。
为此,本研究以与头细蛾传粉相关的叶下珠科黑面神属植物黑面神(Breynia fruticosa)为对象,利用动态顶空吸附法收集该物种雌花传粉前后的气味挥发物,运用气相色谱-质谱联用技术(gas chromatography coupled with mass spectrometry,GC-MS)分析不同传粉时期花气味的化学组成,以期探讨以下科学问题:(1)该物种雌花传粉前后挥发物的化学组成是否发生明显改变;(2)该物种雌花传粉前后释放量是否具有显著变化;(3)该物种雌花气味传粉前后发生质与量的变化有何生态意义。对这些问题的回答,可为进一步揭示叶下珠科植物与传粉头细蛾专性传粉互利共生体系稳定性维持的化学生态机制提供理论基础。
1 材料与方法
1.1 材料
选择位于海南鹦哥岭自然保护区鹦哥嘴分站内,主要生长于山坡、平地旷野灌丛或林缘地带的黑面神(Breynia fruticosa)为材料。地理位置为109°34′04″E、19°02′21″N,海拔450 m。该研究地点植被类型以热带低地雨林和热带季雨林为主,土壤类型为燥红壤和砖红壤(Wu et al.,2008;郝清玉等,2013)。
1.2 方法
1.2.1 花气味的收集 采用动态顶空吸附法分别收集黑面神雌花传粉前后的花气味挥发物(黄代红等,2015),具体工作流程如下:将采集的花放入无味透明的聚氟乙烯采集袋中(2 L,TeflonFEP,大连德霖气体包装有限公司),用封条密封采集袋的开口端。为了减少空气中的水分对吸附剂吸附效果的影响及除掉空气中的灰尘颗粒,首先利用通气泵(FAY4002,成都气海机电制造有限公司)将空气导入活性碳管(长75 mm,外径6 mm,Sigma-Aldrich公司,美国)对其进行干燥和净化,然后经由采集袋进气口通入袋内,促使花朵释放气味,再通过抽气泵(同通气泵型号)将花气味经由采集袋出气口抽出,最后导入Tenax TA(60/80目,100/50 mg,Sigma-Aldrich公司,美国)吸附管(长75 mm,外径6 mm)中进行挥发物的收集。利用玻璃转子流量器(ZB-4,天津流量仪表有限公司)分别对进气端和出气端的空气流量进行控制,流速均为400 mL·min-1。通过无味的特氟隆管(PTEE,VICI Jour公司,瑞士)将采集裝置中的各部分连接起来。为了与传粉头细蛾活动时间保持一致,花气味收集选择在18:30—23:30进行,持续5 h。在采集过程中,将空气作为对照,与花气味收集同步进行。采集完毕后,用锡箔纸包裹吸附管装入密封袋内,放置超低温冰盒带回实验室。
在化学分析前,首先取出吸附管,用正己烷(色谱纯,Fisher公司,美国)洗脱挥发物,重复3 次,然后将洗脱液收集在2 mL棕色进样瓶内(Sigma-Aldrich公司,美国),约0.5 mL,再加入500 ng正二十烷(色谱纯,Sigma-Aldrich公司,美国)作为内标化合物对挥发物的含量进行定量,用氮气浓缩至100 μL,最后将样品置于冰箱内(-18 ℃)保存待分析。
1.2.2 花气味的化学分析 采用气-质联用仪(GC-MS;GC,HP-6890;MS,HP-5795;Agilent Technoligies,USA)进行气味挥发物的分析及鉴定。(1)GC条件:色谱柱采用HP-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm);进样量2 μL,采用4∶1分流模式;柱箱程序升温:40 ℃ 保持 5 min,以3 ℃·min-1升温至 150 ℃,以10 ℃·min-1升至200 ℃,保持5 min;进样口温度250 ℃;载气为高纯He,流速1.0 mL·min-1。(2)MS条件:离子轰击源设为扫描功能,扫描范围 35~500 amu,电离方式EI;电子能量70 eV;接口温度280 ℃;离子源温度 230 ℃;极杆温度150 ℃。(3)气味化合物的鉴定:利用仪器自带的标准谱库(NIST08)检索目标化合物,确定其可能性,进一步利用保留指数,并根据相关文献加以确定。运用面积归一化法计算出气味各挥发物组分的相对百分含量。
1.3 数据处理
采用Graphad Prism 5.0软件,利用单因素方差分析中的Tukeys方法分别对黑面神雌花传粉前后花气味中不同类型挥发物的相对含量、传粉前后9种主要挥发物的相对含量以及传粉前后挥发物的释放量进行差异性检验;采用SPSS17.0软件,运用主成分分析法对黑面神雌花传粉前后的气味化学成分进行差异性分析,并且利用非参数检验 Kruskal-Wallis test对主成分1和主成分2进行差异性检验,同时运用对应分析法探讨黑面神雌花传粉前后花气味与9种主要挥发物之间的相互联系。所有图片采用 Graphad Prism 5.0和Photoshop软件制作完成。
2 结果与分析
2.1 传粉前后花气味的化学组成
运用GC-MS技术分别从黑面神雌花传粉前、传粉期和传粉后的气味中共鉴定出22种挥发物,由11种脂肪族衍生物、3种单萜类化合物、6种倍半萜类化合物以及2种芳香族化合物四大类构成(表1)。其中,三个时期中均能检测到的挥发物仅5种,分别是3-己烯醛、反-2-己烯醛、顺-3-己烯-1-醇、顺-乙酸-3-己烯酯和反-β-罗勒烯;任意两个时期共同出现的化合物多达8种,包括反-乙酸-2-己烯酯、顺-丁酸-3-己烯酯、反-氧化芳樟醇(呋喃型)、β-石竹烯、β-蛇麻烯、反,反-α-金合欢烯、苯甲醛和水杨酸甲酯;传粉前和传粉期均有反-乙酸-2-己烯酯、顺-丁酸-3-己烯酯和苯甲醛3种挥发物。
传粉前雌花中共检测到12种挥发物,主要包括顺-乙酸-3-己烯酯(48.69±6.31)%、顺-3-己烯-1-醇(21.04±10.68)%和3-己烯醛(13.35±9.59)% 3种物质,含量高达总相对含量的83%。其中,传粉前仅有正己醇、2-乙基-2-己烯醛、正十一烷和正十三烷4种特有化合物;传粉期雌花中发现15种挥发物,主要成分有反-β-罗勒烯(34.19±8.42)%、顺-乙酸-3-己烯酯(18.79±6.06)%、β-石竹烯(12.44±8.85)%以及反,反-α-金合欢烯(10.42±4.66)% 5种化合物,含量约占总相对含量的75%。其中,传粉期所特有的挥发物仅乙酸-3-己烯酯和顺-β-罗勒烯2种;传粉后雌花共检测出13种挥发物,以β-石竹烯(35.82±6.14)%和顺-乙酸-3-己烯酯(18.19±5.19)%为主,约占总相对含量的54%。其中,β-榄香烯、β-胡椒烯和长叶烯三种化合物为传粉后所特有。
2.2 传粉前后花气味挥发物化学类别的变化
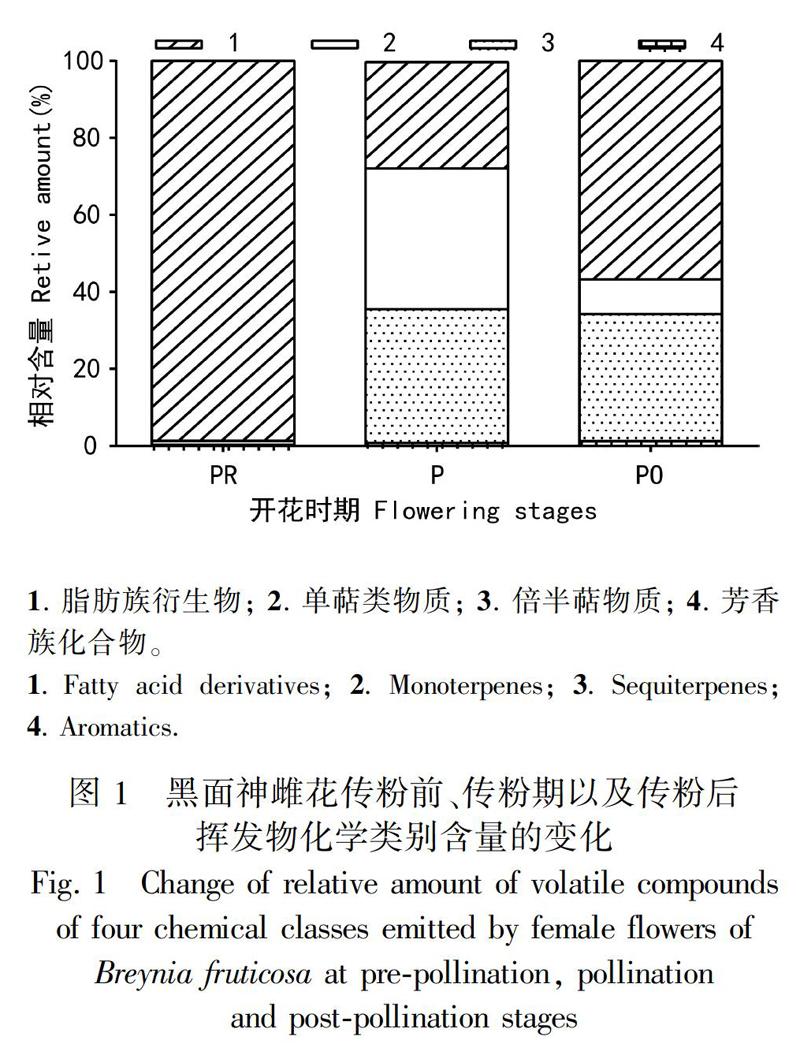
从图1可以看出,传粉前气味挥发物中未检测到倍半萜类物质,以脂肪族衍生物(98.44±0.61)%最为突出,明显高于其他两类化合物(P>0.05)。在传粉期,挥发物中以脂肪族衍生物(34.74 ± 14.88)%、单萜类(36.61 ± 6.60)%和倍半萜类三类化合物(27.61 ± 9.82)%为主,三者含量相当(P<0.05),超过总相对含量的99%。在传粉后,挥发物主要为倍半萜类物质(56.86 ± 4.58)%,显著高于其他三类化合物(P>0.05)。此外,芳香族化合物的相对含量在三个时期中一直均最低,且在各个时期变化趋势不大(P<0.05)(图1)。以上结果说明黑面神雌花传粉前后挥发物的化学类别发生了明显的改变。
2.3 传粉前后花气味中主要挥发物含量的变化
黑面神传粉前、传粉期和传粉后雌花气味中共检测出的22种挥发物中,相对含量>5%的化合物有9种,为花气味的主要成分(表1)。图2显示了黑面神雌花授粉前后花气味中主要挥发物的变化。在传粉前,3-己烯(化合物1)、反-2-己烯醛(化合物2)、顺-3-己烯-1-醇(化合物3)和顺-乙酸-3-己烯酯(化合物4)4种主要挥发物含量最高,且在授粉期和授粉后含量均显著降低(P<0.05)。反-β-罗勒烯在传粉期含量最高(化合物5),且显著高于授粉前和授粉后(P<0.05)。β-石竹烯(化合物6)在授粉前没有检测到,在授粉期含量较低,而到授粉后含量显著升高(P<0.05),长叶烯(化合物9)仅在传粉后被检测到,在传粉前以及传粉期均无发现。β-蛇麻烯(化合物6)和反,反-α-金合欢烯(化合物7)两种化合物在传粉期未出现,到传粉期和传粉后含量显著上升(P<0.05)。以上结果说明黑面神雌花传粉前后气味中的主要挥发物发生了明显的变化。
2.4 传粉前后花气味的化学组成差异性
对传粉前、传粉期和传粉后的花气味中已鉴定的共22种顶空挥发物进行主成分分析。结果如图3:A所示,主成分1和主成分2的方差累计率达60.59%,可认为这两主成分包含了原来花气味结果中主要信息(表1)。传粉前、传粉期和传粉后花气味的顶空样品各自聚合在一起,三者之间则相互分离,没有出现重叠或交叉。对主成分1和主成分2进行非参数Krushal-Wallis检验,结果显示用主成分1和主成分2确实可明显区分传粉前、传粉期和传粉后的花气味(χ2=10.68,P=0.005),说明传粉前后黑面神雌花气味的化学成分和组成之间存在显著差异。
对应分析中使用的9种主要挥发物与结果2.3中一样。如图3:B所示,三个时期分别位于不同的象限,互相分离,与主成分分析结果一致,说明这三个时期的花气味成分之間具有差异性。同时,每个时期周围均聚集有一些不同主要挥发物,化合物距离花期越近,说明该化合物与之对应的花期之间关系越密切。如对传粉前的花气味贡献最大的主要挥发物包括3-己烯醛(化合物1,13.35%)、顺-3-己烯-1-醇(化合物2,7.27%)、顺-3-己烯-1-醇(化合物3,21.04%)和顺-丁酸-3-己烯酯(化合物4,48.69%);传粉期有反-β-罗勒烯(化合物5,34.19%)、β-蛇麻烯(化合物7,4.74%)和反,反-α-金合欢烯(化合物8,10.42%);传粉后的是β-石竹烯(化合物6,35.82%)和长叶烯(化合物9,7.97%)。因此,传粉前后雌花气味出现的差异是由于主要挥发物发生了显著的变化而导致的。这说明黑面神雌花气味传粉前后发生了明显的分化,并且这种改变主要是通过传粉前后主要挥发物发生了变化来体现。
2.5 传粉前后花气味释放量的变化
从图4可以看出,黑面神雌花在传粉前单位时间内释放的挥发物量最少,到了传粉期,花气味的释放量明显上升,达到最大,随着昆虫传粉进程,传粉后花气味挥发物量又显著降低(P<0.05)。这说明黑面神雌花传粉前后花气味释放量发生了明显的变化。
3 讨论与结论
3.1 黑面神雌花传粉前后气味发生了质与量的变化
目前,榕树-榕小峰和丝兰-丝兰蛾两大经典的专性传粉系统中均已有宿主榕树(Chen et al.,2009;Gu et al.,2012;李宗波等,2012a,b)和丝兰(Svensson et al.,2011)传粉前后花气味的变化方面的报道。已有研究表明,接受前期、接受期(相当于传粉期)以及接受后期榕果挥发物的化学成分及组成之间存在着明显差异,接受期榕果释放的挥发物含量最高,传粉后显著减少(Chen et al.,2009;Gu et al.,2012;李宗波等,2012a,b)。昆虫行为学实验也证实了只有接受期的榕果产生的挥发物才能强烈地吸引传粉榕小蜂(Chen et al.,2009;Gu et al.,2012)。然而,丝兰传粉前后花气味的化学成分并未发生变化,相应地,丝兰蛾也不能区分未授粉和已授粉宿主的花(Svensson et al.,2011)。本研究首次报道了与头细蛾传粉相关的叶下珠科植物传粉前后花气味的动态变化。研究发现,该科植物黑面神雌花在传粉前、传粉期以及传粉后气味挥发物的化学组成发生了明显改变,挥发物释放量也表现出显著差异,传粉期释放量最高,明显高于传粉前和传粉后,说明黑面神雌花传粉前后气味发生了质与量的变化。这与榕树研究中的结果类似。因此,今后还应需进一步结合昆虫行为学实验来比较传粉前后黑面神雌花气味对头细蛾的吸引能力。
目前关于传粉前后花气味动态变化的报道中,不论在专性传粉系统,比如榕树(Chen & Song,2008;Guet al.,2012)、兰花(Tollsten,1993;Schiestl & Ayasse,2001)以及蝇子草(Muhlemann et al.,2006;Horn & Holland,2010)等,还是在泛化传粉系统,如大蓟(Theis & Raguso,2005),这些研究结果的一个共同趋势就是传粉前后花气味的改变主要体现在传粉后一些吸引传粉者的活性物质释放量的显著降低或者趋避性物质释放量的明显增加。比如,在榕树-榕小蜂共生系统中,鸡嗉子榕(Ficus semicordata)的雄果和雌果在传粉期均释放出的一种芳香族化合物4-苯甲基醚,含量高达99%,然而该物质在传粉后从鸡嗉子榕的榕果挥发物中消失。昆虫行为学实验进一步证明,该物质可以强烈地吸引其种特异性的传粉榕小蜂(Ceratosolen gravelyi)(Chen et al.,2010)。在蝇子草(Silene latifolia)-夜蛾昆虫(Hadena bicruris)傳粉系统中,紫丁香醛和邻苯二甲醚在传粉期的蝇子草花气味中含量较高,而到传粉后,这两种挥发物释放量明显下降。昆虫行为学实验发现这两种化合物不仅对传粉者的触角具有电生理活性,而且均可强烈地吸引传粉者(Dotterl et al.,2006;Muhlemann et al.,2006)。本研究发现,反-β-罗勒烯在黑面神雌花的传粉期含量最高,占总相对含量的34.18%,均显著高于传粉前和传粉后。对应性分析结果显示,该化合物距离传粉期最近,说明它在传粉期的雌花气味中占主导作用,因此可推测反-β-罗勒烯者有可能是黑面神雌花吸引其异性头细蛾为其传粉的潜在活性物质,然而,将来还需通过昆虫行为学实验来验证该物质对传粉头细蛾真正的吸引能力。
3.2 黑面神雌花气味传粉前后动态变化的生态意义
在植物-昆虫专性传粉育幼系统中,传粉昆虫在为宿主植物完成传粉的同时,还将其卵寄生于宿主植物雌花的果实内,孵化的幼虫依靠捕食宿主果实里的种子来发育,昆虫既是传粉者,也是种子寄生者,植物与昆虫之间形成了传粉-寄生的共生关系。这种特殊关系往往伴随着对共生双方利益的损害,尤其是对植物适合度的损害。共生双方在互利的同时需兼具一定程度的损害(童泽宇和黄双全,2019)。只有共生双方均具备了减少相互作用的消耗,倾向于保证自己的利益的机制,双方最终才均能从各自搭档中获得利益(Herre,2008)。因此,宿主通常为了限制种子寄生性传粉者对其资源的过度开采,尤其是防止在雌花内过多产卵,传粉者与宿主在长期的传粉-寄生互作过程中进化出的一种可能的适应对策就是宿主植物传粉后花气味化学成分发生分化以及挥发量的降低。
在头细蛾-叶下珠科植物专性传粉互利共生体系中,花气味具有非常关键的化学生态功能。在传粉期,它可以强烈吸引种特异性头细蛾准确定位到宿主植物为其传粉并产卵(Okamoto et al.,2007;Svensson etal.,2010;Okamoto et al.,2013)。伴随花的不断发育,尤其到传粉后阶段,花气味可能发挥着其他潜在的生物学功能(Proffit et al.,2008)。同榕果一样,黑面神雌花传粉前后花气味化学成分的改变以及释放量的显著减低,推测可以有效减少其对传粉头细蛾的吸引,进一步限制头细蛾在雌花的子房内过度的产卵,防止宿主资源过度消耗,这种策略对于维持叶下珠族植物与传粉头细蛾互利共生体系的稳定性具有重要的生态学意义。然而,与本研究结果相反的是,丝兰传粉前后花气味的化学成分并未发生变化,丝兰蛾并不能区分未授粉和已授粉宿主的花(Svensson et al.,2011)。然而有趣的是,丝兰本身会自我识别,将那些寄生太多丝兰蛾卵的花选择性地流产掉(Pellmyr & Huth,1994)。同时,丝兰蛾在访花时通常会在已传粉的丝兰花上沉积下自己的性激素作为标记,来有效阻止丝兰蛾的再次访问来限制其过度产卵(Huth & Pellmyr,1999)。因此,丝兰-丝兰蛾的共生系统可采取以上两种策略,而并非利用传粉前后花气味的改变来限制宿主雌花资源的过度消耗从而维持互利共生关系的稳定性。
3.3 叶下珠科植物与头细蛾专性传粉互利共生关系的化学生态维持机制
针对目前已有关于叶下珠科植物花气味的研究,结合本研究的结果,现归纳总结出叶下珠科植物-头细蛾互利共生体系的化学生态维持机制:在传粉期,宿主通过释放独特的花气味在夜晚来吸引种特异性头细蛾前来访花(Okamoto et al.,2007;Svensson et al.,2010)。通常情况下,宿主雄花的释放量远高于雌花,宿主主要是依靠雄花将其种特异性头细蛾吸引而来。之后,由于宿主雌雄花产生的气味互不相同,可以诱导传粉头细蛾在雄花和雌花上分别完成不同的传粉行为,从而获取相应的报酬:头细蛾在雄花上积极采集花粉,之后主动为雌花传粉并产卵,同时雄花可为传粉者提供花粉作为食物,而雌花为传粉者提供子房作为产卵地(Okamoto et al.,2013),这样两者之间就形成了专性传粉互利共生关系。到传粉后,宿主分化出与传粉期不同花气味以及减低气味释放量来减少传粉头细蛾的再次访问,这样可以限制头细蛾在雌花中过度产卵,确保宿主果实中的种子既可满足头细蛾孵化出的幼虫发育的需要,也可保障宿主能够正常繁衍后代,从而使得双方之间的专性传粉互利共生关系更为稳定。然而,目前绝大部分关于维持该互利共生体系的化学基础方面研究仅集中于花气味的化学成分的分析以及差异性比较,而忽略了气味挥发物与传粉者之间是如何建立起真正的联系的,因此今后的研究应该加强开展挥发物成分的昆虫行为学以及电生理学方面的研究,来更加全面和深入地揭示该共生体系的化学生态维持机制。
参考文献:
CHEN C,SONG QS,PROFFIT M,et al.,2009. Private channel:a single unusual compound assures specific pollinator attraction in Ficus semicordata[J]. Funct Ecol,23(5):941-950.
DOTTERL S,JURGRNS A,SEIFERT K,et al.,2006. Nursery pollination by a moth in Silene latifolia:the role of odours in eliciting antennal and behavioural responses[J]. New Phytol,169(4):707-718.
GU D,COMPTOM SG,PENG YQ,et al.,2012. ‘Push and ‘pull responses by g wasps to volatiles released by their host gs[J]. Chemoecology,22(4):217-227.
HAO QY,LIU Q,WANG SQ,et al.,2013. Biomass of forest communities at different altitude regions in Yinggeling montane tropical rainforest[J]. J Trop Subtrop Bot,21(6):529-537.[郝清玉,劉强,王士泉,等,2013. 鹦哥岭山地雨林不同海拔区森林群落的生物量研究[J]. 带亚热带植物学报,21(6):529-537.]
HEMBRY DH,KAWAKITA A,GURR NE,et al.,2013. Non-congruent colonizations and diversification in a coevolving pollination mutualism on oceanic islands[J/OL]. Proc Roy Soc B-Biol Sci,280(1761):20130306. http://dx.doi.org/10.1098/rspb.2013.0361.
HERRE EA,JANDER C,MACHADO A,2008. Evolutionary ecology of gs and their associates:recent progress and outstanding puzzles[J]. Ann Rev Ecol Evol Syst,39(1):439-458.
HORN KC,HOLLAND JN,2010. Discrimination among oral resources by an obligately pollinating seed-eating moth:host-marking signals and pollination and orivory cues[J]. Evol Ecol Res,12:119-129.
HOSSAERT-MCKEY M,SOLER C,SCHATZ B,et al.,2010. Floral scents:their role in nursery pollination mutua-lisms[J]. Chemoecology,20(2):75-88.
HU BB,LI HH,SHI FC,2011. Advance in the study of the mutualism between Epicephala moths(Lepidoptera:Gracillariidae)and Euphorbiaceae plants in China[J]. Acta Zootaxonomica Sin,36(2):447-457.[胡冰冰,李后魂,石福臣,2011. 中国头细蛾属昆虫(鳞翅目:细蛾科)与大戟科植物互利共生关系研究进展[J]. 动物分类学报,36(2):447-457.]
HUANG DH,SHI FC,CHAI MW,et al.,2015. Interspecific and intersexual differences in the chemical composition of floral scent in Glochidion species(Phyllanthaceae)in south China[J/OL]. J Chem Ecol,2015:1-14[2019-11-14]. https://doi.org/10.1155/2015/865694.
HUANG DH,ZHANG ZG,CHEN GP,et al.,2015. Analysis of the components of floral scent in Glochidion puberum using gas chromatography-mass spectrometry with dynamic headspace adsorption[J]. Chin J Chromatogr,33(3):318-322.[黃代红,张振国,陈国平,等,2015. 应用动态顶空吸附—气相色谱—质谱法分析算盘子花气味的化学成分[J]. 色谱,33(3):318-312.]
HUANG DH,CHEN GP,YANG XF,et al.,2016. Analysis of the composition and sexual dimorphism of floral scent in Phyllanthus microcarpus[J]. Acta Ecol Sin,36(13):4013-4020.[黄代红,陈国平,杨晓飞,等,2016. 小果叶下珠花气味组成及其两性异型性分析[J]. 生态学报,36(13):4013-4020.]
HUTH CJ,PELLMYR O,1999. Yucca moth oviposition and pollination behavior is affected by past ower visitors:evidence for a host-marking pheromone[J]. Oecologia,119(4):593-599.
KAWAKITA A,KATO M,2004a. Evolution of obligate pollination mutualism in New Caledonian Phyllanthus (Euphorbiaceae)[J]. Amer J Bot,91(3):410-415.
KAWAKITA A,KATO M,2004b. Obligate pollination mutualism in Breynia(Phyllanthaceae):further documentation of pollination mutualism involving Epicephala moth(Gracillariidae)[J]. Amer J Bot,91(9):1319-1325.
KAWAKITA A,KATO M,2006. Assessment of the diversity and species specificity of the mutualistic association between Epicephala moths and Glochidion trees[J]. Mol Ecol,15:3567-3581.
KAWAKITA A,OKAMATO T,GOTO R,et al.,2010. Mutua-lism favours higher host specificity than does antagonism in plant-herbivore interaction[J]. Proc Roy Soc B-Biol Sci,277(1695):2765-2774.
LI ZB,YANG P,PENG YQ,et al.,2012a. Analysis on chemical compounds and characteristics of fig volatiles emitted from Ficus curtipes Corner[J]. J trop subtrop bot,20(3):292-298.[李宗波,楊培,彭艳琼,等,2012a. 钝叶榕榕果挥发物成分及其构成特征分析[J]. 热带亚热带植物学报,20(3):292-298.]
LI ZB,YANG P,PENG YQ,et al.,2012b. Components and spatial variations in the emission of volatiles by figs of Ficus auriculata before and after pollination[J]. J Yunnan Univ,34(1):90-98.[李宗波,杨培,彭艳琼,等,2012b. 木瓜榕隐头果传粉前后挥发性化合物构成及其变化规律[J]. 云南大学学报,34(1):90-98.]
MUHLEMANN JK,WAELTI MO,WIDMER A,et al.,2006. Post-pollination changes in floral odor in Silene latifolia:adaptive mechanisms for seed-predator avoidance[J]. J Chem Ecol,32(8):1855-1860.
OKAMOTO T,KAWAKITA A,GOTO R,et al.,2013. Active pollination favours sexual dimorphism in floral scent[J]. Proc Roy Soc B-Biol Sci,280:20132280.
OKAMOTO T,KAWAKITA A,KATO M,2007. Interspecic variation of oral scent composition in Glochidion and its association with host-specic pollinating seed parasite(Epicephala)[J]. J Chem Ecol,33(5):1065-1081.
PELLMYR O,HUTH CJ,1994. Evolutionary stability of mutualisms between yuccas and yucca moths[J]. Nature,372:257-260.
PROFFIT M,SCHATZ B,BESSIERE JM,et al.,2008. Signalling receptivity:comparison of the emission of volatile compounds by gs of Ficus hispida before,during and after the phase of receptivity to pollinators[J]. Symbiosis,45(1):15-24.
SCHIESTL FP,2010. The evolution of floral scent and insect chemical communication[J]. Ecol Lett,13:643-656.
SCHIESTL FP,AYASSE M,2001. Post-pollination emission of a repellent compound in a sexually deceptive orchid:a new mechanism for maximizing reproductive success[J]. Oecologia,126(4):531-534.
