气相色谱法快速分析人唾液中7种短链脂肪酸
2016-12-08赵晓亚王跃飞杨帆江振作王琰杨龙
赵晓亚+王跃飞+杨帆+江振作+王琰+杨龙+潘赞红

摘要 建立了气相色谱法(GC)同时检测人唾液中7种短链脂肪酸(Short-chain fatty acids, SCFAs)含量的方法。唾液样品与乙醇溶液按体积比1∶1混合(含0.5%(V/V)浓HCl) 涡旋混合,离心后取上清液进行GC分析。采用DB-FFAP毛细管柱(30 m×0.25 mm×0.25 μm)进行分离; 氢火焰离子化检测器(FID)进行检测,内标法定量。实验结果表明,唾液中共检测到7种SCFAs(乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、己酸),7种SCFAs与内标物2-乙基丁酸的色谱峰峰面积比值与其浓度均呈现良好的线性关系(R2≥0.999),检出限(LOD,S/N=3)和定量限(LOQ,S/N=10)分别为0.060~0.198 μg/mL和0.180~0.594 μg/mL,平均加样回收率为94.8%~109.7%(RSD≤4.3%)。本方法简单、快速、准确,可用于测定人的唾液中短链脂肪酸的含量。
关键词 气相色谱; 唾液; 短链脂肪酸; 肠道菌群
2015-12-05收稿; 2016-03-27接受
本文系重大新药创制科技重大专项项目(No.2015ZX09J15102-004-004)资助
E-mail: wangyuefei_2006@hotmail.com; jeny_pan@163.com
1 引 言
短链脂肪酸(Short-chain fatty acids,SCFAs)是由益生菌,主要是肠道厌氧益生菌发酵膳食纤维和部分氨基酸和蛋白质的终产物[1,2],主要包括乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸和己酸等。短链脂肪酸不仅能为机体细胞提供能量[3],同时具有抑制致病菌[4,5]、抑制肠道上皮细胞和骨髓细胞的炎症反应[6]等作用,并可以调节机体代谢平衡,降低炎症性肠病、肥胖和II型糖尿病等疾病的发生率[7]。
肠腔内产生的短链脂肪酸,一部分在肠道中被利用,另一部分进入血液循环,通过细胞膜和粘膜的渗透作用进入唾液[8],或经血液循环运输至肺部,并随呼吸作用到达口腔, 进入唾液[9]。唾液成分包括少量电解质、蛋白质、激素、DNA、RNA以及其它小分子物质。与血液和尿液等体液相比,唾液分析具有取样简单、适应性好、临床检验快速、简便等特点[10],且基于唾液和血液物质的相关性[9,11],临床上可用于多种疾病的诊断[12]。唾液中含有与疾病相关的生物标记物[13],包括蛋白质和多肽及组织坏死、炎症、细胞粘附、结缔组织破坏和骨重塑的标记物[14]。同时研究者也开始关注唾液样品中的挥发性成分并试图寻找与疾病相关的化学成分。Mueller等[15]采用GC-TOF-MS法对吸烟和非吸烟人群的唾液进行对比分析,发现13种代谢产物含量有显著差异。Sánchez等[16]采用GC-MS方法对健康人和不同类型癌症患者的唾液进行分析,揭示了二甲基二硫醚和2-乙基己醇等可能是疾病相关的生物标记物。但是对唾液中挥发性有机酸的研究鲜有报道。Chen等[17]应用离子色谱法测定了唾液中甲酸、乙酸、丙酸和乳酸的含量,但样品处理方法过程较繁琐。本课题组在前期工作中,应用顶空气相色谱-串联质谱法鉴定唾液和血液中8种短链脂肪酸,包括乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、异己酸、己酸,初步推测唾液-血液中短链脂肪酸具有一定相关性[9]。
本研究建立了气相色谱-氢火焰离子化检测器法测定人唾液中7种短链脂肪酸(乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸和己酸)的定量分析方法,并成功用于41例健康志愿者唾液样品的分析。本方法简单、快速、准确,为寻找唾液中与疾病相关的挥发性生物标记物奠定了方法学基础。
2 实验部分
2.1 仪器与试剂
Shimadzu GC-2010气相色谱仪(日本Shimadzu公司); DB-FFAP毛细管柱(30 m×0.25 mm×0.25 μm, 美国Agilent公司); Milli-Q超纯水系统(美国Millipore公司); SCIENTZ 25-12超声仪(宁波新芝生物科技股份有限公司); TGL-16C高速台式离心机(上海安亭科学仪器厂); XS205电子天平(瑞士Mettler Toledo公司)。
乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、己酸、2-乙基丁酸对照品(纯度≥99%,美国Sigma-Aldrich公司); 其它试剂均为国产分析纯; 实验用水为超纯水。
2.2 标准品溶液的配制
准确称取各短链脂肪酸对照品,用50%(V/V)乙醇溶解并定容,得到7种标准品的单储备液,浓度分别为乙酸20.39 mg/mL、丙酸4.87 mg/mL、异丁酸0.532 mg/mL、丁酸0.657 mg/mL、异戊酸0.526 mg/mL、戊酸0.565 mg/mL、己酸0.562 mg/mL。此外, 以无水乙醇配制87.6 μg/mL 2-乙基丁酸(内标,IS)储备液。
分别取各标准品储备液适量,加50 μL浓HCl,以50%乙醇(V/V)定容至10 mL,得到混合标准品溶液,浓度分别为: 乙酸2039 μg/mL、丙酸487.0 μg/mL、异丁酸26.60 μg/mL、丁酸65.70 μg/mL、异戊酸26.30 μg/mL、戊酸56.50 μg/mL、己酸56.20 μg/mL(含0.5%(V/V)浓HCl及4.38 μg/mL 2-乙基丁酸),并采用50%乙醇溶液(含0.5%(V/V)浓HCl及4.38 μg/mL 2-乙基丁酸)逐级稀释,得到系列不同浓度的混合标准品溶液。
2.3 唾液样品的采集及供试品溶液的制备
经志愿者(24~40周岁)同意并签署了知情同意书,于早餐1~2 h后(样品采集前30 min以清水漱口)采集健康志愿者的唾液样品,以14000 r/min离心10 min,取上清液, 80℃保存备用。
取 80℃冻存的唾液样品,静置溶化后,取500 μL置于1.5 mL离心管中,加500 μL乙醇溶液(含1%(V/V)浓HCl及8.76 μg/mL 2-乙基丁酸),涡旋混匀,14000 r/min离心10 min,取上清液直接进行气相色谱分析。
2.4 气相色谱条件[18]
色谱柱: DB-FFAP弹性石英毛细管柱(30 m×0.25 mm×0.25 μm); 色谱柱升温程序: 初始温度50℃保持1 min,以15℃/min升至120℃, 以5℃/min升至170℃, 以15℃/min升至240℃后保持3 min; 进样口温度: 250℃; 氢火焰离子化检测器(FID)温度: 250℃; 进样体积: 5 μL,分流比50∶1; 载气: 高纯氮气(纯度>99.999%), 流速: 1.0 mL/min; 尾吹气: 高纯氮气(纯度>99.999%),流速: 30 mL/min; 氢气流速: 47 mL/min; 空气流速: 400 mL/min。
3 结果与讨论
3.1 样品处理条件的优化
短链脂肪酸为酸性化合物,在溶液中存在离子型和游离型两种状态[18],加入适量HCl酸化,使短链脂肪酸处于游离态,有利于测定,合适的酸性条件可改善色谱分离度及峰形,因此在样品处理过程中加入浓HCl酸化唾液样品。考察了唾液供试品溶液中浓HCl浓度(0.1%, 0.5%, 1.0%,V/V)、唾液样品与稀释液比例(1∶0.5, 1∶1, 1∶2, V/V)的影响。当唾液供试品溶液中浓HCl浓度为1.0%时,丁酸色谱峰拖尾严重,无法准确定量; 当浓HCl浓度为0.5%时,各短链脂肪酸的色谱峰形、分离度最优。唾液样品与稀释液体积比为1∶0.5时,乙酸色谱峰拖尾严重; 唾液样品与稀释液体积比为1∶1时,各短链脂肪酸的色谱峰形、分离度最优。综合考虑,确定唾液样品处理方法为唾液样品与稀释液(1% (V/V) 浓HCl-乙醇溶液)以体积比1∶1混合并涡旋混匀, 14000 r/min离心10 min,取上清液直接进行GC分析。
3.2 方法学验证
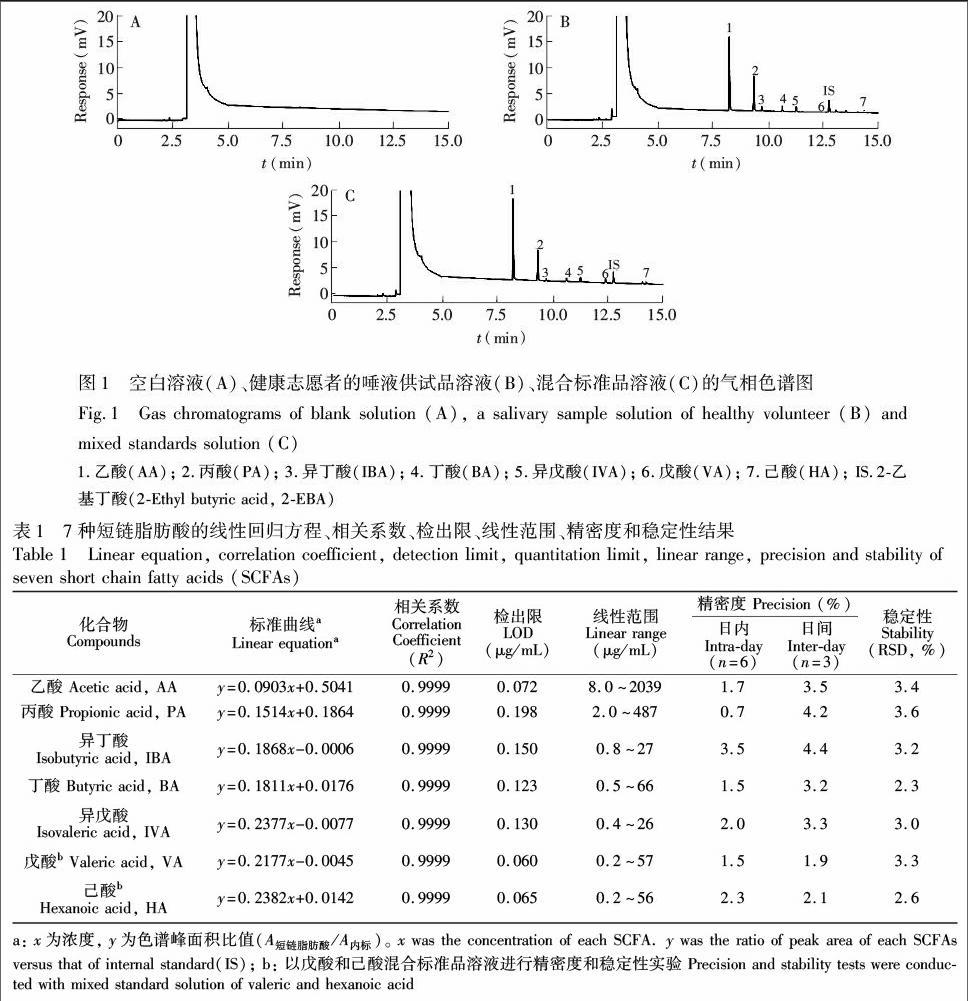
将空白溶液(0.5%浓HCl-50%乙醇溶液)、唾液供试品溶液和混合标准品溶液按照2.4节气相色谱条件分析,色谱图如图1所示。可见,空白溶液和唾液中其它物质色谱峰均不干扰短链脂肪酸分析。
将混合标准品溶液逐级稀释成系列标准品溶液,以标准品浓度x(μg/mL)为横坐标,以对照品与内标物的峰面积比值y为纵坐标,绘制标准曲线,7种短链脂肪酸在相应浓度范围内线性良好,相关系数R2≥0.999,检出限(S/N≥3)和定量限(S/N≥10)分别为0.060~0.198 μg/mL,0.180~0.594 μg/mL; 在方法学研究中,唾液中未检测到戊酸和己酸,故以0.589 μg/mL戊酸和0.615 μg/mL己酸的混合标准品溶液(内标浓度为4.38 μg/mL)进行日内、日间精密度和稳定性实验,结果见表1。7种短链脂肪酸的日内精密度(相对标准偏差,RSD)和日间精密度RSD分别为0.7%~3.5%和1.9%~4.4%。唾液供试品溶液室温条件下放置12 h内稳定性良好,RSD为2.3%~3.6%。
准确吸取适量标准品溶液至健康志愿者的唾液样品中,按照2.3节方法制备供试品溶液,进行分析,7种短链脂肪酸的加样回收率为94.8%~109.7%, RSD为1.7%~4.3%,结果见表2。
3.3 健康志愿者的唾液样品中短链脂肪酸分析
在方法学验证的基础上,采用本方法测定了41例健康志愿者唾液样品中7种短链脂肪酸的含量,结果为: 乙酸13.1~378 μg/mL; 丙酸1.62~101.6 μg/mL; 异丁酸0.647~6.03 μg/mL; 丁酸0.644~18.2 μg/mL; 异戊酸0.859~9.86 μg/mL; 部分唾液样品中检测到戊酸和己酸,且大部分样品中戊酸和己酸含量在定量限以下。
仅一例样品中检测到戊酸, 含量为0.359 μg/mL; 7种短链脂肪酸总量为15.4~507 μg/mL。由于7种短链脂肪酸的含量差异悬殊,因此绘制了41例健康志愿者唾液样品中7种短链脂肪酸的含量分布箱图(图2A),更直观地显示出唾液样品中7种短链脂肪酸含量均在一定范围内波动,其原因可能是个体在饮食、肠道功能、肠道菌群种类及活力等方面的差异,导致产生的短链脂肪酸含量差异,最终影响了唾液中短链脂肪酸含量。
以乙酸为例,41例健康志愿者唾液样品中乙酸含量分布如图2B所示,含量在20~150 μg/mL的样品例数占78.0%,含量低于20 μg/mL的占4.9%,含量高于150 μg/mL的占17.1%。人体唾液蕴含大量生理信息,唾液中的成分来源途径广,如腮腺、牙龈龈沟液、舌下[8]和体液交换过程中的主动运输或被动扩散[19],所以作为一个开放的环境,检测唾液中的成分能反映身体的健康和疾病状况[20]。唾液中的短链脂肪酸有利于保持口腔的偏酸性环境,有利于抑制有害菌的滋生[4],从而保持健康的口腔环境。测定唾液中的短链脂肪酸也有可能成为未来监测人体健康状况的一种简捷的辅助性手段。
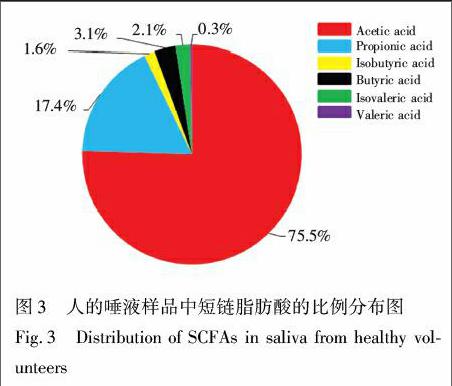
如酸的比例分布图表明: 唾液样品中乙酸占短链脂肪酸的75.5%,丙酸占17.4%,丁酸占3.1%,三者占短链脂肪酸的96.0%,与文献报道的人的粪便、血液中的结果[21]基本一致; 异丁酸、异戊酸和戊酸占短链脂肪酸的4.0%。原因可能是,在哺乳动物体内,肠腔内产生的乙酸,大部分经血液运输至外周,被外周组织利用; 另一部分乙酸和丙酸被运输至肝脏,乙酸参与合成长链脂肪酸、谷氨酸等,丙酸进行糖异生作用[22]。丁酸则主要作为能量物质被肠道上皮细胞利用[23],而异丁酸、异戊酸和戊酸由肠道菌群发酵某些特定的多肽和氨基酸产生[2]。
上述实验结果表明, 本方法简单、快速、准确,可用于人的唾液中短链脂肪酸的分析。
Reference
1 Cummings J H, Pomare E W, Branch W J, Naylor C P, Macfarlane G T. Gut, 1987, 28(10): 1221-1227
2 Rasmussen H S, Holtug K, Mortensen P B. Scand. J. Gastroenterol., 1988, 23(2): 178-182
3 Roediger W E. Gut, 1980, 21(9): 793-798
4 Orrhage K, Nord C E. Drugs Exp. Clin. Res., 2000, 26(3): 95-111
5 Levison M E. Infect. Immun., 1973, 8(1): 30-35
6 Iraporda C, Errea A, Romanin D E, Cayet D, Pereyra E, Pignataro O, Sirard J C, Garrote G L, Abraham A G, Rumbo M. Immunobiology, 2015, 220(10): 1161-1169
7 Puertollano E, Kolida S, Yaqoob P. Curr. Opin. Clin. Nutr. Metab. Care, 2014, 17(2): 139-144
8 Chiappin S, Antonelli G, Gatti R, De Palo E F. Clin. Chim. Acta, 2007, 383(1-2): 30-40
9 ZHAO Xiao-Ya, JIANG Zhen-Zuo, WANG Yue-Fei. Chinese J. Microecol., 2015, 27(2): 130-134
赵晓亚, 江振作, 王跃飞. 中国微生态学杂志, 2015, 27(2): 130-134
10 Dhima M, Salinas T J, Wermers R A, Weaver A L, Koka S. J. Prosthodont. Res., 2013, 57(1): 51-56
11 Rantonen P J, Penttila I, Meurman J H, Savolainen K, Narvanen S, Helenius T. Acta Odontol. Scan., 2000, 58(6): 299-303
12 Streckfus C F, Bigler L R. Oral Dis., 2002, 8(2): 69-76
13 Li Y, St John M A, Zhou X, Kim Y, Sinha U, Jordan R C, Eisele D, Abemayor E, Elashoff D, Park N H, Wong D T. Clin. Cancer Res., 2004, 10(24): 8442-8450
14 Nieuw Amerongen A V, Ligtenberg A J, Veerman E C. Ann. N. Y. Acad. Sci., 2007, 1098: 1-6
15 Mueller D C, Piller M, Niessner R, Scherer M, Scherer G. J. Proteome Res., 2014, 13(3): 1602-1613
16 Sánchez M N, Garcia E H, Pavon J L, Cordero B M. Anal. Chem., 2012, 84(1): 379-385
17 Chen Z, Feng S, Pow E H, Lam O L, Mai S, Wang H. Clin. Chim. Acta, 2015, 438: 231-235
18 JIANG Zhen-Zuo, WANG Yue-Fei, CHEN Rong-Rong, ZHU Yan, ZHANG Lei, LIU Shuang, LIU Hai-Li. Chinese J. Anal. Chem., 2014, 42(3): 429-435
江振作, 王跃飞, 陈荣荣, 朱 彦, 张 蕾, 刘 双, 刘海利. 分析化学, 2014, 42(3): 429-435
19 Aps J K, Martens L C. Forensic Sci. Int., 2005, 150(2-3): 119-131
20 Foo J Y, Wan Y, Kostner K, Arivalagan A, Atherton J, Cooper-White J, Dimeski G, Punyadeera C. PloS one, 2012, 7(10): e48452
21 Zhao G, Nyman M, Jonsson J A. Biomed. Chromatogr., 2006, 20(8): 674-682
22 Cook S I, Sellin J H. Aliment. Pharmacol. Ther., 1998, 12(6): 499-507
23 Pomare E W, Branch W J, Cummings J H. J. Clin. Invest., 1985, 75(5): 1448-1454
Abstract A gas chromatographic (GC) method was established for the simultaneous analysis of seven short-chain fatty acids (SCFAs) including acetic acid, propionic acid, isobutyric acid, butyric acid, isovaleric acid, valeric acid and hexanoic acid in human saliva. Salivary sample was diluted by ethanol solution by ratio of 1∶1 (V/V), with 0.5% (V/V) hydrochloric acid in sample solution, then vortexed and centrifuged. The supernatent was subjected to GC analysis. The chromatographic separation was performed on a DB-FFAP capillary column (30 m × 0.25 mm × 0.25 μm) using flame ionization detector (FID). The quantification was achieved by internal standard method. The experimental results showed that an excellent correlation coefficient (R2≥0.999) was obtained for all the calibration curves of seven SCFAs. The limits of detection (LOD, S/N=3) and limits of quantitation (LOQ, S/N=10) were 0.060-0.198 μg/mL and 0.180-0.594 μg/mL, respectively. The average recoveries were 94.8%-109.7% with relative standard deviation (RSD)≤4.3% (n=6). The developed method is simple, rapid and accurate, and suitable for the simultaneous determination of seven SCFAs in human saliva.
Keywords Gas chromatography; Saliva; Short-chain fatty acids; Gut microbiota
