CTGF和ELMO1多态性与2型糖尿病性肾病易感性的关联研究
2020-08-13何志忠陈继承王全兴刘加河郑晓军
何志忠, 陈继承, 王全兴, 刘加河, 郑晓军
2型糖尿病(type 2 diabetes mellitus, T2DM)是以胰岛素分泌相对不足及胰岛素抵抗为特征表现的内分泌代谢性疾病。由于血糖控制不佳及患者对糖尿病认知不足,T2DM所导致的心、脑、肾等大血管及微血管病变具有较高的发生率[1]。糖尿病性肾病(diabetic kidney disease,DKD)是T2DM患者最常见的微血管并发症[2-3]。目前针对DKD的发病机制尚未完全明确,多项研究均证实:引起DKD的主要原因包括遗传、环境因素及长期的糖代谢紊乱[4-6]。GWAS和相关荟萃分析已报道在不同人群中与DKD易感性相关的一些基因[7]。其中,吞噬和细胞运动蛋白1(engulfment and cell motility 1, ELMO1)基因的多态性与DKD具有相关性[8],但其机制尚不完全清楚。部分研究表明,ELMO1基因的突变可导致细胞外间质代谢紊乱,从而导致细胞外基质的累积、肾小管和肾小球基底膜增厚,增加DKD的风险[9]。结缔组织生长因子(connective tissue growth factor, CTGF)在刺激系膜细胞增生、促进细胞外基质合成及促进肾脏纤维化等方面发挥作用[10]。遗传学研究发现,人类CTGF基因中有10个SNP,其中3个SNP位点可能存在一定的功能[11]。本研究采用imLDRTM多重SNP分型技术,探讨CTGF基因rs2648875及ELMO1基因rs10951509多态性与DKD遗传易感性的关系。
1 对象与方法
1.1对象 收集2017年1月—2018年6月就诊笔者医院的DKD患者195例(DKD组)。同时随机选取笔者医院体检中心体检的患者134例作为对照组,无DM、肾损害、高血压病、冠状动脉粥样硬化性心脏病等病史。T2DM诊断符合2017年2型糖尿病防治指南中的诊断标准[12]。DKD的诊断符合2019年中国糖尿病肾病疾病防治临床指南[13],由糖尿病引起的慢性肾病,主要包括尿白蛋白/肌酐比(albumin to creatinine ratio,ACR)≥30 mg/g持续超过3月和(或)伴肾小球滤过率(glomerular filtration rate, GFR)<60 mL·min-1·1.73 m-2。排除标准:(1)年龄<30岁或>70岁;(2)合并高血糖高渗状态、糖尿病酮症酸中毒等其他严重并发症者;(3)合并有严重的心、肝等并发症;(4)因泌尿系感染、发热、运动等因素导致的ACR升高者;(5)无持续蛋白尿而出现肾功能迅速恶化;(6)原发性肾小球疾病、高血压病、心功能不全、血液病、自身免疫性疾病、肿瘤及药物等导致的继发性肾损害;(7)精神病患者。所有研究对象均为泉州市常住汉族人群,彼此间无血缘关系。本研究通过笔者医院医学伦理委员会审核同意,所有研究对象均签署知情同意书。
1.2方法
1.2.1一般情况及生化分析 收集受试患者身高、体质量、腹围、血压等情况,计算体质量指数(body mass index, BMI)。采集空腹静脉血,通过糖化血红蛋白分析仪(H8,深圳普门科技股份有限公司)检测糖化血红蛋白(glycosylated hemoglobin, HbA1c)水平。通过生化免疫流水线(Aptio,德国西门子公司)进行空腹血糖(fasting plasma glucose, FPG)、甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、血清尿素氮(serum urea nitrogen, BUN)、血清肌酐(serum creatinine, Scr)、尿酸(uric acid, UA)等指标检测。收集晨尿,通过ACR尿液分析仪(720型,韩国赛宝公司)检测患者尿液ACR水平。
1.2.2DNA提取 采集两组患者的空腹外周静脉血3 mL,采用中量全血基因组DNA提取试剂盒(DP2102,北京百泰克生物技术有限公司)进行基因组DNA的提取。具体提取步骤参照试剂盒说明进行。采用超微量紫外分光光度计(Nanodrop-2000,美国Thermo公司)检测基因组DNA纯度和浓度,所有基因组DNA样本的纯度和浓度均达到实验要求。
1.2.3CTGF及ELMO1基因多态性分析 采用上海天昊生物科技有限公司自主专利研发的imLDRTM多重SNP分型试剂盒进行CTGF基因rs2648875及ELMO1基因rs10951509多态性检测。

2 结 果
2.1临床资料比较 DKD组患者的腹围及BMI,SBP,DBP,FPG,TC,TG,LDL-C,BUN较对照组显著升高,HDL-C较对照组显著降低,差别具有统计学意义(P<0.01,表1)。

表1 两组患者的一般临床资料比较
2.2CTGF基因rs2648875多态性分析
2.2.1HWE检验、基因型及等位基因分布比较 经过似然比χ2检验,两组基因型频率分布符合HWE(P均>0.05,表2),证明所采集样本人群具有良好的群体代表性。两组患者AA,GA及GG基因型分布差别具有统计学意义(χ2=8.639,P=0.013,表3)。DKD组风险等位基因A频率较对照组升高,差别具有统计学意义(χ2=7.220,P=0.007,表3),其OR为1.183,95%CI为1.043~1.343。
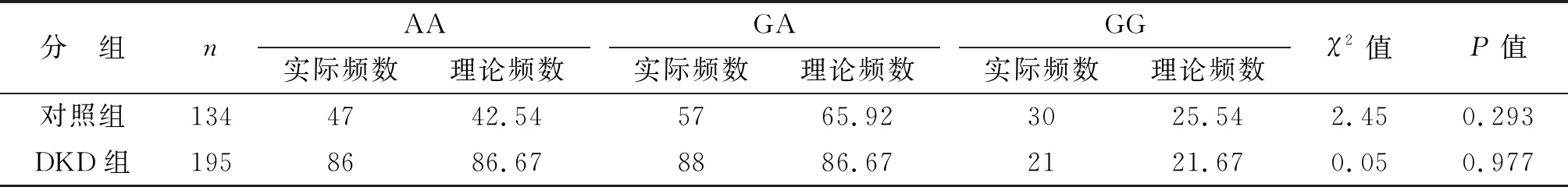
表2 rs2648875基因型遗传平衡定律检测

表3 两组患者rs2648875基因型及等位基因分布情况
2.2.2DKD组rs2648875多态性与临床资料相关性分析 GG基因型患者TG水平较AA及GA基因型患者显著降低,差别具有统计学意义(P<0.05,表4)。
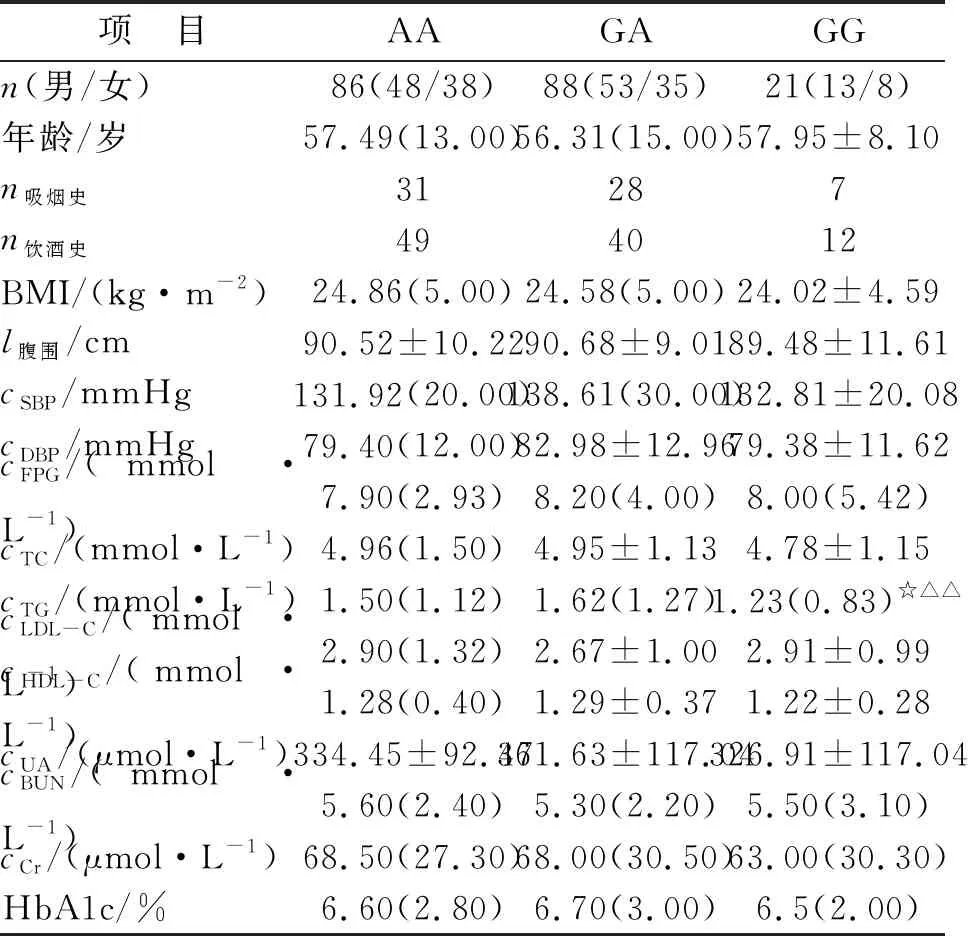
表4 DKD组rs2648875基因型与理化指标相关分析
2.3ELMO1基因rs10951509多态性分析
2.3.1HWE检验、基因型及等位基因分布比较 经过似然比χ2检验,两组基因型频率分布符合HWE(P均>0.05,表5),证明所采集样本人群具有良好的群体代表性。两组患者AA,AG及GG基因型分布差别具有统计学意义(χ2=6.770,P=0.034,表6)。DKD组风险等位基因A频率较对照组升高,差别具有统计学意义(χ2=6.769,P=0.009,表6),其OR为1.149,95%CI为1.031~1.281。

表5 rs10951509基因型遗传平衡定律检测

表6 两组患者rs10951509基因型及等位基因分布比较
2.3.2DKD组rs10951509多态性与临床资料相关性分析 AG基因型患者LDL-C水平较AA基因型显著降低,差别具有统计学意义(P<0.05,表7)。
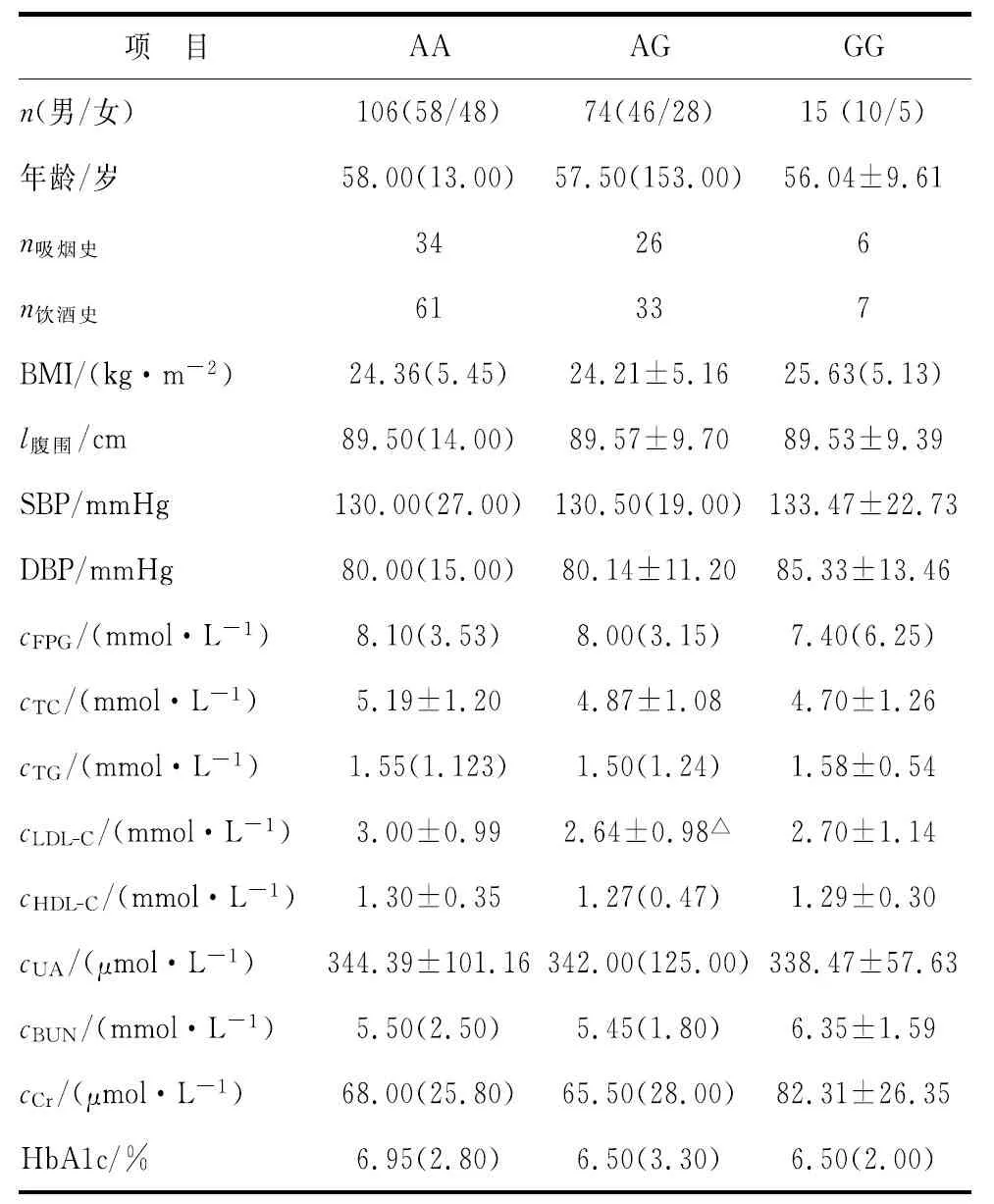
表7 DKD组rs10951509基因型与临床资料相关分析
2.4DKD危险因素Logistic回归分析 以DKD为因变量,以性别、年龄、吸烟史、饮酒史、腹围、CTGF 3种基因型、ELMO1 3种基因型及BMI,SBP,DBP,FPG,TC,TG,LDL-C,HDL-C,BUN,Cr为自变量,进行二元Logistic回归分析,结果显示吸烟史、腹型肥胖及SBP,FPG,BUN,CTGF-AA基因型为DKD的独立危险因素(表8)。

表8 DKD危险因素Logistic回归分析
3 讨 论
20%~40%的糖尿病患者可并发肾脏损害,DKD是导致终末期肾功能衰竭的主要病因[14-15]。目前关于DKD的发病机制尚未完全阐明,一般认为是环境因素与遗传因素共同作用的结果,其中遗传因素是决定DKD易感性及严重程度的重要因素。本研究回归分析发现,吸烟史、腹型肥胖及SBP,FPG,BUN为DKD的独立危险因素。但笔者发现,DKD的发生与患者血糖控制情况并未完全成正比,不能完全用血糖控制不佳解释患者DKD的发生,且DKD具有明显的家族聚集倾向及种族差别,存在DKD家族史患者并发DKD的风险为正常人的3倍[5,16]。同时,DKD患者同胞并发DKD的风险为无合并肾脏疾病糖尿病患者同胞的2.3倍,可见DKD具体明显的遗传倾向性。DKD发生的病理过程中,早期主要表现为肾小球肥大及基底膜增厚,同时合并系膜区细胞外基质堆积及重构,DKD后期主要表现为肾小球及肾间质纤维化[17]。
人CTGF基因长度约为3 kb,位于染色体6q23.1上,其含有5个外显子和4个内含子,其5个外显子分别编码4个功能片段和CTGF的分泌信号肽。CTGF蛋白为即刻早期基因CNN家族中的一种细胞因子,为转化生长因子β的下游效应因子,在肾脏中表达最高,在刺激肾小球系膜细胞增生和细胞外基质合成、导致肾小球硬化、促肾脏纤维化等方面发挥作用,参与DKD的整个病理过程[10, 18]。研究发现,体外培养的人肾小管上皮细胞经高糖刺激后,CTGF表达显著升高,肾小管上皮细胞发生转分化改变,肾间质细胞的细胞外基质蛋白表达增高,降解减少,导致细胞外基质过度堆积,出现肾脏体积增大并最终发生纤维化[19-21]。本研究发现,CTGF rs2648875基因DKD组等位基因A频率较对照组升高(χ2=7.220,P=0.007),表明CTGF rs2648875基因A等位基因为DKD的易感基因(OR:1.183,95%CI:1.043~1.343)。进一步行Logistic回归分析发现,CTGF AA基因型为DKD独立危险因素。Mason等研究认为,CTGF rs9399005基因多态性可改变患者血清水平,是肾纤维化进程中发挥多种生物学活性的有害细胞因子[22]。进一步分析发现,AA及GA基因型患者TG水平较GG基因型显著增高(P<0.05),推测CTGF rs2648875基因多态性可通过改变患者TG水平影响DKD的发生,这有待后续进一步行蛋白组学研究证实。
人ELMO1基因位于染色体7p14.2上,包含22个外显子及21个内含子。ELMO1在死亡细胞吞噬、细胞形态改变及细胞转移等方面具有重要作用[6]。在DKD发生、发展过程中,ELMO1的过表达可导致细胞外基质代谢失调,细胞黏附性降低,引起细胞外基质沉积,出现肾小球和肾小管基底膜增厚,尿蛋白排出增多,引起慢性肾小球和肾小管损伤[9]。在ELMO1高表达的细胞中,细胞外基质中纤连蛋白、I型胶原蛋白、整合素连接激酶和TGF-β表达均明显增加,金属蛋白酶表达明显减少,促进慢性肾小球损伤的发展[23]。另外,ELMO1可通过增强环氧化酶活性而增加纤连蛋白的表达,引起肾小球中细胞外基质不断沉积,进一步加重肾小球损害[24]。2005年,Shimazaki等通过全基因组关联分析首次证实ELMO1基因多态性与日本人群DKD的发生具有相关性[8]。Hanson等在亚利桑那州的印第安人中研究发现,位于ELMO1内含子13的rs10951509 A等位基因和rs1345365A等位基因与DKD的发生具有明显关联性[25]。本研究在汉族人群中的调查也发现,ELMO1 rs10951509基因DKD组等位基因A频率较对照组升高(χ2=6.769,P=0.009),表明ELMO1 rs10951509基因A等位基因为DKD的易感基因(OR:1.149,95%CI:1.031~1.281)。而我国一项在新疆维吾尔族人群中的研究发现,ELMO1 rs10951509基因G等位基因为DKD易感基因[26],与本次研究及国外研究相反,考虑与种族、样本量及地域差别等因素有关。本研究进一步分析发现,AA基因型患者LDL-C水平较AG基因型显著升高(P<0.05),较GG基因型患者升高,但无显著性差别,ELMO1 rs10951509基因多态性是否影响患者LDL-C水平,有待后续增加样本量研究证实。
综上所述,本研究发现CTGF rs2648875基因A等位基因及ELMO1 rs10951509基因A等位基因与DKD的发生相关。吸烟史、腹型肥胖及SBP,FPG,BUN,CTGF-AA基因型为DKD的独立危险因素。DKD的发生是遗传因素和环境因素共同作用的结果,发病机制十分复杂,遗传背景在不同种族人群中差别很大,所产生的SNP位点作用强度也不同,同时多个SNP位点之间也可相互影响,生活饮食、居住环境、实验样本量等均可影响相关研究结果。本研究仅从小量样本及部分SNP位点进行关联研究,因此进一步研究CTGF及ELMO1多态性与DKD的相关性,仍需进行不同种群之间的多中心研究以及多位点之间的交互研究。从基因学角度进行研究有助于DKD疾病的早期筛查、预防、延缓病情进展及对药物治疗提供新靶点。
