考尼伐坦关键中间体的合成新工艺研究
2020-07-13喻明军
喻明军
(亳州学院中药学院,安徽 亳州 236800)
引言
盐酸考尼伐坦是一种精氨酸加压素(AVP)V1a和V2受体的非肽类双重抑制剂[1],在治疗低钠血症的时候具有良好的疗效和安全性[2]。最近有研究指出盐酸考尼伐坦还具有比甘露醇更好的利尿作用,并且不会引起脑组织的损害和水肿,这表明盐酸考尼伐坦还具有治疗缺血相关脑血管疾病的作用[3-4]。1,2,3,4-四氢-5H-苯并氮杂-5-酮是合成盐酸考尼伐坦的关键中间体,目前报道的中间体合成方法主要有以下几种:方法1[5-9]是以氨茴酸甲酯为原料,经磺酰化得2-[(4-甲基苯)磺酰胺基]-苯甲酸甲酯(3),然后与4-氯丁腈或4-溴丁酸乙酯进行N烷基化反应分别得到中间体4和6,中间体4或中间体6在碱性条件下关环分别得到中间体5和7,最后脱除氰基或羧基生成目标化合物1,如图1所示;方法2[10]是以苯胺为起始原料,先用磺酰基对氨基进行保护,再与4-氯丁酸乙酯进行N-烷基化反应,然后经水解反应和傅克酰基化反应得到目标产物,如图2所示;Wang等[11]人报道另外一种合成方法(方法3),以 N-保护的环丙基苯胺为原料,在三价铑复合物催化下与一氧化碳进行加成反应,得到目标产物,收率为79%~82%,如图3所示。目前报道的几条合成路线中存在以下缺点:第一条合成路线的起始原料氨茴酸甲酯价格相对较高,磺酰基保护后的苯胺的NH活性变弱,N-烷基化反应需要使用催化剂并且反应时间较长,且对甲基苯磺酰作为保护基分子量大,成本高,原子不经济;第二条反应路线也存在N-烷基化反应活性低和保护基不经济的缺点;第三条合成路线催化剂昂贵、用量大,辅助试剂多,成本高。因此,需要开发出一条更加经济合理的路线来进一步降低原料成本和生产成本。
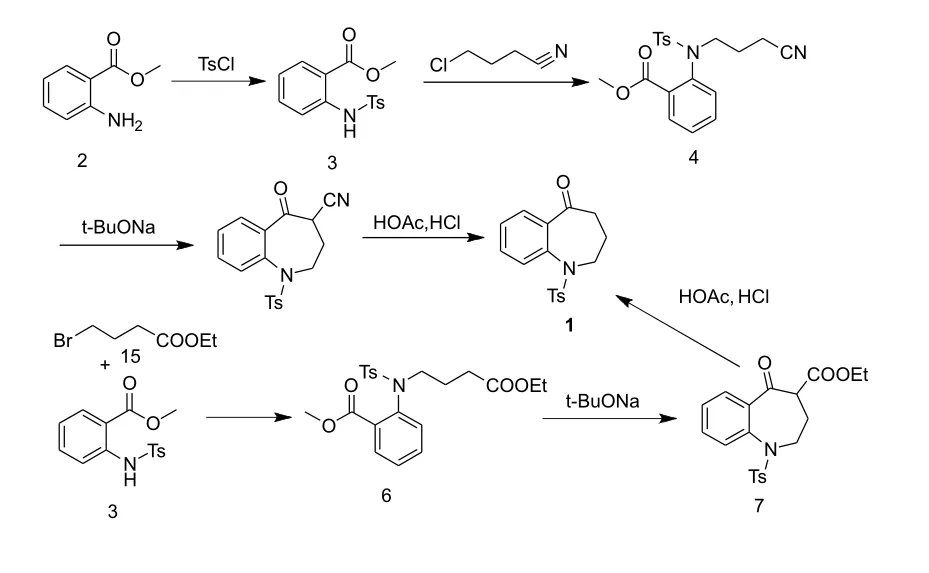
图1 考尼伐坦中间体合成方法1
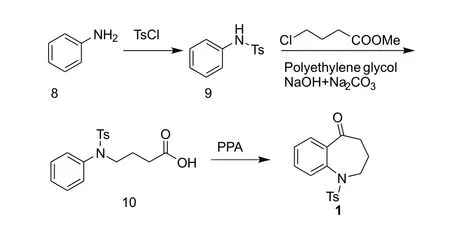
图2 考尼伐坦中间体合成方法2

图3 考尼伐坦中间体合成方法3
在新设计的合成路线中,以苯胺为起始原料,先与4-溴丁酸乙酯发生N-烷基化反应,然后用氯甲酸甲酯保护氨基,再经水解反应和傅克酰基化反应得到1-甲氧羰基-并氮杂-5-酮,具体合成路线如图4所示。

图4 考尼伐坦合关键中间体新合成路线
1 实验部分
1.1 实验仪器与试剂
主要实验仪器:XPE205型电子天平(梅特勒-托利多国际有限公司),GC-2014气相色谱仪(岛津企业管理(中国)有限公司),岛津LC-20A高效液相色谱仪(岛津企业管理(中国)有限公司),Bruker 400 MHz核磁共振波谱仪(瑞士布鲁克公司),WATERS超高效液相色谱-飞行时间质谱联用仪(美国沃特世公司)。
主要试剂:苯胺(国药集团),4-溴丁酸乙酯(武汉江民华泰医药化工有限公司),氯甲酸甲酯(国药集团),无水三氯化铝(国药集团),氯化亚砜(国药集团),六氟异丙醇(阿达玛斯),其他溶剂和试剂均为分析纯,无水二氯甲烷(自制)。
1.2 实验步骤
4-(苯胺基)丁酸乙酯(11)的合成:
在100 mL的三口烧瓶中加入苯胺(9.3 g,0.1 mol)和三乙胺(30.3 g,0.3 mol),加热到95℃ ~100℃后缓慢滴加 4-溴丁酸乙酯(24.3 g,0.125 mol)。滴加完毕后,在100℃反应2 h。TLC显示反应完毕,过滤除去三乙胺氢溴酸盐,得到棕黄色的溶液45.2 g,直接用于下一步反应。
4-(N-甲氧羰基苯胺基)丁酸(12)的合成:
将45.2 g 4-(苯胺基)丁酸乙酯粗品加入到100 mL的三口烧瓶中,然后再加入甲苯(30 mL)和碳酸钠(12.7 g,0.12 mol),冷却到0℃~5℃。控制温度在10℃以下缓慢加入氯甲酸甲酯(13.2 g,0.14 mol),加料完毕后,在0℃~10℃反应1 h。TLC显示反应完成后,加入水(20 mL)、甲醇(10 mL)和氢氧化钠(0.8 g),升温度到60℃,反应3 h。TLC显示原料消失,冷却至室温,分层,水相浓缩除去残余的甲醇,然后用乙酸乙酯(30 mL)萃取一次。水相加入二氯甲烷(30 mL),控制温度在20℃以下用35%的盐酸调pH至1~2。分层,水层用二氯甲烷(30 mL)萃取一次,合并二氯甲烷层,用无水硫酸钠干燥,过滤,减压浓缩除去二氯甲烷,得到20.6 g油状的中间体 12,收率 86.8%,纯度98.2%。1H NMR(400 MHz,CDCl3)δ:7.48-7.36(t,2H),7.22-7.16(m,2H),6.97-6.95(m,1H),3.62(s,3H),3.52-3.42(t,2H),2.41-2.37(t,2H),1.91-1.84(dd,2H);13C NMR(151 MHz,DMSO-d6)δ:173.99,155.24,129.01,127.27,126.53,52.56,49.03,30.66,23.20,MS[M+1]:238.0。
在250 mL的三口瓶中加入中间体12(20.6 g,86.8 mmol)、无水二氯甲烷 (100 mL)、氯化亚砜(10.8 g,91.0 mmol)和 N,N-二甲基甲酰胺(0.073 g,1 mmol),在室温下反应2 h。TLC显示原料反应完毕,在氮气保护下减压除去二氯甲烷和过量的氯化亚砜,然后加入六氟异丙醇(145 g,0.86 mol)在室温下反应5 h。反应完成后,减压浓缩除六氟异丙醇,粗品用柱层析纯化(洗脱剂:二氯甲烷),得到15.6 g黄色液体,收率81.9%,纯度 99.2%。1HNMR(400 MHz,CDCl3)δ:7.87-7.01(m,4H),3.59(s,3H),3.48-3.38(t,2H),2.68-2.64(t,2H),1.74-1.71(m,2H);13C NMR(151 MHz,CDCl3)δ:201.68,156.40,141.80,132.97,129.41,129.38,127.50,127.09,53.18,51.91,31.38,23.86.MS[M+1]:220.1。
2 结果与讨论
2.1 N-烷基化反应条件优化
芳胺与卤代烷烃的N-烷基化反应生成的产物主要是N-单取代产物和N,N-双取代产物,以及少量的原料,如图5所示。通过对反应温度、溶剂、缚酸剂和催化剂等条件的优化可以提高单取代产物的收率[12-14]。Radhe K等[14]人对2,6-二甲基苯胺的N-烷基化反应条件进行了优化,发现以三乙胺为缚酸剂,甲苯为溶剂,在100℃下反应,单取代产物收率最高。

图5 N-烷基化反应
2.1.1 4-溴丁酸乙酯的量对反应的影响
烷基化试剂的用量对反应有明显的影响,当烷基化试剂用量过多,N,N-双烷基化产物会明显增加,当烷基化试剂用量不足时,原料剩余较多。对N-烷基化试剂4-溴丁酸乙酯的用量进行了筛选,当其用量从1.0当量增加到1.3当量时收率明显增加,再继续增加4-溴丁酸乙酯的用量,双取代杂质14明显增加,收率降低,如图6所示。
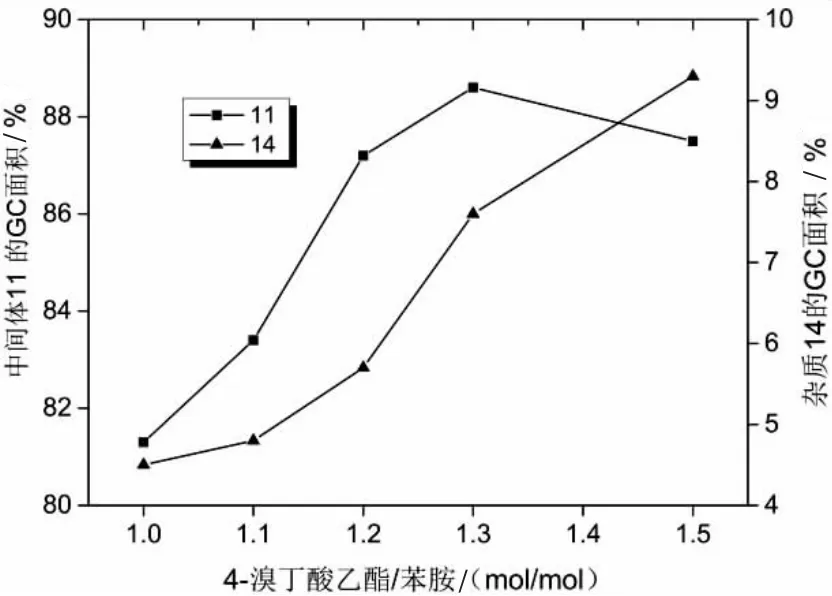
图6 4-溴丁酸乙酯的用量对反应的影响
2.1.2 碱对反应的影响
碱性的强弱对N-烷基化反应有重大影响[15-16]。在确定了4-溴丁酸乙酯的用量后,以甲苯为反应溶剂,对碱进行了筛选,结果见表1。
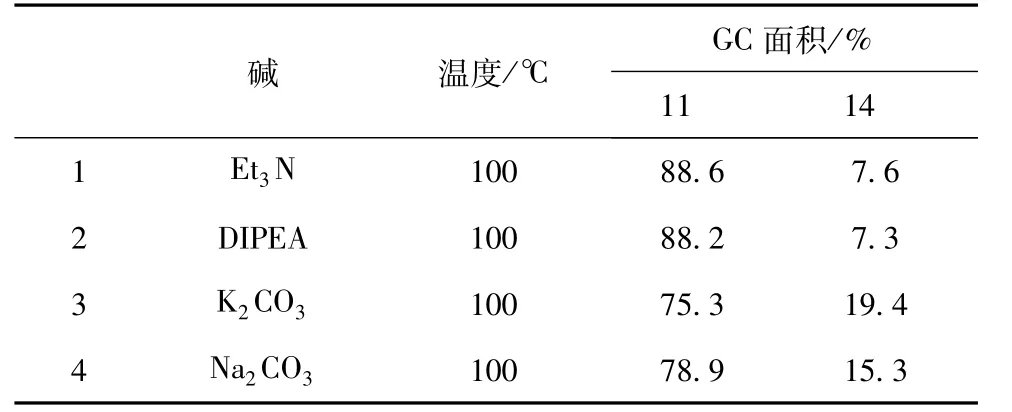
表1 碱对N-烷基化反应的影响
从表1可以看出,当使用有机碱三乙胺(Et3N)和二异丙基乙胺(DIPEA)时,化合物11的GC面积在88%~89%之间,副产物14含量在8%以下,而当使用无机碱碳酸钠 (Na2CO3)和碳酸钾 (K2CO3)时,副产物14明显增加。
2.1.3 三乙胺量对反应的影响
三乙胺在反应中用来束缚烷基化反应释放出来的HBr,使反应向正方向进行,三乙胺的用量过少反应不完全,用量过多使杂质14增加,并且增加物料成本,见表2。

表2 三乙胺量对反应的影响
从表2可以看出,中间体11的收率随三乙胺的用量增加而增加,在3当量时达到最大值,随后再增加三乙胺的用量收率基本不变。
2.1.4 反应温度的影响
反应温度一直都是影响反应的重要因素,在N-烷基化反应中,反应温度低时烷基化反应速度变慢,升高温度有利于反应的进行,但是也会提高生成N,N-双烷基化产物14的速度,见表3。
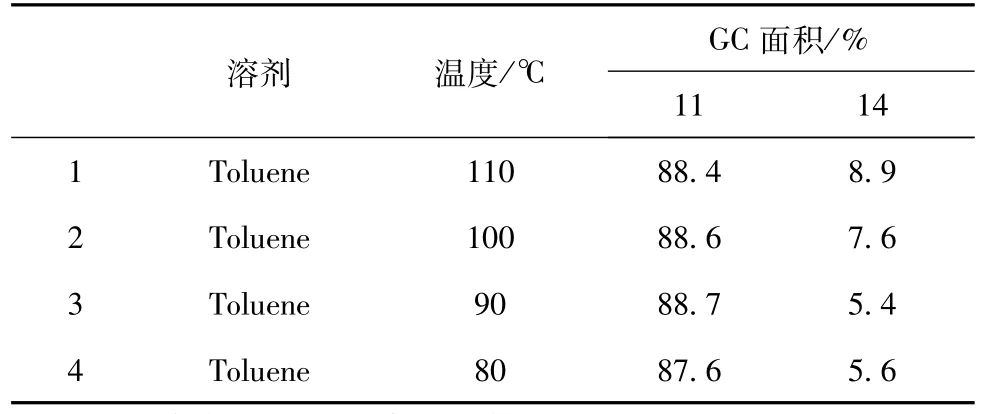
表3 反应温度对N-烷基化反应的影响
从表3可以看出,反应温度在90℃~110℃之间时对中间体11的收率影响较小,但N,N-双烷基化产物14含量明显随着温度上升而增加。反应温度在80℃时反应时间明显延长,因此反应在100℃较为合适。
2.1.5 反应溶剂对反应的影响
考察了极性较强的溶剂乙腈和小极性溶剂甲苯对反应的影响,乙腈为溶剂时反应在回流条件下进行,甲苯为溶剂时反应温度为100℃,如图7所示。从图7中可以看出,乙腈作为溶剂时收率降低,杂质14明显增加。

图7 反应溶剂对反应的影响
2.1.6 4-溴丁酸乙酯滴加时间对反应的影响
N,N-双烷基化产物14是由N-单烷基化产物11和4-溴丁酸乙酯继续反应生成的。降低溶液中4-溴丁酸乙酯的量有利于减少副产物14的生成,反应时将4-溴丁酸乙酯在100℃缓慢滴加到反应液中以期减少副产物14的生成。图8反映了4-溴丁酸乙酯的加料时间对反应的影响,从图中可以看出,中间体11的收率先随着滴加时间的延长而增加,随后缓慢降低,而杂质14则相反。
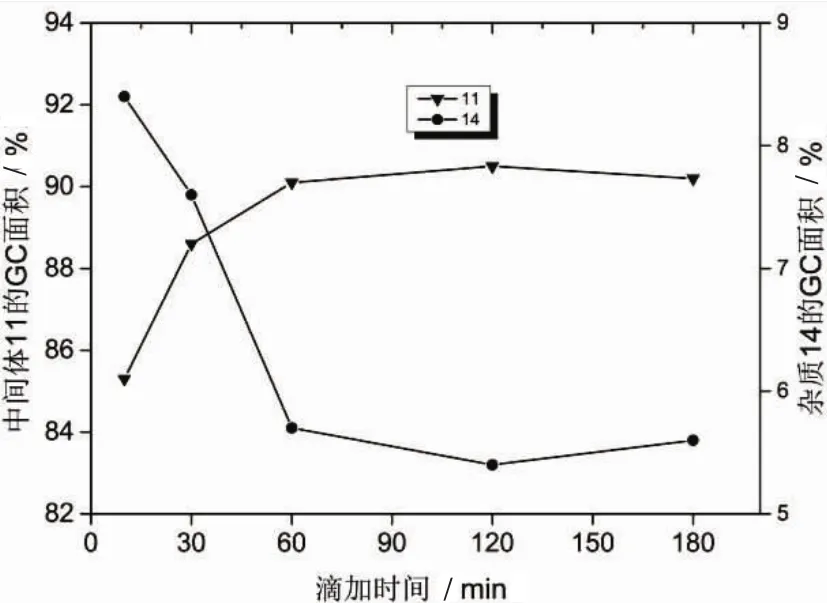
图8 滴加时间对反应的影响
2.1.7 溶剂量对反应的影响
溶剂量与反应浓度、原料成本和生产效率密切相关,减少溶剂用量能够提高单位体积的产能,也能降低原料成本,但溶剂量减少会增加反应物浓度,从而对反应产生影响。甲苯用量对反应的影响见表4。从表4可以看出,减少甲苯的用量对反应影响很小,即使在无溶剂条件下,收率也没有明显的变化。
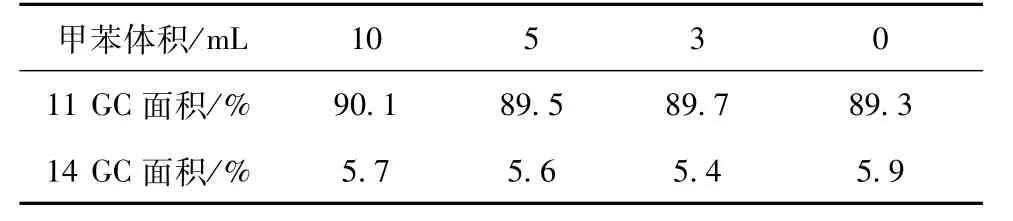
表4 溶剂用量对反应的影响
2.2 傅克酰基化反应
路易斯酸,如氯化铝、浓硫酸、多聚磷酸和三氟甲磺酸等,是傅克酰基化反应常用的催化剂[17-19],最近发现六氟异丙和锆-β沸石中等也可以催化傅克酰基化反应[20-21]。
2.2.1 氯化铝催化
氯化铝用量是影响傅克酰基化反应重要因素之一,表5反映了氯化铝用量对收率的影响。从表5可以看出,收率(从11到1a)随着氯化铝的用量增加而升高,在4当量后,再继续增加氯化铝的用量收率变化不明显。
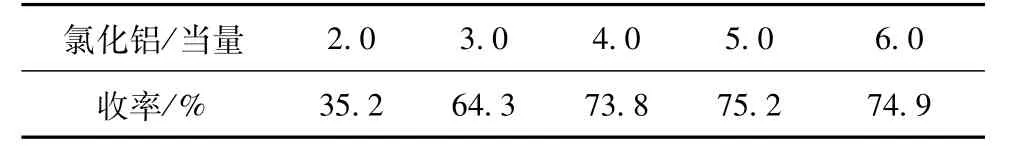
表5 氯化铝的用量对反应的影响
2.2.2 多聚磷酸催化
多聚磷酸催化傅克酰基化反应时,原料直接从羧酸(12)到目标产物。多聚磷酸在60℃以上才具有流动性,在110℃时,才能溶解在溶剂1,1,2,2-四氯乙烷中,因此在1,1,2,2-四氯乙烷中,反应温度在110℃的条件下,考察了多聚磷酸的用量对反应的影响,见表6。从表6可以看出,多聚磷酸的用量在1.0当量~2.0当量之间,收率没有明显变化。

表6 多聚磷酸用量对反应的影响
2.2.3 六氟异丙醇催化
Rakesh等人[22]报道了六氟异丙醇能够促进傅克酰基化反应,收率较高且没有废酸产生。研究了六氟异丙醇催化傅克酰基化关环反应,见表7。从表7可以看出,六氟异丙醇催化傅克酰基化反应收率明显高于氯化铝和多聚磷酸催化,在六氟异丙醇加入二氯甲烷(DCM)对收率没有明显影响。

表7 六氟异丙醇催化傅克酰基化反应
由表7可知,氯化铝和多聚磷酸为催化剂时收率相近并且都会产生大量的废酸,而多聚磷酸催化时无需先将羧酸转化为酰氯,因此多聚磷酸催化优于氯化铝催化。六氟异丙醇为反应试剂时,收率明显高于多聚磷酸作为反应试剂,并且反应条件温和无大量废酸产生。缺点是六氟异丙醇价格高和需要先将羧酸转化为酰氯,但是可以通过回收六氟异丙醇以降低成本[22]。综合比较,六氟异丙醇作为傅克酰基化试剂成本低且对环境友好。
2.3 4-(N-甲氧羰基苯胺基)丁酸中的杂质及纯化研究
在本路线中,从原料苯胺到4-(N-甲氧羰基苯胺基)丁酸中间没有经过纯化步骤,可以节约生产时间,减少损失。该步反应中的主要杂质如图9所示,其中杂质1来源于第一步N-烷基化时未反应的原料在第二步和氯甲酸甲酯反应,杂质2是第一步N-烷基化反应的双烷基化副产物在第三步水解反应生成的,杂质3是第一步反应剩余的原料4-溴丁酸乙酯在第三步水解产生。化合物12为酸性化合物,杂质1为中性化合物,杂质2在酸性条件下成盐且水溶性好,杂质3在水中溶解度好。因此在碱性条件下,用有机溶剂萃取出杂质1,水层酸化后产品可以被有机溶剂萃取出,而杂质2成盐不能被萃取出,杂质3水溶性大也不能被萃取出,纯化流程如图10所示。
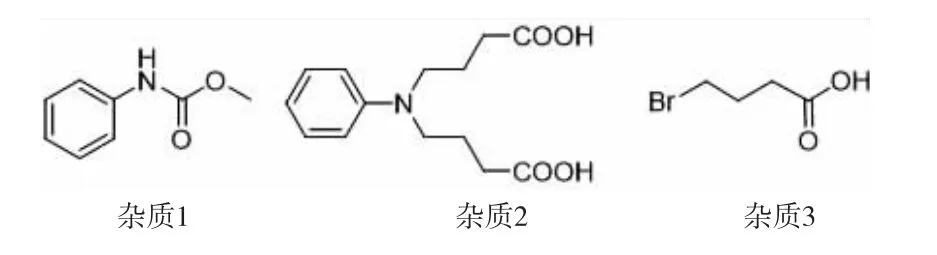
图9 化合物12粗品中的杂质结构
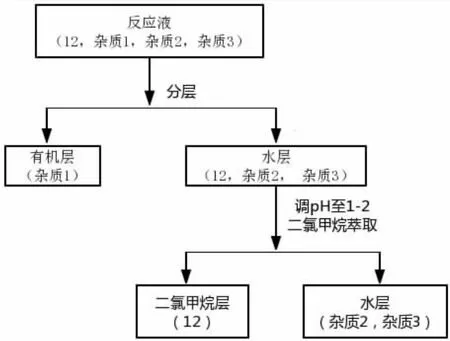
图10 化合物12的纯化步骤
3 结束语
改进后的盐酸考尼伐坦中间体的合成路线以廉价易得的苯胺为原料,经N-烷基化、氨基保护、水解以及傅克酰基化反应得到其关键中间体1-甲氧羰基-1,2,3,4-四氢-5H-苯并氮杂-5-酮。对工艺路线中对收率影响最大的N-烷基化反应和傅克酰基化反应的反应条件进行了优化,优化后的工艺简单易行,总收率达71.0%。
