云南省香格里拉市猪肠气泡病病例的组织病理学观察与病原检测
2020-07-06张容萍李红芳吴世洲鲁富有严达伟陈培富
张容萍,李红芳,吴世洲,鲁富有,严达伟,陈培富
(1.云南农业大学,云南昆明 650201;2.普洱市动物疫病预防控制中心,云南普洱 665000;3.迪庆藏族自治州动物疫病预防控制中心,云南香格里拉 674499)
肠气泡病(pneumatosis cystoides intestine,PCI)又称肠壁囊状气肿病、肠气肿病[1]。在猪群中,这种病例非常少见,且通常只有宰后检验时才被发现。剖检可见猪空肠和回肠段,尤其是在肠管与肠系膜连接处,出现直径1~2 cm 的气泡;在肠管浆膜下发生的气泡多呈丛状,而发生于肠管和肠系膜连接处的气泡多形成葡萄串状[2]。指压气泡均有捻发音。该病除散发于猪外,在羊和鸡中也有报告。人也有类似疾病[3],称为肠大泡性气肿(bullous emphysea of intestine)、囊肿性淋巴积气症(cystic lymphopneumatosis)、肠气肿(intestinal emphysema)、腹膜淋巴积气症(peritoneal lymphopneumatosis)等。国内人的类似疾病多见于儿童,婴儿通常表现腹泻症状,而成人基本不表现症状。近几年,发生于人结肠的肠管气囊肿症病例报道不断增多。
PCI 最早由日本池田义文和匈牙利胡体拉等学者于1980年发现和提出[1,4],随后国内也陆续出现相关报道,但均只见于20 世纪80-90年代,且仅限于病理报告或组织形态描述,鲜有对其发病原因、致病机理等方面的研究报道。因不引起明显的临床症状,该病往往不被重视。国内外屠宰检疫人员认为,此病并不影响胴体合格率,将肠道弃之,其余部分仍可销售及食用。尽管如此,患病猪屠宰后仍会引起人们的感官不适以及对猪肉卫生状况的担忧。近年在云南省多地不同品种猪中均零星发现该病,其中在香格里拉市发现病例较多。为探讨其发病原因及致病机理,开展了织病理学观察与病原检测。
1 材料与方法
1.1 材料
1.1.1 样品来源 样品采集自香格里拉市某藏猪场屠宰时发现有肠气泡病的4 头出栏商品猪,包括肝素抗凝血液和有肠气泡病变的小肠组织、肠系膜及其淋巴结,以及正常个体对照组织样品。宰前临床检查时,未发现正常猪和患病猪在体温、脉博、呼吸、精神、运动等方面存在明显差异,也未见饲料(玉米为主)霉变及脂肪肝情况。但饲养人员报告患病猪在仔猪阶段曾有腹泻经历,估计发病率约为5%。
1.1.2 主要试剂 病毒核酸提取试剂盒(TaKaRa Mini BEST 5.0 病毒RNA/DNA 提取商品化试剂盒)、逆转录试剂盒(TAKARA PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit),均购自宝生物工程(大连)有限公司;琼脂糖胶回收试剂盒(TIANgel Midi purification kit DP209-02),购自北京天根生化科技有限公司;基于胰蛋白酶大豆胨琼脂(TSA)的绵羊血琼脂,为自行配制;引物,由昆明擎科生物公司合成。根据猪瘟病毒(CSFV)E2基因[5]、猪流行性腹泻病毒(PEDV)ORF3基因[6]、传染性胃肠炎病毒(TGEV)N基因[7]和轮状病毒(RV)常见B 群VP6基因[8],分别设计特异性引物(表1)。依据文献[9-12]的报道,合成细菌16S rRNA 通用引物和大肠杆菌腹泻相关毒力基因引物(表2)。

表1 病毒核酸引物序列
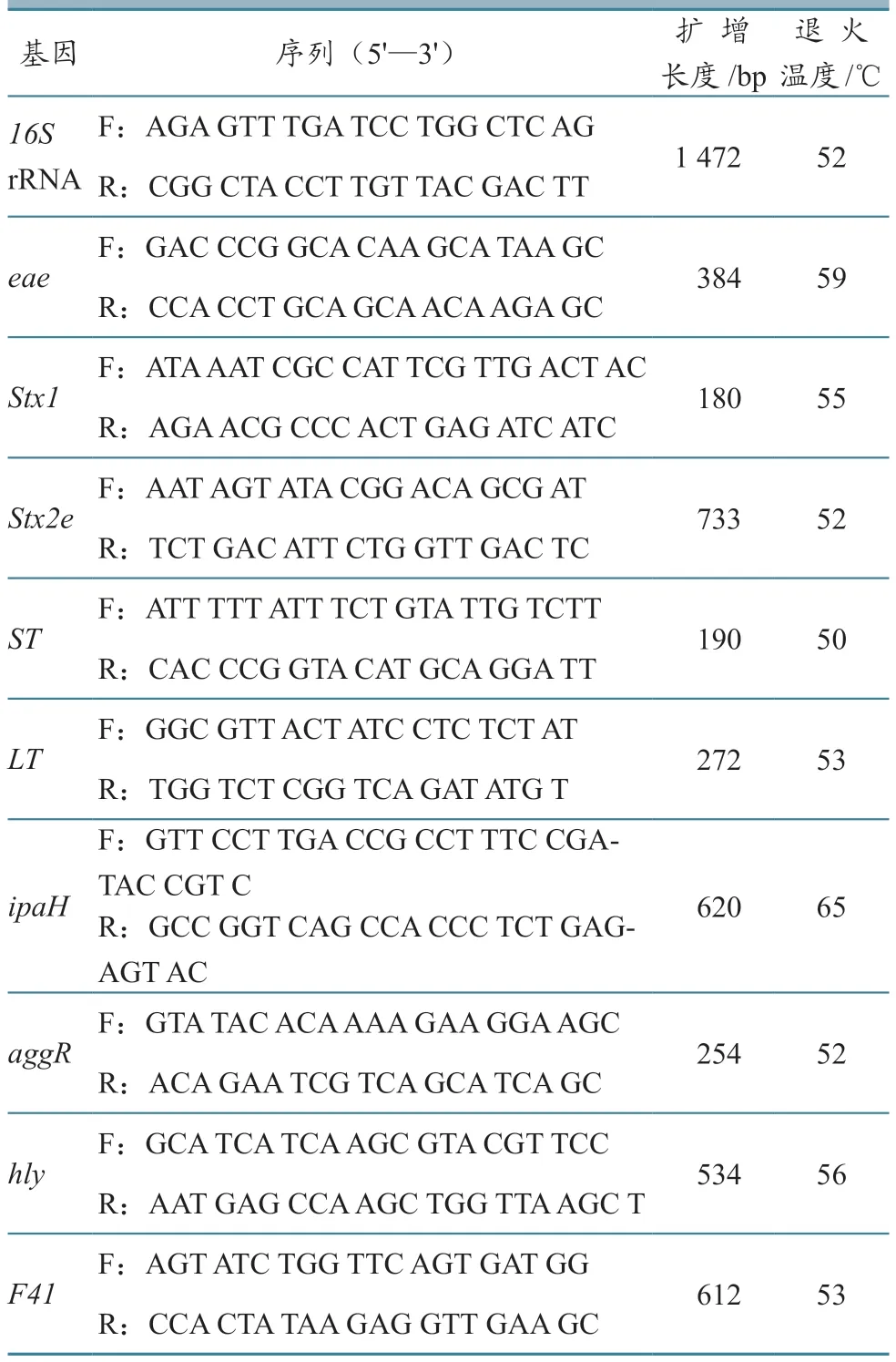
表2 细菌16SrRNA 基因和毒力基因核酸引物序列
1.2 方法
1.2.1 病毒核酸检查 参照TaKaRa Mini BEST 5.0 病毒RNA/DNA 提取商品化试剂盒说明书,从组织样品研磨液中提取病毒RNA;使用TaKaRa PrimeScriptTMⅡ 1stStrand cDNA Synthesis Kit 进行逆转录反应。在冰盒上配置20 µL 反应体系:Primerscript Ⅱ RTase 1 µL,5×PrimerScript Ⅱ Buffer 4 µL,RNase Inhibitor 0.5 µL,dNTP Mixture 1 µL,oligo dT primer 1 µL,Ramdom 6 mers 1 µL,RNase free dH2O 9.5 µL,RNA 模板2 µL。反应条件:30 ℃10 min,42 ℃ 45 min,95 ℃ 5 min。以cDNA 为模板,PCR 扩增病毒核酸,反应体系为:Mix 8.5 µL、ddH2O 8.5µL、上游引物0.5 µL、下游引物0.5 µL、DNA 模板2 µL。扩增程序为:95 ℃ 4 min 预变性,95 ℃ 40 s、53 ℃ 40 s、72 ℃ 50 s,30个循环;72 ℃10 min。1%琼脂糖凝胶电泳检查扩增产物。
1.2.2 细菌分离鉴定 分别取20 µL 血液、少许气泡内壁刮取物、气泡根蒂组织及肠壁刮取物,涂布于血琼脂平板表面作有氧培养,涂布于添加半胱氨酸盐酸盐的血琼脂平板作无氧培养,37 ℃恒温箱培养24 h。将不同形态的菌落划线转种相应培养基继续培养1~2 代,直至形成菌落形态完全一致的纯培养物,再接种于麦康凯培养基或LB 液体培养基,培养过夜。取1 mL 细菌悬液与50%灭菌甘油等体积混匀,置于-80 ℃冰箱保存备用。将剩余菌液用于革兰染色镜检、生化发酵管培养及其他检查。生化试验包括,吲哚靛基质、甲基红(MR)、二乙酰(V-P)、三糖铁琼脂及其他糖发酵产酸产气试验。以细菌DNA 为模板,配制扩增16SrRNA基因的50 µL 体系:Mix 23 µL、上游引物1 µL、下游引物1 µL、DNA 模板2 µL、ddH2O 23 µL;PCR 扩增程序:95 ℃预变性5 min;94 ℃ 50 s,52 ℃45 s、72 ℃ 50 s,35个循环;72 ℃延伸10 min。1%琼脂糖凝胶电泳鉴定PCR 扩增结果。对PCR 产物作胶回收,经TA 克隆于pMD-18T,转化Trans T-1 大肠杆菌感受态细胞,从培养后的琼脂平板,随机挑选5~8个单菌落进行质粒DNA 测序,将所获序列使用DNAstar(5.0)软件进行分析并在NCBI 网站作BLAST 在线比对。毒力基因PCR 扩增体系(20 µL):Mix 8 µL、上游引物1 µL、下游引物1 µL、模板DNA 2 µL、ddH2O 8 µL。扩增程序:95 ℃预变性5 min;94 ℃ 1 min、退火(表2)1 min、70 ℃ 2 min,30个循环;72 ℃延伸10 min。玻片凝集试验:将被检菌液于121 ℃加热1 h,破坏其可能含有的K 抗原,取O 抗原10 µL 于玻片上,吸取10 µL 多价血清与之充分混匀,轻轻摇动玻片,于1 min 内肉眼判断结果,若出现凝集,再以单价血清作凝集试验。
1.2.3 病理学研究分析 将制作好的小肠及肠系膜石蜡组织切片做HE 染色,镜下观察组织细胞结构变化情况。
2 结果
2.1 病理剖检及镜检
肠气泡病猪剖检可见,轻症个体在空肠和回肠肠管外表浆膜下有多量突起的气泡,重症个体在空肠和回肠段肠系膜有大量直1 cm 以内的葡萄串状透明气泡,看似卵巢囊肿,有的在腹部脂肪组织也可看到类似气泡;戳破气泡,未闻到任何气味;气泡壁和肠管壁有淤血(图1),其余内脏器官无肉眼可见病变。
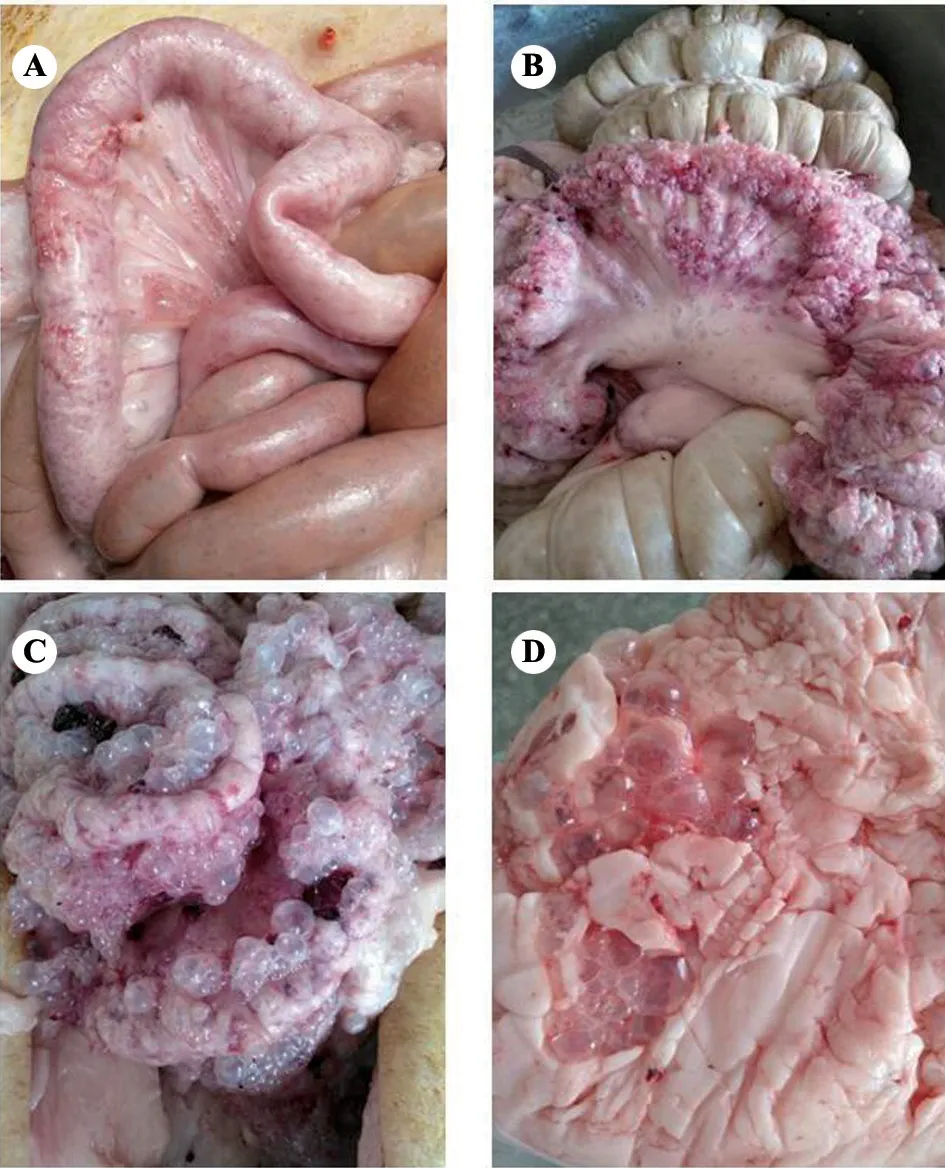
图1 肠气泡病猪剖检可见病变
光镜观察病理组织切片,可见患病猪肠管壁肌层和黏膜下层间充满大小不一的气泡,黏膜下层可见嗜中性粒细胞、淋巴细胞及嗜酸性粒细胞增多(图2-a);正常肠系膜结构呈规则网状结构排列,其间分布少量嗜酸性粒细胞,病变肠系膜网状结构紊乱(图2-b);肠系膜细胞淤血,脂肪细胞体积增大,结缔组织有大量炎性细胞渗出,见聚集的多核巨噬细胞、上皮样细胞,组织间隙较大,结缔组织增生,成纤维细胞和嗜酸性粒细胞增多,产生以慢性增生为主的炎症病变(图2-c);小肠肠腺体积增大,杯状细胞增多、体积明显增大(图2-d);肠系膜淋巴结巨噬细胞增多(图2-e)。
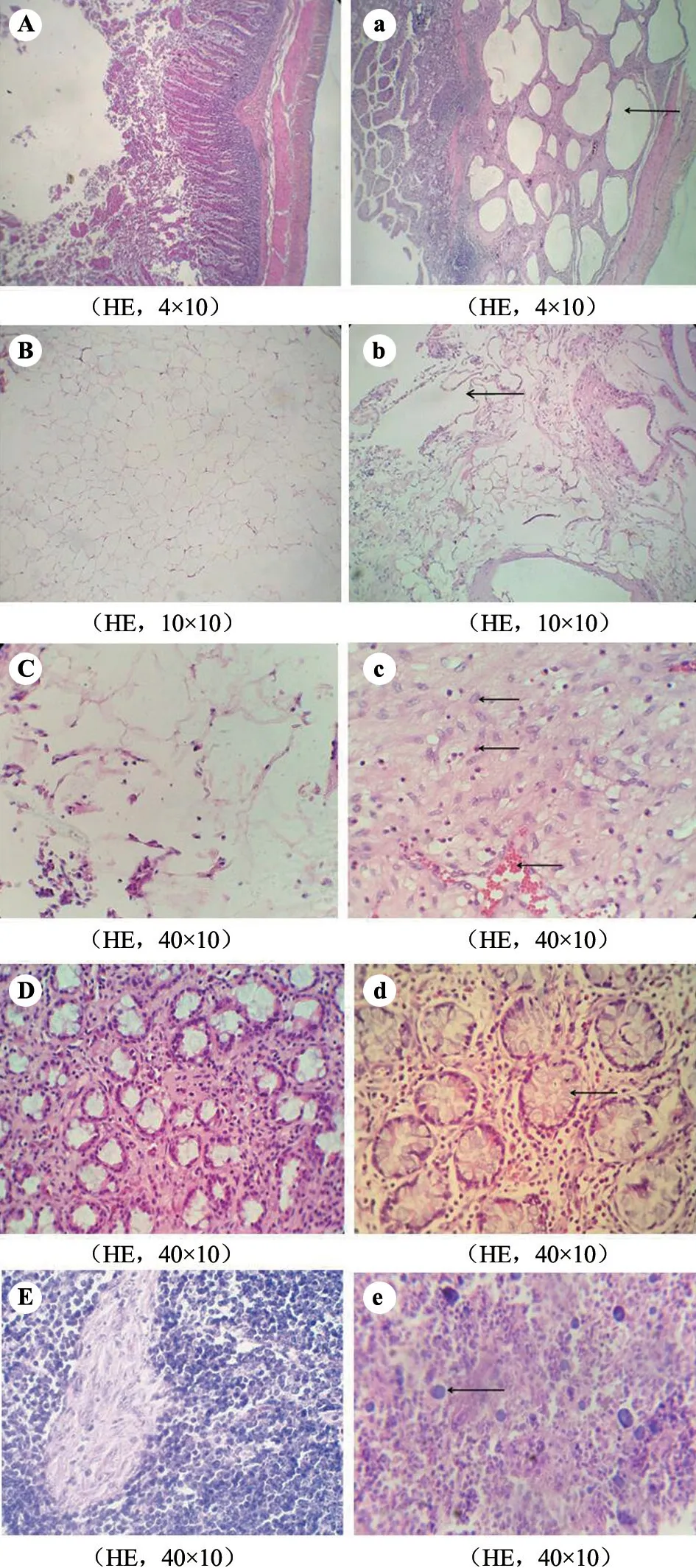
图2 组织切片形态学观察结果
2.2 病毒核酸检测
从5 份肠道上皮组织及白细胞提取核酸样品,进行CSFVE2基因、TGEVN基因、PEDVORF3基因及RVVP6基因的PCR 扩增检测,结果都为阴性。
2.3 细菌检查
患病猪血液、气泡根蒂组织及气泡内壁在血琼脂平板上均未见细菌生长;4 份病样和1 份正常样品的肠壁刮取物在血琼脂平板上,有氧和无氧条件下均为形态特征一致、光滑湿润的乳白色单一菌落。生化试验发现,分离菌株符合大肠杆菌特性。PCR 扩增16SrRNA 获得与目的片段预期大小相符的产物(图3)。TA 克隆经测序分析证实,分离菌株为大肠杆菌。随机挑取5个独立菌落作PCR扩增,未检出致病性大肠杆菌常见的9种毒力基因。菌液也未与O157、H7、O104、H4 阳性血清发生肉眼可见的凝集现象,表明不属于这些常见的致病性大肠杆菌血清型。
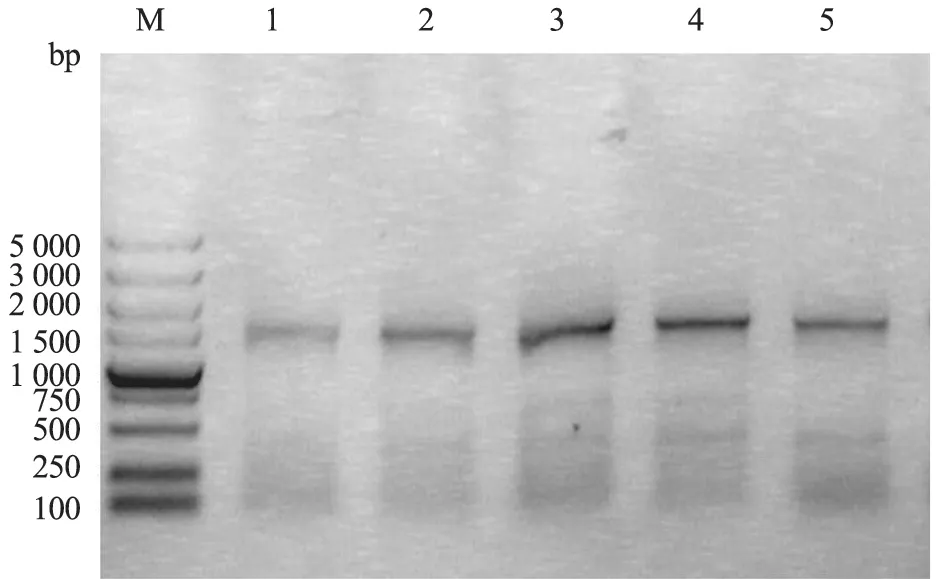
图3 分离菌株16S rRNA 基因的PCR 扩增结果
3 分析与讨论
该养猪场地处香格里拉市一座海拔约2 500 m的山坡上,昼夜温差通常达10 ℃以上,距离县城约100 km,与外界接触甚少。据该养猪场养殖人员介绍,肠气泡病的发病率为5%左右,冬季检出率较高,且患有肠气泡病的猪在仔猪阶段常有腹泻经历。本研究挑选仔猪阶段有腹泻经历的8 头出栏猪进行屠宰取样,检出4 头患肠气泡病,病变部位主要在空肠和回肠段肠系膜,其中1 头在腹部脂肪组织也观察到气泡病变,进一步检查未发现常见猪腹泻相关病毒,仅从肠壁刮取物中分离到不属于O157、H7、O104 或H4 血清群,且无常见致病基因的大肠杆菌。
猪肠气泡病是一类气体代谢异常疾病,其发生机制尚不清楚。国外学者曾用致病性大肠杆菌感染无菌猪,得到的悉生猪在大肠肠壁出现气泡囊肿,而其他内脏器官均表现正常[13],由此提出细菌学说。本研究发现,从肠气泡病猪中分离到的大肠杆菌并非常见致病血清型,且病变部位主要在小肠及其肠系膜,但不能排除大肠杆菌分离株可能存在其他或未知的毒力成分。本研究发现,肠腺及杯状细胞体积明显增大,这可能是患病个体小肠发生代偿性分泌肠液(黏液)的组织形态表现,提示腹泻相关因素对小肠产生了某种代谢压力。值得一提的是,根据2017年英国科学家加尔文·科菲提出的观点,肠系膜是一个连续但独立的器官,而非肠道组织的附属物[14],其功能及病理意义尚不清楚,因此全面阐明肠气泡病的发生机制可能需要从全新角度去考虑。
就本研究而言,基于大肠杆菌能分解乳糖、产生乳酸和氢气的生化特性,推测可能由于当地昼夜温差大,引起仔猪出现较大的胃肠冷热应激反应,从而一方面造成仔猪腹泻,另一方面形成利于肠内大肠杆菌生长的条件。大肠杆菌在肠道内厌氧分解饲料中的糖类,而产生大量不能被机体组织利用的氢气,在肠内形成较大的氢气压力。氢气经中央乳糜管吸收后游离进入小肠浆膜层,因其组织结构致密程度不一,从而形成大小不一的葡萄串状气泡,最终表现为肠气泡病。本研究发现1 例病猪在其腹部脂肪组织也有气泡形成,推测这可能是在特定压力下,气体在体内扩散的结果。本试验未检测到大肠杆菌分离株有致病性,提示猪肠气泡病基本不影响猪的生长发育,这与观察到的实际情况一致。组织病理学观察肠系膜及其淋巴结,发现嗜酸性粒细胞和巨噬细胞略有增多,提示肠气泡病会伴发轻度炎症。值得注意的是,尽管吉林、辽宁等平原地区[4,15]也有检出该病的报道,但香格里拉市海拔较高,血氧分压相对较低,这可能是肠气泡病的一个促发因素,以致该地发生猪肠气泡病的比例高于云南其他地区。按照类似设想,有学者指出吸氧疗法是早期祛除人肠管气囊肿症的有效疗法[16],但在猪中,如何防治肠气泡病仍是一个需要继续研究的课题。
