马泰勒虫RAP-1 基因的原核表达及蛋白性质分析
2020-07-06肖培培张梦圆特列克库拉别克刘世芳宋晶晶樊新丽
肖培培,张梦圆,特列克·库拉别克,刘世芳,宋晶晶,樊新丽,李 敏,张 杨
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.新疆维吾尔自治区动物卫生监督所,新疆乌鲁木齐 830063;3.中国医学科学院北京协和医学院药用植物研究所云南分所药理中心,云南景洪 666100;4.西双版纳州傣药南药重点实验室,云南景洪 666100)
马泰勒虫(Theileria equi)属顶复门、梨形虫目、泰勒科、泰勒属,是一种专性细胞内寄生原虫[1],寄生于马、驴、骡和斑马等马属动物的红细胞、淋巴细胞内,引起蜱传血液原虫病——马泰勒虫病[2-3]。该病具有明显的季节性及地区性,与媒介硬蜱的活动规律有关[4-5]。患病动物临床表现为发热(多为稽留热)、贫血、呼吸困难、水肿、血红蛋白尿、黄疸及败血症,以及孕畜流产及新生幼畜死亡[6]。尽管患病动物临床症状可经药物治疗后消失,但并不能清除患畜体内的病原体,其将终生携带病原[7],这为该病的传播及流行提供了条件。由于媒介蜱的广泛存在,马泰勒虫病发病率不断上升,流行区域也不断扩大,严重制约了马产业的发展[8]。目前没有针对马泰勒虫病的有效疫苗,对马泰勒虫病的控制仅依赖于药物治疗、蜱媒控制以及限制受感染马匹的移动。
棒状体相关蛋白1(rhoptry-associated protein 1,RAP-1)位于顶复门原虫裂殖子的棒状体上,在子孢子阶段也有表达,是虫体与宿主红细胞粘附后,由棒状体分泌的,与入侵红细胞相关的蛋白[9]。研究表明:RAP-1 蛋白包含多个抗原表位,可诱导机体产生体液免疫和细胞免疫;感染驽巴贝斯虫的马匹可产生针对RAP-1 蛋白的抗体,因此RAP-1 蛋白可用于驽巴贝斯虫的血清学诊断[10]。对牛巴贝斯虫RAP-1 与裂殖子表面抗原1(MSA-1)的研究表明,RAP-1 可能共同参与了裂殖子对红细胞的侵袭过程[11]。对双芽巴贝斯虫RAP-1 直系同源物的研究表明:针对RAP-1 的单克隆抗体能够在体外抑制虫体增殖[12-13];用天然的RAP-1 或重组融合蛋白免疫小牛,发现在裂殖子感染时,平均寄生虫血症峰值明显减少[14-15];用重组RAP-1 蛋白刺激淋巴细胞建立的T 细胞对牛巴贝斯虫有应答,但对双芽巴贝斯虫裂殖子无应答,而通过用牛巴贝斯虫膜抗原重复刺激淋巴细胞建立的T 细胞系可对RAP-1 强烈增殖,证明了该蛋白的免疫显性特性[16];用纯化的牛双芽巴贝斯虫RAP-1 免疫牛,使其产生了部分保护性反应,因此RAP-1 被作为澳大利亚研制的重组疫苗中的抗原之一[17]。以上研究有力证明了RAP-1 在巴贝斯虫生物学和发育过程中发挥了功能作用,作为免疫原性蛋白,参与对红细胞的侵袭过程,被认为是潜在的候选疫苗抗原[18]。
由于顶复门原虫裂殖子的表面蛋白或由细胞器所分泌的蛋白介导虫体侵入宿主的红细胞过程,因此这些蛋白被作为抗原蛋白或药物靶点的研究重点。目前已经鉴定了巴贝斯虫属和疟原虫属中的RAP-1 蛋白[19],但关于马泰勒虫RAP-1 蛋白的研究目前开展较少。本研究扩增了马泰勒虫RAP-1基因片段;对重组蛋白进行了表达纯化,检测了其免疫原性,又以巴贝斯属、泰勒属、疟原虫属的顶复门原虫的RAP-1 蛋白为靶标,构建了进化树;对RAP-1蛋白理化性质及结构进行了分析和预测,以期为进一步研究该蛋白的生物学功能或研制亚单位疫苗提供参考。
1 材料与方法
1.1 材料
马泰勒虫阳性血液、pET-32a(+)表达载体以及马泰勒虫标准阳性、阴性血清,均由新疆农业大学动医学学院寄生虫实验室提供;pMD 19-T载体、DH5a 感受态细胞、限制性内切酶EcoRI 和XhoI、T4DNA 连接酶、Total RNA 提取试剂盒、Fast King RT Kit 反转录试剂盒、琼脂糖凝胶回收试剂盒,均购自北京鼎国昌盛生物技术有限责任公司;BL21 感受态细胞和Protein Marker,购自北京全式金生物技术有限公司;质粒小量提取试剂盒,购自OMEGA 生物试剂公司;2×EsTaqMaster Mix,购自康为世纪生物科技有限公司;HisSep Ni-NTA 6FF Chromatography Column,购自上海翊圣生物科技有限公司;辣根过氧化物酶(HRP)标记的兔抗马IgG,购自北京博奥森生物技术有限公司。所用水为超纯水。
1.2 总RNA 提取
按照RNA 提取试剂盒说明书,提取马泰勒虫阳性血液样品的总RNA。应用Fast King RT Kit 反转录试剂盒,以提取的RNA 为模板,合成第一链cDNA;cDNA 合成后分装,一部分用于基因扩增,其余置于-80 ℃保存。
1.3 引物设计与合成
参考GenBank 报道的马泰勒虫RAP-1基因序列和原核表达载体pET-32a(+)图谱酶切位点,使用Oligo 软件设计引物RAP-1-P1(5'-GAATTCCTCATAAGGCACAGAGAAA-3') 和RAP-1-P2(5'-CCGCTCGAGAAGCTTAATCTCAGAGGG-3')。加下划线的序列分别对应EcoRI、XhoI 酶切位点。引物由生工生物工程(上海)股份有限公司合成。
1.4 RAP-1 基因扩增
以1.2 制备的cDNA 为模板,用1.3 设计的引物,通过PCR 技术扩增RAP-1基因(95 ℃5 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环,72 ℃ 5 min)。反应结束后,取5 µL PCR产物于1%的琼脂糖凝胶上进行电泳检测。
1.5 RAP-1 基因进化树分析
选取顶复门原虫驽巴贝斯虫(B.caballi,登录号GQ871780.1、KF059876.1),双芽巴贝斯虫(B.bigemina,登录号AB586126.1、KT312797.1),分歧巴贝斯虫(B.divergens,登录号HQ538420.1、HQ538430.1),恶性疟原虫(P.falciparum,登录号FJ407006.1、GQ281628.1),牛巴贝斯虫(B.bovis,登录号FJ588009.1、L77326.1),马泰勒虫(T.equi,登录号XM_004830353.1),应用MEGA 6.0 软件,以选取的11种顶复门原虫及本研究测定的RAP-1基因为靶标,以最大似然法构建进化树。
1.6 RAP-1 蛋白理化特性和二、三级结构预测
运用在线工具ProtParam(https://web.expasy.org/protparam/) 及ProtScale(http://web.expasy.org/protscale/),分析蛋白的理化特性、亲(疏)水性;用TMHMM 法,分析蛋白质跨膜区;运用DNAstar 软件,预测分析RAP-1 蛋白的二级结构;用在线工具Swiss model(https://swissmodel.expasy.org/),构建RAP-1 蛋白的三级结构模型;用PyMOL 分子三维结构,显示软件分析该蛋白的三维结构。
1.7 pET-32a-RAP-1 重组质粒构建
根据胶回收纯化试剂盒说明书回收目的片段,用纯化后的RAP-1 片段与克隆载体pMD 19-T连接,将连接产物转化至大肠杆菌DH5α 感受态细胞中,菌液鉴定为阳性的克隆,送至上海生工生物工程有限公司测序,将测序正确的克隆命名为19-T-RAP-1;根据质粒小提试剂盒说明书提取19-T-RAP-1、pET-32a(+)质粒,将重组质粒和pET-32a 载体双酶切(EcoRI、XhoI),回收目的片段和空载体,用T4DNA 连接酶于16 ℃过夜连接,转化至大肠杆菌BL21 感受态细胞;37 ℃培养12~14 h 后,挑取单个菌落,通过菌液PCR 鉴定阳性克隆;提取质粒进行酶切验证并测序,将经测序鉴定正确的重组质粒命名为pET-32a-RAP-1。
1.8 重组蛋白诱导表达及纯化
将pET-32a-RAP-1 阳性菌液于含100 µg/mL氨苄青霉素的LB 液体培养基(50 mL)中小量诱导,测定重组蛋白的表达情况。于37 ℃ 180 r/min 培养至OD 值达0.4~0.6 时,分别加入终浓度为0.2、0.4、0.6、0.8、1.0 mmol/L 的IPTG,37 ℃诱导表达,然后分别收集1~7 h 的菌液进行SDS-PAGE 电泳分析;以最佳的诱导时间和浓度进行表达,超声破碎菌体后离心,分别取上清和沉淀进行可溶性分析。
将pET-32a-RAP-1 阳性菌液扩培至400 mL 的含100 µg/mL 氨苄青霉素的LB 液体培养基,当OD 值达0.4~0.6 时,加入终浓度为0.4 mmol/L 的IPTG,诱导2 h,离心收集诱导表达后的菌液;加10 mL 的破菌液,混匀,超声破碎(功率为40 W,超声5 s,间歇5 s,40 min);8 000 r/min,4 ℃离心10 min,最后收集上清/沉淀进行蛋白纯化。
1.9 Western-blot
取10 µL 重组蛋白样品进行SDS-PAGE 电泳后,半干转印于硝酸纤维素膜(NC 膜)上,用封闭液(5%脱脂乳,含0.5% Tween 的PBS 稀释)封闭1 h,加马泰勒虫阳性血清作为一抗(1:100),37 ℃ 反应2 h;将二抗辣根过氧化物酶(HRP)标记的兔抗马IgG(HRP-兔抗马IgG)用5%脱脂乳1:6 000 稀释,37 ℃ 孵育1.5 h;最后,于DAB 显色液中37 ℃避光孵育5 min,观察结果。
2 结果
2.1 RAP-1 基因扩增
PCR 扩增产物经1%琼脂糖凝胶电泳,得到1 236 bp 的片段(图1),与预期片段大小一致。
2.2 遗传进化分析
分别选取巴贝斯属、泰勒属及疟原虫属的顶复门原虫RAP-1基因序列(登录号GQ871780.1、KF059876.1、AB586126.1、KT312797.1、HQ538420.1、HQ538430.1、FJ407006.1、GQ281628.1、FJ588009.1、L77326.1、XM_004830353.1),应用MEGA 6.0 软件构建进化树,进行系统发育分析。结果显示:本试验所得RAP-1基因序列与GenBank 上发表的马泰勒虫序列聚为一支,置信度为100%;巴贝斯属的不同虫株相聚类,马泰勒虫虫株与恶性疟原虫虫株相聚类,表明两者亲缘关系较近(图2)。

图2 运用最大似然法构建的RAP-1 基因核苷酸序列系统发育树
2.3 RAP-1 蛋白理化特性和二、三级结构预测分析
蛋白理化性质结果显示,RAP-1 蛋白理论等电点为9.85,半衰期为30 h,不稳定系数为43.33,总平均亲水性为-0.368。ProtScale(http://web.expasy.org/protscale/)分析蛋白的亲(疏)水性结果显示(图3-A):MIN 为-2.600,MAX 为2.011;由图可以看出,标度值<0 的区域与>0的区域相比较为密集,结合理化性质中的总平均亲水性(GRAVY)值,总体上认为是亲水性蛋白。使用TMHMM 法分析蛋白质跨膜区,发现氨基酸位于细胞膜表面,无跨膜区(图3-B)。二级结构(图3-C)显示:RAP-1 蛋白结构主要包括α-螺旋、β-折叠、β-转角和无规卷曲4种类型,占比分别为38.5%、15.5%、27.8%、18.1%。通过Swiss model软件,对马泰勒虫RAP-1 蛋白进行同源建模,用PyMOL 分子三维结构显示软件,对该蛋白的三维结构进行比对分析。结果(图3-D)显示:蓝色为α-螺旋结构、β-折叠结构,红色标注位置为半胱氨酸所在位置。该蛋白结构比较简单,在RAP-1三级结构中α-螺旋占据较多构象。
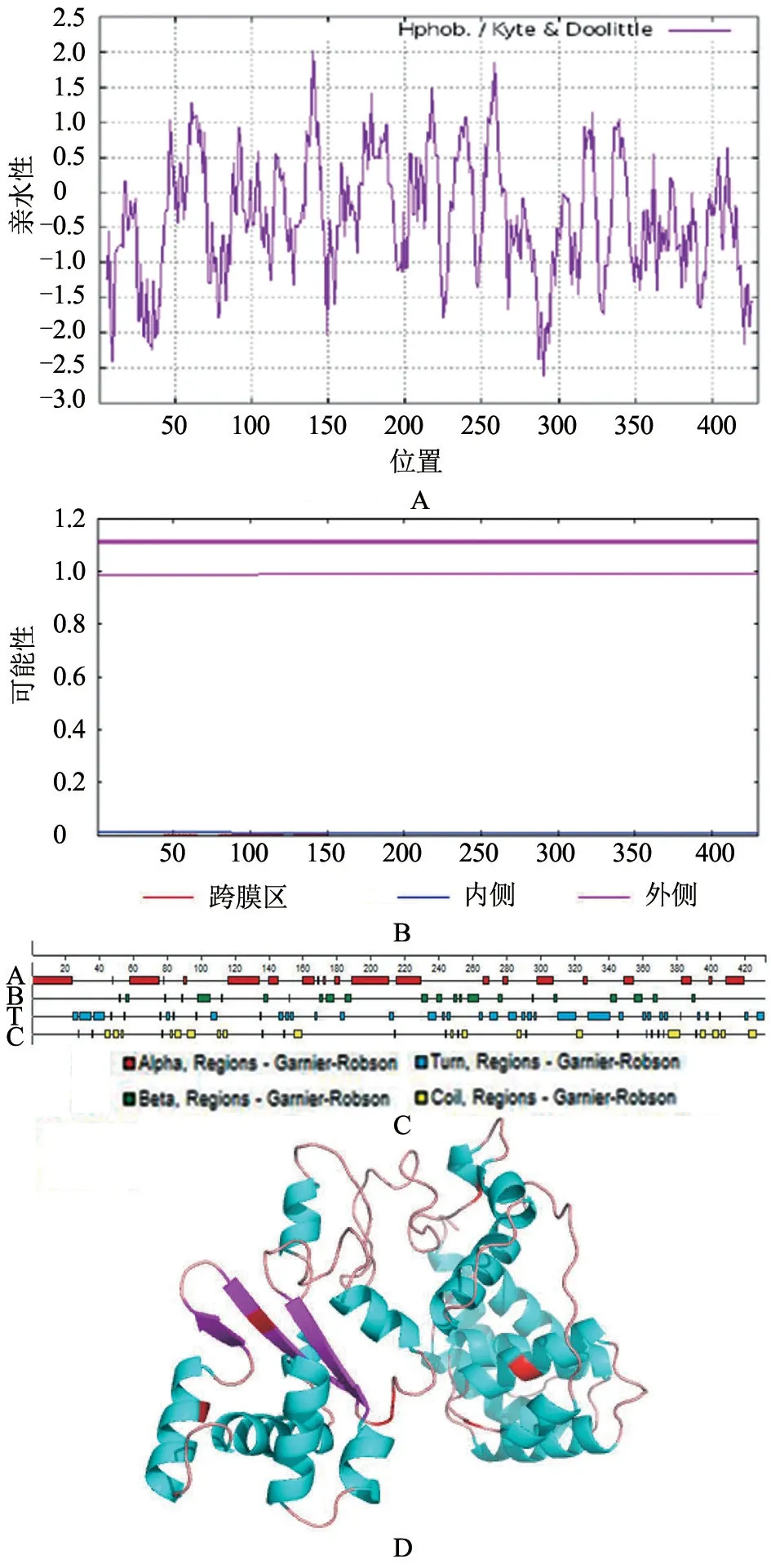
图3 马泰勒虫RAP-1 理化特性和二、三级结构预测分析结果
2.4 重组质粒双酶切
重组质粒经过EcoRI 和XhoI 双酶切,酶切产物经1%琼脂糖凝胶电泳,结果得到两条特异性条带(图4),表明目的基因RAP-1插入到表达载体pET-32a(+)中,并测序成功,说明重组质粒pET-32a-RAP-1 构建成功。
2.5 RAP-1 重组蛋白SDS-PAGE 诱导表达
将pET-32a-RAP-1 阳性菌液加入含100 µg/mL氨苄青霉素的LB 液体培养基中,180 r/min,37 ℃ 培养至OD 值达到0.4~0.6 时,加入终浓度为1 mmol/L IPTG 进行诱导表达,筛选诱导时间;于不同IPTG 浓度下诱导表达,筛选最佳诱导时间。SDS-PAGE 分析结果显示,以终浓度为0.4 mmol/L IPTG 诱导2 h 时,蛋白表达量最高(图5~6)。诱导后的表达产物大小约65 kDa,与其理论值基本一致。选用最佳诱导时间和诱导浓度,经过超声破碎,离心分别收集上清和沉淀,进行SDS-PAGE检测,结果发现沉淀中表达蛋白杂带较少,表达蛋白主要存在于沉淀中,为包涵体蛋白(图7)。
2.6 重组蛋白纯化
使用镍柱纯化试剂盒纯化浓缩蛋白,将制备样品进行SDS-PAGE 电泳,收集后检测其浓度。纯化结果见图8。

图6 重组蛋白最佳诱导浓度
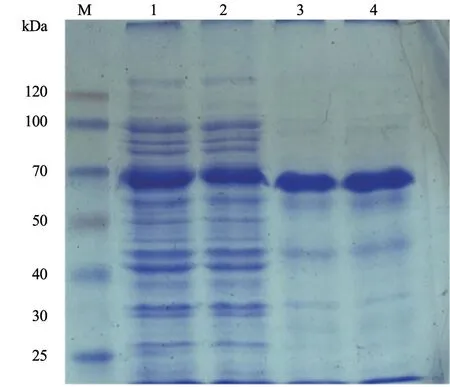
图7 重组蛋白最佳诱导时间和IPTG 浓度诱导后可溶性蛋白分析结果
2.7 表达产物Western-blot 分析
用破菌液悬浮收集菌体,超声破碎至半透明状态,进一步处理表达产物,经SDS-PAGE 电泳后转移至NC 膜上。结果表明,马泰勒虫阳性血清与蛋白反应,在65 kDa 处有条带出现(图9),表明该重组蛋白具有特异性和反应原性。
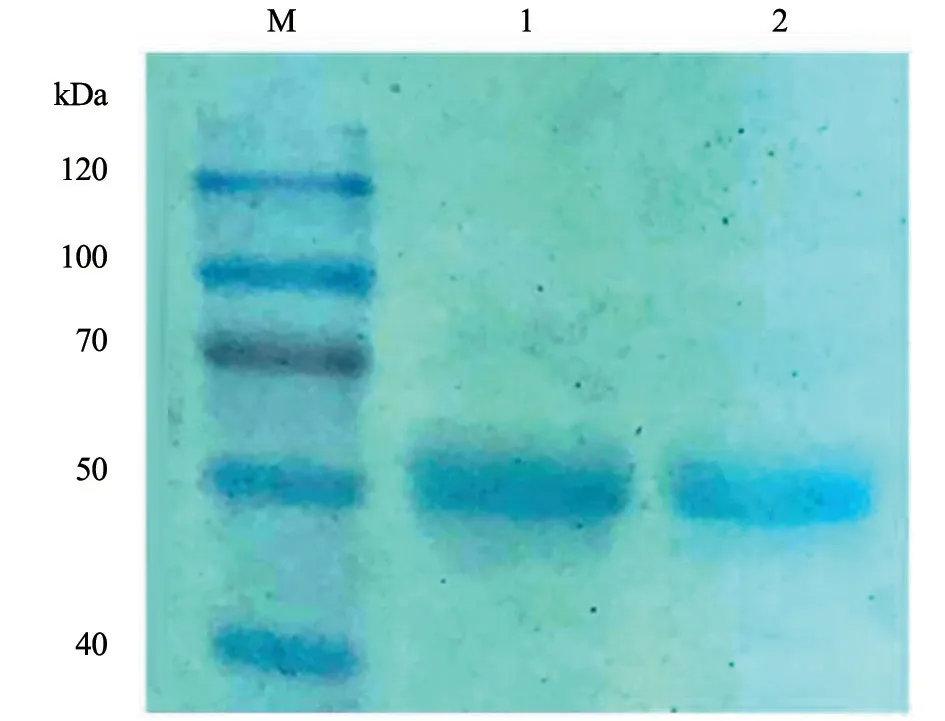
图8 pET-32a-RAP-1 重组蛋白纯化结果
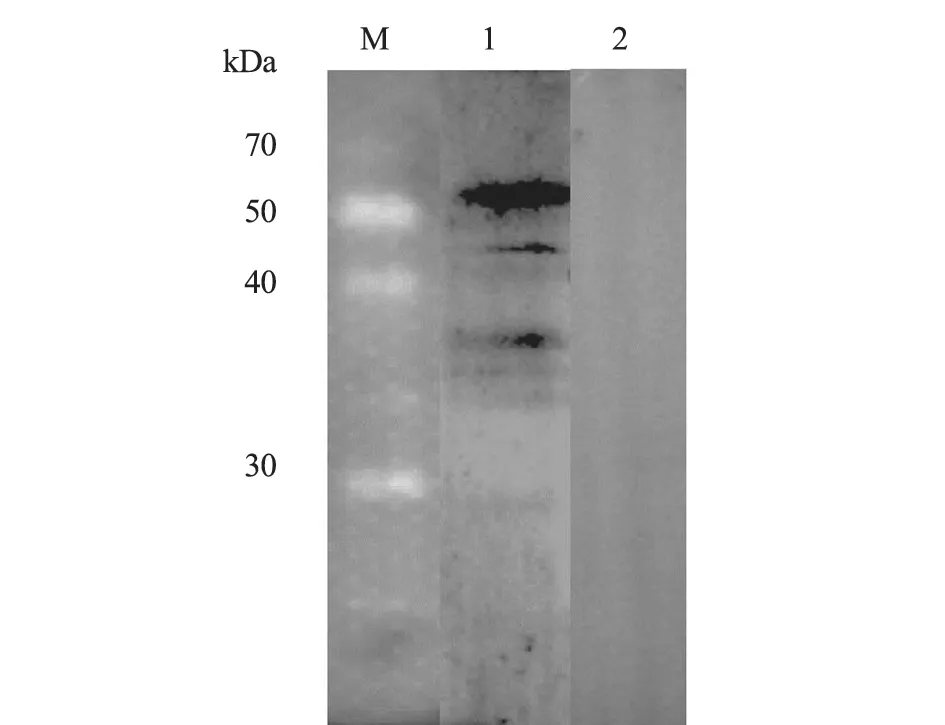
图9 pET-32a-RAP-1 重组蛋白Western-blot 结果
3 讨论
顶复门原虫的分泌型细胞器棒状体和微线体在虫体侵入宿主红细胞过程中分泌的,与入侵相关的保守蛋白——棒状体相关蛋白(rhoptry associated protein,RAP)可与微线体顶端膜抗原(microneme protein apical membrane antigen,AMA1)形成运动结合体,在虫体入侵过程中发挥关键作用[20]。棒状体相关蛋白被认为是保护虫体侵入以及入侵后期进行繁殖的关键分子,在纳虫空泡形成过程中发挥重要作用,被认为是侵入宿主细胞的主要毒力因子[21]。在顶复门原虫RAP 的研究中,弓形虫、疟原虫和柔嫩艾美耳球虫的RAP 研究较深入。以往的相关研究成果表明了棒状体蛋白在抵御虫体侵入和免疫保护方面起到了关键作用,指明RAP 研究将作为未来疫苗及诊断抗原研究的重要方向[22-24]。目前对RAP 的研究主要集中在RAP 对宿主侵入功能等的初步验证,尚无对宿主细胞相互作用影响的文献发表。本试验结果表明,原核表达所获得的融合蛋白RAP-1 分子质量为65 kDa;Western-blot 分析结果表明,该重组蛋白能被马泰勒虫标准阳性血清识别,具有良好的反应原性。对以巴贝斯属、泰勒属及疟原虫属顶复门原虫RAP-1基因为靶标构建的进化树的结果显示,巴贝斯虫属的不同虫株相聚类,恶性疟原虫与马泰勒虫虫株序列相聚类。与巴贝斯虫相比,恶性疟原虫与马泰勒虫这两种虫体的入侵方式可能更为相似,其原因还有待研究。RAP-1 的二级结构预测结果显示:其含有丰富的α-螺旋和β-转角,推测该蛋白性质稳定;三级结构的构建直观立体地展现了RAP-1 的形态,为进一步研究该蛋白功能提供可视化依据。RAP-1基因的获得为我国马泰勒虫病的流行病学调查、免疫学诊断、筛选药物靶标,以及该基因在入侵中的明确作用、疫苗候选奠定了基础。
