原发性肺淋巴上皮瘤样癌的MDCT影像学特征及临床表现
2020-06-23陈相猛张嘉瑜段晓蓓金志发谭国强龙晚生张朝桐罗学毛柳学国
陈相猛,张嘉瑜,段晓蓓,金志发,谭国强,龙晚生,张朝桐,罗学毛,柳学国
淋巴上皮瘤样癌(lymphoepithelioma-like carcinoma,LELC)是临床少见的恶性肿瘤,常合并EB病毒(epstein-barr virus,EBV)感染,好发于鼻咽部,也可以发生在前肠衍生器官如唾液腺、胸腺、胃及肝脏等。原发性肺淋巴上皮瘤样癌(pulmonary lymphoepithelioma-like carcinoma,PLELC)相对罕见,占全部肺癌患者的0.92%。自1987年Begin等[1]首次报道PLELC以来,文献报道了约200例[2,3]。本研究回顾性分析我院病理组织学证实的20例PLELC患者的临床资料和胸部多排计算机体层成像(multiple detector computed tomogrpahy,MDCT)影像学表现,提高对该病的临床认识和影像学诊断水平。
材料与方法
1.一般资料
本研究经我院伦理委员会批准。通过检索我院电子病历系统,回顾性收集2009年1月至2019年3月经病理组织学证实的PLELC患者,记录患者的临床资料,包括性别、年龄、临床表现、吸烟史和既往肿瘤病史等。纳入标准:①病理组织学和免疫组化诊断为PLELC;②病理组织检查前1个月接受胸部MDCT平扫和增强检查;③影像学资料显示鼻咽部未见明显异常。排除标准:①鼻咽部和其他部位LELC或其他恶性肿瘤病史;②MDCT检查前接受活检或者放化疗治疗史;③胸部CT图像质量不能满足影像学诊断要求。随访方法:以初次胸部CT检查作为起点,末次胸部CT检查作为终点,记录肿瘤有无进展、复发或转移。
2.胸部MDCT扫描
采用Siemens Emotion 16层 和Toshiba Aquilion 64层设备进行胸部CT平扫和增强检查。扫描参数:管电压120 kV,自动管电流技术50~150 mA,准直16×0.5或64×0.625 mm,视野320 mm,重建层厚3.0 mm,层间距3.0 mm。CT 扫描前进行呼吸训练。先行CT平扫,患者仰卧位,扫描范围为胸廓入口处至双侧肾上腺水平。CT增强扫描保持与平扫相同的体位、范围和方向。使用双筒高压注射器经肘前静脉团注非离子型碘对比剂,总量约60~80 mL,流率2.0~3.0 mL/s,注药后分别于30~35 s(动脉期),60~70 s(静脉期)扫描。将原始数据进行多平面重组(multi-planar reconstruction,MPR)图像后处理。
3.MDCT图像与分析
所有检查图像由2位高年资医师以上胸部放射学医师进行评价,意见不同经讨论达成一致。使用肺窗(窗宽1500 HU,窗位-600 HU)和纵隔窗(窗宽350 HU,窗位50 HU)进行图像观察。记录影像学征象包括:①病灶位置和分型:中央型(病灶累及段支气管及其以上),周围型(病灶累及段支气管以下);②病灶径线(肺窗横断位最大层面病灶的最长径和垂直短径的平均值);③边界(清晰,模糊);④形态(规则,不规则);⑤有无钙化、空洞;⑥强化方式(均匀,不均匀);⑦有无合并肺不张或阻塞性炎症;⑧有无纵隔和/或肺门淋巴结肿大,以淋巴结短径>10 mm为标准;⑨有无胸腔积液。
4.病理组织学诊断和免疫组化分析
组织标本均经过10%中性福尔马林溶液固定,常规脱水、石蜡包埋、切片,HE染色,光镜观察。采用Enli Vision二歩法进行免疫组织化学染色,选用抗体包括CK,CK5/6,P63、CK7、Vimentin、TTF-1、Napsin A、Syn、CgA等。EB病毒编码的核糖核酸(Epstein-Barr virus-encoded RNA)原位杂交染色采用过氧化酶系统,DAB显色,以阳性信号定位于肿瘤细胞核为结果阳性。根据2015年WHO胸部肿瘤病理学分类标准明确诊断为PLELC,并排除鼻咽癌肺转移及其他部位原发性恶性肿瘤转移[4]。肿瘤分期参考肺癌第八版TNM分期标准[5]。
5.统计学处理
采用SPSS 22.0 统计学软件分析,计量资料采用均数±标准差表示;符合正态分布的定量资料采用两组独立样本t检验,不符合者采用Mann-WhitneyU秩和检验;以P<0.05为差异有统计学意义。
结 果
1.临床表现
共纳入患者20例,其中男9例,女11例,年龄37~69岁,平均年龄(54.7±9.5)岁。8例临床表现为咳嗽、咳痰;5例表现为胸背部疼痛、不适;6例为体检发现肺内病变;1例因发现颈部肿物入院。全部患者均为广东省本地居民。6例患者有吸烟史。术前影像学诊断:2例患者建议随访复查;5例患者拟诊为肺部感染性病变,建议治疗后复查;13例患者诊断为肺部恶性肿瘤性病变,建议进一步检查。
2.MDCT影像学表现
病灶位置:左肺上叶(n=7),左肺下叶(n=3);右肺上叶(n=0),右肺中叶(n=5),右肺下叶(n=5)。中央型病灶(n=10),其中1例伴有阻塞性肺炎,3例伴有阻塞性肺不张;周围型病灶(n=10),表现为实性软组织结节或肿块。
病灶径线范围为(8.1~60.6)mm,平均径线(32.3±13.6)mm。结节型径线范围为(8.1~28.0)mm,平均径线(20.9±5.3)mm(图1a、b);肿块型径线范围(30.5~60.6)mm,平均径线(43.7±9.1)mm(图2a)。中央型病灶平均径线(39.0±13.7)mm>周围型(25.5±11.1)mm,差异具有统计学意义(t=2.422,P=0.026)。大多数病灶边界清晰(n=17),形态不规则(n=19);少见钙化(n=2)、空洞(n=1)。
MDCT平扫病灶密度均匀。增强扫描病灶呈轻到中度强化,且呈延迟强化的表现;均匀强化(n=10),不均匀强化(n=10)。合并纵隔和肺门淋巴结肿大(n=1),胸腔积液(n=1,图2b、c)。
病灶强化是否均匀、有无淋巴结转移、EBV是否阳性在病灶径线分布上的差异无明显统计学差异(t=-0.314,P=0.757;t=-0.645,P=0.527;Z=-0.476,P=0.700,表1)。
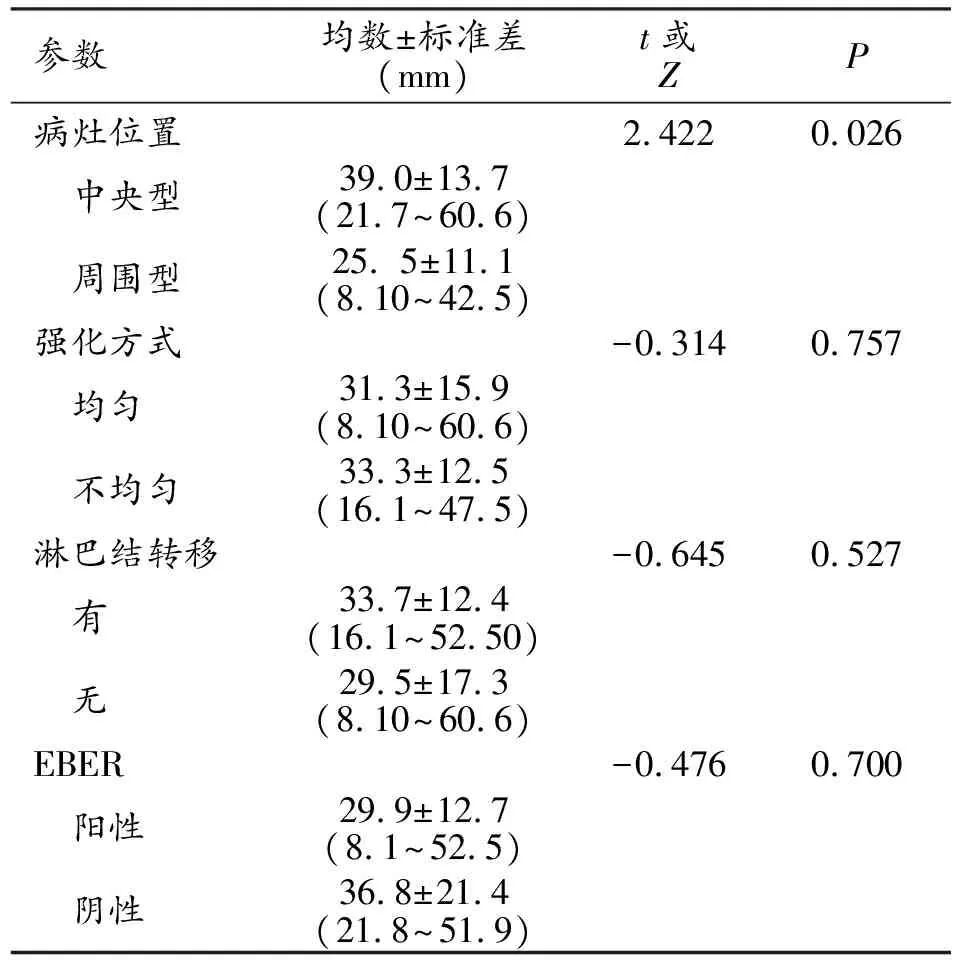
表1 PLELC与病灶径线的关系
3.PET/CT影像学表现
2例患者接受18F-FDG PET/CT检查,1例病灶径线为52.5 mm,SUVmax为13.1,合并多处淋巴结和远处转移(图3);1例病灶径线为8.1 mm,SUVmax为1.0,未见淋巴结和远处转移。
4.病理组织学结果和免疫组化分析
20例患者均经病理组织学和免疫组化分析确诊。手术切除15例,剖胸探查1例,支气管纤维镜活检1例,CT引导下穿刺切割活检3例。肿瘤分期:ⅠA1期 1例,ⅠA2期 2例,ⅠA3期 2例,ⅠB期 1例,ⅡA期 1例,ⅡB期 6例,ⅢA期 1例,ⅢB期 5例,ⅣB期 1例。
手术切除的肿瘤标本,直径约0.8~6.2 cm。肉眼观察:大部分切面灰白色或灰黄色,质硬或中等,与周围组织界限不清,10例出现非坏死性肉芽肿反应,8例出现出血、囊变或坏死。显微镜下表现:肿瘤细胞呈团片状、巢状分布,圆形或椭圆形,缺乏腺泡、腺管、乳头状结构,呈合体细胞状聚集,核大呈空泡状,明显的嗜酸性核仁和大量淋巴细胞浸润(图1c)。部分呈推挤性浸润性生长,淋巴细胞反应明显,包括成熟的淋巴细胞,经常混有浆细胞和组织细胞,偶尔有嗜中性粒细胞和嗜酸性粒细胞(图2d)。免疫表型:CK(+),CK5/6(+),P63(+);CK7(-)、Vimentin(-)、TTF-1(-)、Napsin A(-),Syn(-), CgA(-);ki-67阳性率30%~70%。16例行EBER检查,其中14例(87.5%)为阳性表现。16例行肺门和纵隔淋巴结清扫术,9例(56.2%)证实有淋巴结转移。
5.随访结果
17例患者有随访结果,随访时间3~96个月;3例患者失访。14例患者接受根治性手术切除并有完整随访记录,其中3例术后未行放化疗,无进展;10例予以术后化疗,2例进展;1例予以术后放化疗,无进展。2例患者直接接受放化疗,其中1例进展。1例患者确诊后未行治疗,随访病灶进展。
讨 论
PLELC是一种罕见的恶性肿瘤,占所有非小细胞肺癌的0.4%[5],2004年认为是未分化大细胞肺癌的一个亚型。由于PLELC在病理组织学上和流行病学上与大细胞肺癌不同,2015年WHO胸部肿瘤病理学将其归为未分类肿瘤[6]。
1.PLELC的临床表现
PLELC好发于年轻、无吸烟史的亚洲人群,无明显性别差异[7]。本组20例患者中男9例,女11例,平均年龄54.6岁。6/20的患者既往有吸烟史,提示吸烟与该病无明显相关性[5,9]。PLELC临床症状无特异性,以咳嗽、咳痰、胸痛较多见[10]。本组病例中8例患者因咳嗽、咳痰就诊,5例患者出现胸背部疼痛、不适,6例患者体检发现,与既往文献报道接近。PLELC病理特征与未分化鼻咽癌相似,癌细胞呈合胞体聚集,片状或巢状排列,核仁明显,核分裂象多见,间质内可见大量淋巴细胞浸润以及局部鳞状细胞分化。本组患者均进行完整的鼻咽部影像学检查,排除鼻咽部原发淋巴上皮瘤样癌肺转移。
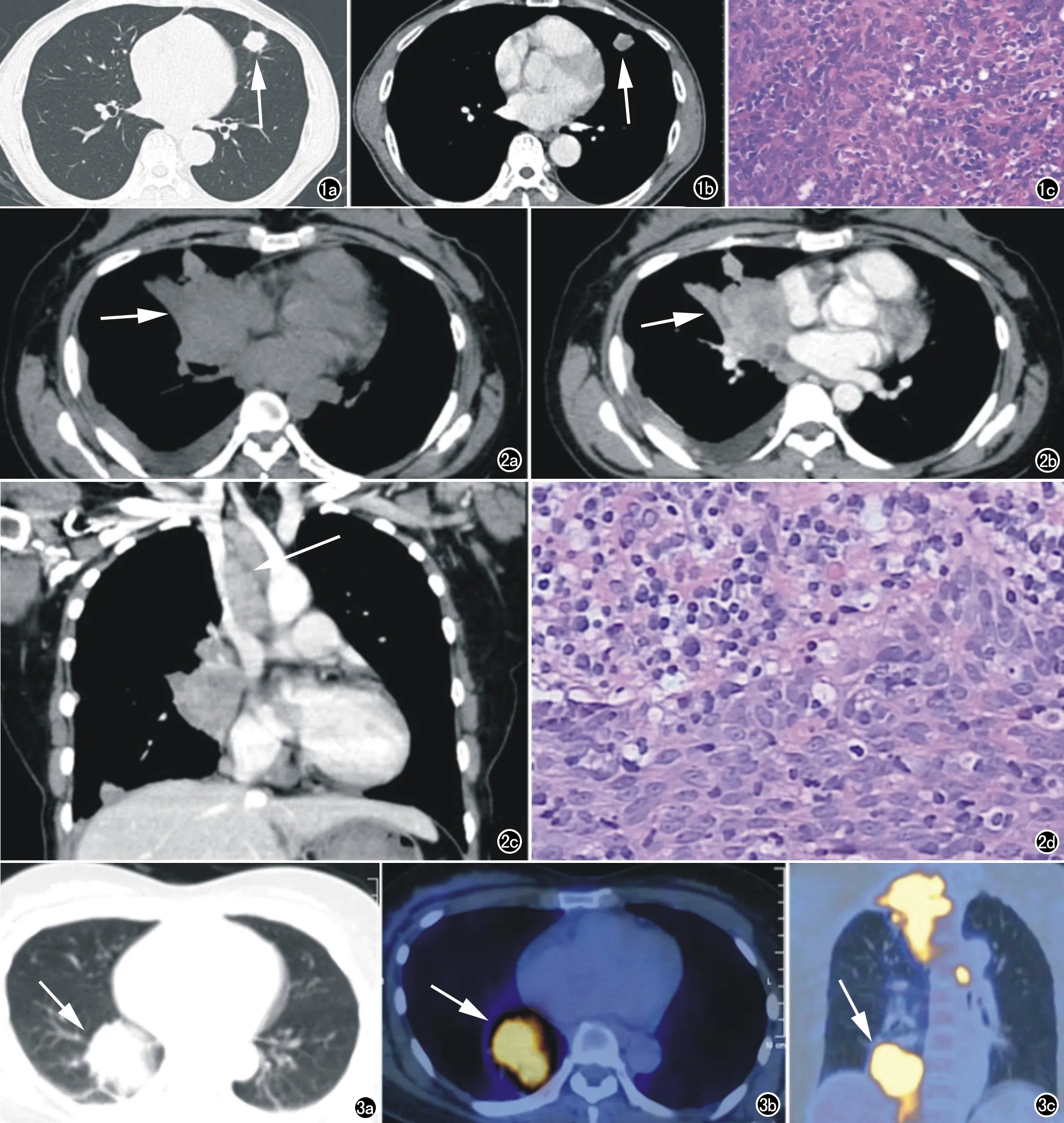
图1 男,37岁,咳嗽、咳痰1个月。a)CT平扫轴面肺窗示左肺上叶舌段实性结节,边界清晰,大小约2.2cm×2.2cm,呈浅分叶(箭);b)CT增强轴面纵隔窗示病灶不均匀强化(箭);c)病理图示肿瘤细胞与淋巴细胞混杂,肿瘤细胞核浆比例高,细胞核呈梭形或不规则形,染色质粗糙,核仁不明显(×200,HE)。 图2 女,41岁,反复右下胸背部疼痛,伴咳嗽气促2个月。a)CT平扫轴面纵隔窗示右肺中叶肺门区肿块,大小约4.5cm×5.0cm,中叶支气管截断并肺不张,右侧胸膜结节状增厚,右侧胸腔少量积液(箭);b)CT增强轴面纵隔窗示肿块不均匀明显强化(箭);c)CT增强冠状面纵隔窗示纵隔、右肺门多发肿大淋巴结,压迫上腔静脉(箭); d)病理图示肿瘤细胞和淋巴细胞呈合胞体样巢片状排列生长,细胞胞浆丰富,具有明显的嗜酸性核仁,细胞异型较大,较多核分裂象(×200,HE)。 图3 女,46岁,右肩背部疼痛1年。a)CT轴面肺窗示右肺下叶支气管近端软组织肿块,大小约5.8cm×4.7cm,形态不规则(箭);b)18F-FDG PET/CT轴面示肿块糖代谢明显增高,SUVmax 13.1(箭);c)18F-FDG PET/CT冠状面示右肺门和纵隔增大、融合淋巴结,糖代谢明显升高(箭)。
2.PLELC与EBV感染
既往文献[10,11]报道约67%中国南部、台湾、香港的PLELC患者EBV检查呈阳性。本组20例患者均为中国南部居民,其中16名患者接受EBER检测,14/16结果呈阳性,提示PLELC的发生与EBV感染的相关性有一定的地域性。EBV血清学效价越高,肿瘤径线越大、临床分期越晚。同时,治疗效果不佳的患者,EBV衣壳抗原显示为持续升高状态[11]。
3.PLELC的胸部MDCT影像学表现
胸部MDCT扫描是发现、诊断PLELC的主要影像学检查方法,能清晰显示病灶本身和周围的情况。早期PLELC通常表现为形态不规则、周围型实性结节,不伴有淋巴结转移[13]。PLELC多邻近纵隔,容易出现支气管周围淋巴结转移和血管包绕征,并造成阻塞性炎症和肺不张[8,14]。Ooi等[15]发现PLELC可表现为胸膜下孤立结节,病灶进展可侵犯纵隔、胸膜,并出现纵隔及肺门淋巴结转移。本组PLELC患者多表现为孤立性、中央型或周围型、实性结节或肿块,中央型病灶平均径线3.9 cm,高于周围型病灶平均直径2.6 cm(P=0.026), 与文献报道相符[8,15]。Ma等[7]报道4.9%的PLELC病灶内发现细小钙化,多在强化减低的坏死区域,被认为与营养不良钙化有关。本组仅有2例出现钙化,并且钙化体积小、形态不规则。
胸部MDCT增强图像上,PLELC病灶强化方式与病灶径线有关[8]。病灶径线大,恶性程度高,肿瘤生长速度快,血供相对不足,肿瘤中央出现凝固性坏死,是较大病灶强化不均匀的原因。同时,肿瘤血管具有形态不规则、结构幼稚、血流紊乱、高通透性等特点,也会导致肿瘤强化不均匀。PLELC强化方式除了与血供相关以外,与病理组织学细胞构成亦有关联,镜下PLELC肿瘤上皮细胞周围间质内有大量淋巴细胞浸润,两种细胞构成比例与病灶强化模式有一定的相关性。本组病例中,不均匀强化组与均匀强化组的病灶径线未见明显统计学差异(P=0.757),可能与样本量较小有关。
4.PLELC的PET/CT表现
PET/CT是评估肺内病变恶性程度的无创性检查方法之一,对于发现淋巴结及远处转移具有明显的优势,并且可以排除鼻咽部有无原发病灶。Dong等[16]报道了1例晚期PLELC合并淋巴结转移的患者,肿瘤SUVmax达到34.5。FDG高摄取被认为与肿瘤上皮细胞Ki-67的高表达有关。Shen等[17]报道了1例PLELC伴有EBV阳性的患者,随访两年内病灶FDG出现由不摄取到高摄取的转变,提示肿瘤进展。本组2例患者进行了PET/CT检查,肺部病灶SUVmax分别为13.1和1.0;高摄取患者同时发现淋巴结和远处多发转移,低摄取患者未出现淋巴结和远处转移,说明原发灶的摄取程度与是否发生肿瘤扩散和转移密切相关。Gul等[18]发现PLELC病理组织学表现上皮类细胞肿瘤所占比例较少,肿瘤基质中富含大量增殖指数高、Ki-67呈高表达的淋巴细胞,可能是PLELC病灶FDG高摄取的原因。
5.PLELC的鉴别诊断
PLELC需要与以下疾病鉴别:①原发性肺淋巴瘤:多为均匀等密度软组织肿块,包绕血管和支气管,肿瘤内部支气管可无明显狭窄出现“空气支气管征”;肿瘤坏死少见,增强后呈均匀中度强化;合并纵隔、肺门淋巴结肿大,淋巴结融合常见亦呈均匀强化[19]。②肺韦格纳氏肉芽肿:常表现为双肺多发的肿块和/或结节,大部分伴有空洞形成,部分空洞周围有“晕征”提示肺泡出血;实验室检查抗中性粒细胞抗体(ANGA)阳性[20]。本组PLELC以孤立性病变为主,仅有1例患者表现为空洞性病变。③其他病理类型肺癌:原发性肺腺癌常表现为周围型、孤立性的结节或肿块,由于瘤内纤维化出现分叶征、毛刺征、胸膜凹陷征等征象。肺癌筛查发现的早期肺腺癌更多地表现为孤立性的非实性结节或部分实性结节,而PLELC均表现为孤立性实性结节或肿块。肺鳞癌常表现为中央型肺门区软组织肿块并阻塞性肺炎或肺不张,多数伴有坏死。Ooi等[15]在PLELC患者和其他类型肺癌的对比中发现,前者发生淋巴结转移的概率较高,但发生率与肺癌差异无统计学意义。
6.PLELC的的治疗和预后
手术切除是早期PLELC的首选治疗策略。晚期PLELC患者可以采用联合放化疗方案。He等[21]报道PLELC患者1、3、5年生存率分别为85.6%、68.9%、59.5%,高于其他非小细胞病理类型肺癌患者的1、3、5年生存率分别为39.1%、18%、12.9%。本组10例患者接受术后化疗,其中2例患者在术后27、30个月复查胸部CT出现进展,其余8例患者随访过程中无进展。
综上所述,PLELC好发于相对年轻的非吸烟人群,合并EBV感染。PLELC的胸部MDCT检查具有一定的特征性改变,多表现为孤立性、实性肿块或结节,少见钙化和空洞,平扫密度均匀,增强轻中度强化,且呈延迟强化。手术切除辅助放化疗是治疗早期PLELC的首选方案,预后较好。
