双能量CT及DWI食管癌病理分级对照
2020-06-23周胜利陈伟柏根基王亚婷
周胜利, 陈伟, 柏根基, 王亚婷
食管癌是消化道常见恶性肿瘤,死亡率高[1],食管癌的病理特点对于肿瘤生物学行为及预后具有重要意义[2]。双源CT(dual source computed tomography,DSCT)碘图可间接反应肿瘤新生血管生成[3],进而反映肿瘤组织病理分化特点[4]。磁共振扩散加权成像(diffusion weighted imaging,DWI)可从细胞及分子水平诊断疾病[5],其表观扩散系数(apparent diffusion coefficient,ADC)值可在一定程度上预测食管癌恶性程度[6-7]。本文通过对2016年12月-2019年12月60例食管癌患者行影像与病理对照分析研究,目的在于探讨双能量CT及磁共振扩散加权成像在食管癌病理分级中的应用比较,为食管癌患者术前病情评估、临床治疗方案制定及预后评价提供有益信息。
材料与方法
1.临床资料
2016年12月-2019年12月经内镜活检或术后病理证实食管鳞状细胞癌患者60例。男43例,女17例,年龄48~84岁,平均65.8岁,其中食管上段癌8例,食管中段癌33例,食管下段癌19例。
病例入选标准:经内镜活检或病理证实肿块型食管癌患者;既往无食管肿瘤手术病史且未行放疗或化疗;所有病例均行双源CT双能量平扫加双期增强扫描及磁共振扫描;无碘剂过敏史。排除标准:碘剂过敏、严重心脑肾功能不全以及甲状腺毒症者、体重质量指数(BMI)>30 kg/m2及磁共振检查禁忌症者。
2.检查方法
双源CT扫描:采用西门子Definition Flash双源CT机对60例食管癌患者以双能量模式进行检查,所有患者均行平扫和增强扫描。常规平扫扫描参数:管电压120 kV,有效电流250 mAs,层厚5 mm、层间距5 mm,螺距0.7,转速0.28 s/圈,FOV 300 mm。双能量增强扫描:采用双筒高压注射器自肘前静脉注射碘海醇,注射流率3.5 mL/s,剂量1.5 mL/kg,总量约60~80 mL,然后以相同流率注射生理盐水20 mL,应用对比剂团注跟踪软件(Bolus Tracking)监测平面选择同层主动脉,达到阈值(100 HU)后延迟10 s进行动脉期扫描,延迟35 s扫描静脉期。扫描后自动重建层间距、层厚为1 mm。
MRI扫描:采用德国西门子AVANTO 1.5T磁共振成像仪常规扫描。成像参数:T1WI轴面、T2WI轴面及T2WI冠状面,扫描时间17~40,层厚5 mm,视野350 mm×350 mm~400 mm×400 mm;DWI检查时层面、层厚、FOV及层间距均保持一致,TR 5700 ms,TE 70 ms,矩阵128×128,层厚5 mm,选用b值为0和600 s/mm2同时生成ADC图。
3.图像处理及数据分析
CT后处理方法及观察指标:将所有图像传至双源CT Syngo.VIA工作站,并利用其Liver VNC软件进行后处理,测量工作由两名副高以上高年资医生共同完成。分别测量病灶所有层面平扫、动脉期和静脉期食管癌病灶CT值、标准化碘浓度,标准化碘浓度(normalization iodine concentration,NIC)=病灶内测得的碘浓度/同层面主动脉测得的碘浓度。本研究测量感兴趣区碘浓度时在测量软件中将Normalized ROI放置于同层主动脉进行标准化,然后选用Dual energy ROI于病灶处绘制感兴趣区,所得碘浓度即为标准化碘浓度。CTA=CT动脉期-CT平扫,为动脉期病灶强化程度,CTP=CT静脉期-CT平扫,为静脉期强化程度。
ADC值测量:由2位副高以上高年资MRI诊断医师对病灶行诊断及定位。感兴趣区(region of interest,ROI)选取:结合T1WI、T2WI图像上肿瘤的范围和形态,在ADC图不规则边缘划线,圈入全部病变区,记录病灶所在每一层面ADC值后取其平均值,若病灶大小不足3个层面,取3个不同部位分别测量并取其平均值。
4.统计学分析
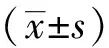
结 果
1.食管癌双能量CT碘图及MRI表现
CT表现:食管壁不规则增厚,可形成以管壁为轴心的软组织密度肿块,管腔不同程度狭窄,增强扫描可见呈中度至明显强化,碘图上显示食管癌病灶碘剂聚集,病灶较大伴有坏死者,碘剂分布可不均匀(图1)。
MRI表现:轴面T1WI见以管壁为中心非对称性增厚,管腔不规则狭窄,T2WI环形高信号的黏膜线破坏中断;病变于DWI图像上呈明显不均质高信号,ADC图呈低信号(图2)。
2.不同病理分级食管癌NIC值、CT强化程度比较(表1)
不同病理分级食管癌NIC值不同,随着病理分级逐渐升高,病灶NIC值逐渐增加,对3组NIC值行单因素方差分析后得出动脉期、静脉期高分化与低分化、中分化与低分化食管癌NIC值比较差异均有统计学意义(P<0.05),而高分化与中分化食管癌NIC值比较差异无统计学意义(P>0.05);不同病理分级食管癌CT强化程度比较得出静脉期高分化与低分化食管癌强化程度差异有统计学意义(P<0.05),其余两组比较差异均无统计学意义(P>0.05)。
两比较结果:动脉期和静脉期NIC值高分化与低分化、中分化与低分化食管癌NIC值差异均有统计学意义(P<0.05);高分化与中分化NIC值差异均无统计学意义(P>0.05)。静脉期CT强化程度高分化与低分化组间差异有统计学意义(P<0.05),其余两组间差异均无统计学意义(P>0.05)。
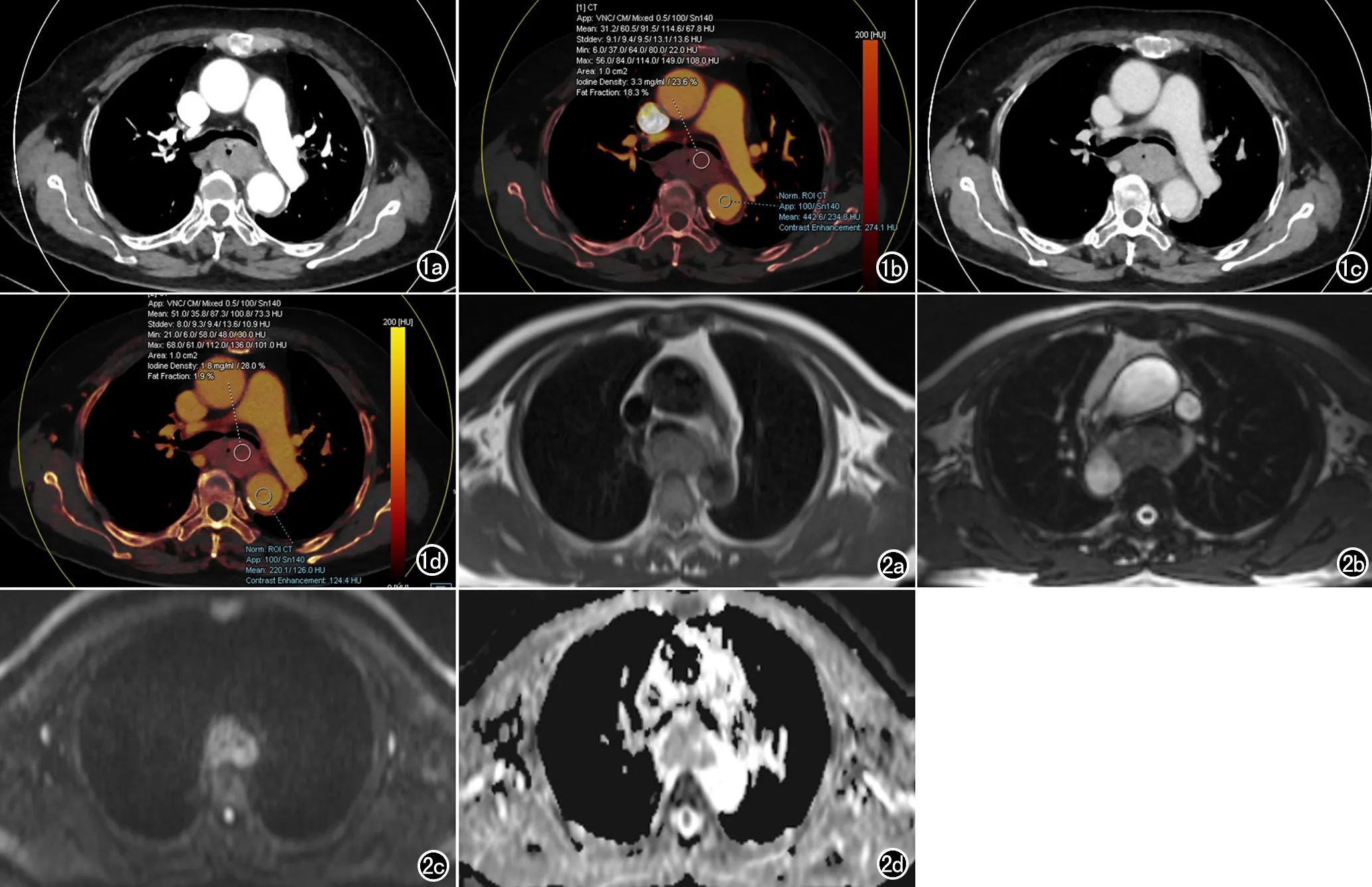
图1 a)动脉期混合能量(120kV)图像示食管壁明显增厚,见软组织肿块形成,管腔狭窄、闭塞,增强扫描见病灶明显强化;b)动脉期碘图示食管癌病灶内有明显碘剂沉积;c)静脉期混合能量图像(120kV);d)静脉期碘图。 图2 男,60岁,食管上段中分化鳞状细胞癌。a)T1WI食管上段管壁明显不规则增厚,呈等信号,管腔狭窄;b)T2WI病灶呈稍高信号,正常高信号食管粘膜线中断;c)DWI食管管壁增厚,肿块呈明显不均质高信号;d)ADC图病变呈低信号。
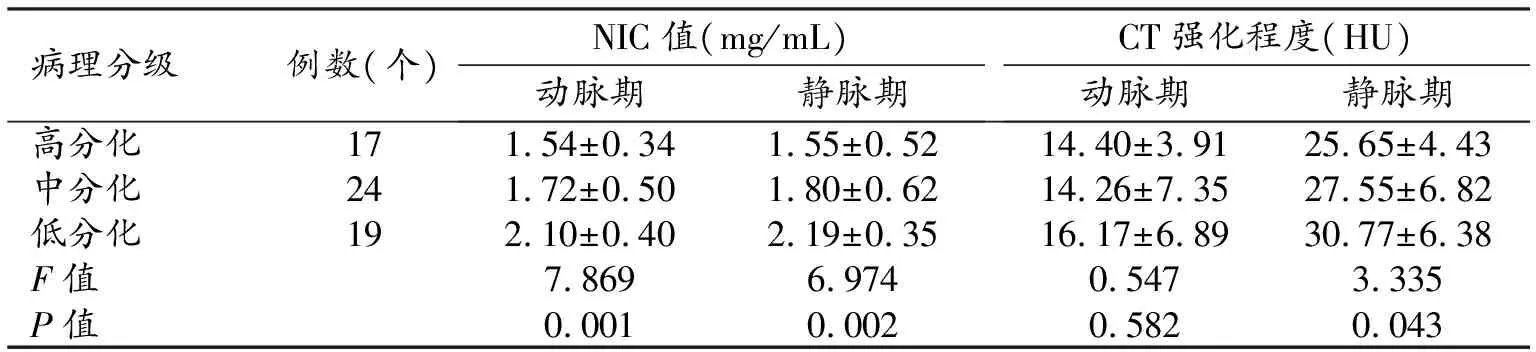
表1 不同病理分级食管癌NIC值及CT强化程度比较结果
注:NIC标准化碘浓度
3.不同病理分级食管癌的ADC值比较(表2)
病灶的 ADC值均随着肿瘤分化程度增高而升高,并对高分化组、中分化组、低分化组3组间行两两比较后得出各分化组间差异均有统计学意义(P<0.05)。

表2 不同分化程度食管癌ADC值(×10-3mm2/s)比较
注:F=21.594,P=0.000
4.ROC曲线分析NIC值及ADC值对中高分化食管癌与低分化食管癌鉴别诊断效能
把不同分化程度食管癌分为2组即低分化组和中高分化组。以食管癌病灶为观察目标,应用ROC曲线分析NIC值及ADC值对中高分化食管癌与低分化食管癌鉴别诊断效能。依ROC曲线分析结果得知NICp曲线下面积最大,其诊断效能最大,选取1.92mg/mL作为诊断阈值,其敏感度和特异度均较高,分别为80.5%和89.5%(表3)。
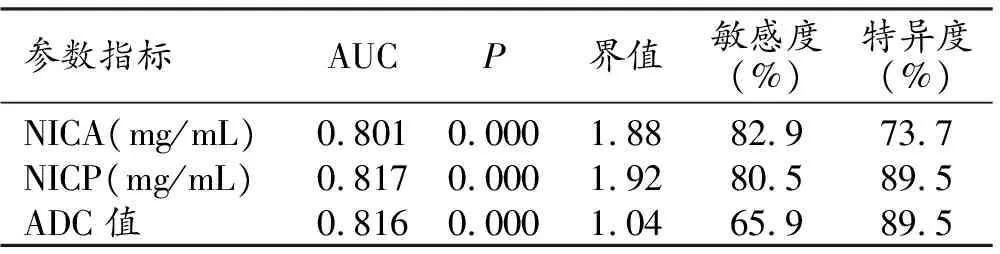
表3 中高分化与低分化食管癌NIC值及ADC值ROC曲线分析结果
注:NIC 标准化碘浓度;NICA 动脉期期NIC值;NICP 静脉期NIC值;ADC 表观扩散系数值
讨 论
食管癌是恶性程度较高消化道肿瘤,近年来其发病率逐年增加[8],食管癌病理分型以鳞癌多见,占90%以上,而腺癌少见,病理学上按照分化程度不同将其分为高分化、中分化、低分化癌。
研究[9]发现肿瘤供血早期主要来源于宿主血管,肿瘤进一步发展会促进肿瘤自身新生血管的大量生成,肿瘤分化程度越差,其肿瘤新生血管越丰富,但是新生肿瘤血管存在发育不成熟、血管纡曲、紊乱并且血管通透性较高特点。CT增强扫描病理基础是碘对比剂在组织微血管充盈,因此可知肿瘤强化程度与瘤内微血管密度及结构呈正相关,进而可反映肿瘤血管生成情况[10]。双源CT标准化碘浓度能够反映肿瘤分化程度,主要原因可能是不同分化程度肿瘤其血管形成强度不同,分化程度差的肿瘤其血供相对越丰富,增强扫描时病灶内沉积碘剂越多,进而可以通过病灶内碘浓度测量来反映肿瘤分化程度。因此,分化程度越低的食管癌其肿瘤微血管密度越高,测量标准化碘浓度越高[11-12]。
DWI能够从分子水平上早期检测组织与器官病理生理学改变。ADC值可以定量评估肿瘤组织微结构变化[13-15]。研究表明肿瘤组织中水分子自由扩散能力是影响ADC值大小主要因素[16]。病理学上食管癌分化程度越低,肿瘤细胞越大,肿瘤细胞增多且排列紧密,肿瘤组织细胞外间隙减小,水分子自由扩散受限,因而ADC值减低,即理论上分化程度不同食管癌之间ADC值不同。
本组研究结果显示不同分化程度食管癌NIC值不同,分化程度越低,其NIC值越高,其原因可能是由于不同病理分级食管癌其血供及微血管密度不同。各组间两两比较得出高分化与低分化食管癌、中分化与低分化食管癌标准化碘浓度间差异有统计学意义(P<0.05),而高分化与中分化食管癌间标准化碘浓度差异无统计学意义(P>0.05),可能是由于高分化与中分化食管癌分化程度均较高,肿瘤血管生成情况相差不大所致病灶内碘剂沉积无明显差异所致。本研究测量了不同病理分级食管癌的ADC值,结果显示不同病理分级食管癌ADC值亦不同,各组间两两比较得出高分化与低分化食管癌、高分化与中分化及中分化与低分化食管癌ADC值间差异均有统计学意义(P<0.05)。因此认为ADC值可以作为鉴别食管癌恶性程度定量指标。
本研究通过ROC曲线分析病灶NIC值及ADC值对于中高分化食管癌与低分化食管癌的鉴别诊断价值,结果表明二者均有鉴别诊断价值,其中NIC值对于中高分化与低分化食管癌的鉴别以静脉期曲线下面积最大,诊断效能最高,相应诊断阈值为1.92mg/mL,敏感度和特异度均较高,分别为80.5%和89.5%;ADC值对于中高分化食管癌与低分化食管癌鉴别诊断阈值为1.04×10-3mm2/s,其敏感度和特异度分别为65.9%和85.9%,通过对比显示出二者均有助于鉴别肿瘤血管生成情况,但以碘定量分析价值更高。
