刺松藻中甾醇的提取、结构分析及调节血脂活性研究
2020-06-21李小翠王丹丽赵玉勤
王 燕,李小翠,王丹丽,徐 萍,赵玉勤,陈 荫
(浙江海洋大学食品与药学学院,浙江舟山 316022)
植物甾醇(phytosterols,plant sterol)是一类广泛存在于植物体的天然生理活性物质,其结构与胆固醇相似,是含3 位羟基的甾体化合物,具有免疫调节、消炎退热、抗肿瘤、降低血脂和胆固醇及护养皮肤等多种生理功效[1-5],和动物中胆固醇起相同的作用[6]。POLLAK O J,et al[7]以谷甾醇为药物,证实了植物甾醇对高胆固醇患者存在一定功效。近年来,植物甾醇以明确的降血脂作用和安全性,引起了人们极大的关注[8-9]。但以上研究应用的植物甾醇以陆源植物甾醇居多,CHEN Zhen,et al[10]对源于海洋的植物甾醇研究中,发现中药海藻的总甾醇具有很好的降血脂作用。随着植物甾醇应用范围的不断扩大,其制备技术也在不断提高,选择和开发简单有效的生产工艺,是取得较好效益的关键[11]。
刺松藻Codium fragile 是一种广泛分布于温带海域的大型海藻,常见于我国黄海和渤海,属于绿藻门、绿藻纲、管藻目、松藻科、松藻属。生长于低中潮带的岩石上[12]。作为一种高膳食纤维、高蛋白、低脂肪、低热量,且富含铁、锌等微量矿物质元素的天然理想保健食品原料[13],其脂溶性成分主要为烷烃、不饱和脂肪酸、甾醇类成分,具有很好的药用前景[14],可用于海洋功能性食品、药品等的开发,以增加其附加值,但目前国内外对该藻的研究大多集中在其多糖等大分子活性物质,而对于低极性的植物甾醇等小分子化合物则相对较少,对于其提取分离更未进行深入研究[15-17]。本文通过对刺松藻内甾醇的提取及分析,探究甾醇对血脂的作用和影响,以期为深入开发海洋生物资源,为植物甾醇提取提供新的途径与理论依据。
1 材料与方法
1.1 实验材料与仪器
刺松藻(采自南麂岛);健康SPF 小鼠25 只(雌雄各半,28 g 左右);高脂高糖饲料(配方为基础饲料55.8%、猪油18%、蛋白质25%、胆固醇1%、牛胆盐0.2%)。
总胆固醇(total cholesterol,TC,南京建成生物工程研究所);甘油三酯(Triglyceride,TG,南京建成生物工程研究所);低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C,上海酶联生物科技有限公司);高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C,上海酶联生物科技有限公司);磷硫铁显色剂(实验室自配)[12];乙醇(分析纯);氢氧化钾(分析纯);正己烷(分析纯);石油醚(分析纯);85%浓磷酸;无水硫酸钠;三氯化铁(FeCl3·6H2O)。
BT125D 电子天平(赛多利斯科学仪器(北京)有限公司);数显恒温水浴锅(金坛市亿能实验仪器厂);A-1000S 水流抽气泵(上海爱朗仪器有限公司);N-1100 旋转蒸发仪(海爱朗仪器有限公司)上;TGL-16G高速离心机(上海安亭科学仪器厂);UV-1800PC 型紫外可见分光光度计(上海美普达仪器有限公司);Thermo Fisher 酶标仪(赛默飞世尔科技(中国)有限公司)。
1.2 试验方法
1.2.1 刺松藻甾醇的提取
将刺松藻用90%乙醇按料液比1:20 在80 ℃下回流提取4 h[18-19],真空抽滤后滤液在35 ℃下减压蒸干,用10 mL10% KOH-乙醇溶液将其提取物溶出,加入到具塞试管中,65 ℃下皂化3 h,皂化物离心取上清液,然后加入10 mL 正己烷和15 mL 水进行萃取[15],分层后取上层有机相,水相用正己烷反复萃取至有机相无色,合并正己烷相,用30%乙醇溶液洗涤至乙醇相无色且呈中性,取出正己烷相经无水Na2SO4脱水10 min,再加入少量活性炭粉末,于60 ℃下水浴搅拌脱色20 min[20],抽滤得滤液在35 ℃下减压蒸干得刺松藻甾醇提取物,用高浓度乙醇将其溶出得刺松藻甾醇样品溶液。
1.2.2 刺松藻甾醇的含量测定
精密称取谷甾醇标准品,用甲醇溶解并定容配制成1.013 g·L-1的谷甾醇贮备液,再从中精密量取5 mL至25 mL 容量瓶中,加入甲醇定容至刻度线,摇匀即得0.202 6 g·L-1谷甾醇对照品溶液[19]。
精密量取谷甾醇对照品溶液0.2 mL,置于干燥具塞试管中,水浴蒸干后,精密加入2 mL 无水乙醇,涡旋混匀,再沿管壁精密加入磷硫铁显色剂2 mL,在室温下立即摇匀稳定10 min,以无水乙醇作为空白参比,使用紫外分光光度计在400~800 nm 范围内进行扫描,选取最大吸收波长作为检测波长。
依次精密量取谷甾醇对照品溶液0.20、0.40、0.60、0.80、1.00、1.20、1.40 mL,按照上述的操作,在530 nm处测定溶液的吸光度。每个点重复3 次,以谷甾醇浓度(X)为横坐标,吸光度(Y)为纵坐标,绘制标准曲线。
将刺松藻甾醇样品溶液水浴蒸干后,精密加入2 mL 无水乙醇,涡旋混匀,再沿管壁精密加入磷硫铁显色剂2 mL,在室温下立即摇匀稳定10 min,以无水乙醇作为空白参比,在530 nm 处测定溶液的吸光度。样品总甾醇含量按下式计算:

其中:W 为吸光度对应的样品中甾醇的浓度(mg·mL-1);V 为定容体积(mL);t 为稀释的倍数;m 为样品总重量(g)。
1.2.3 刺松藻甾醇回流提取工艺的正交试验
在单因素试验的基础上,对乙醇浓度、料液比、提取时间和提取温度进行4 因素3 水平正交试验设计,以得到甾醇的最佳提取工艺,试验方案见表1。

表1 正交试验设计因素水平表Tab.1 Factors and levels of orthogonal test on extraction condition of sterol from apple seed oil
1.2.4 刺松藻甾醇的红外光谱分析
采用KBr 压片法,首先将KBr 粉末在真空中干燥至恒重后,在研钵中研磨至粉末,再用压片机压制成透明薄片。样品溶在正己烷中,配制成5 mg·mL-1的溶液,均匀的涂在KBr 薄片上,待溶剂挥发干后进行红外扫描,其扫描范围为4 000~400 cm-1,背景扫描次数32 次,分辨率为4.0 cm-1。
1.2.5 刺松藻甾醇的GC-MS 分析
为确定刺松藻甾醇的主要成分,对混合物进行GC-MS 分析。其中GC 条件:采用DB-5ms 气相色谱柱(0.25 mm×30 m),进样口温度250 ℃,载气为氦气,柱流速0.8 mL·min-1,起始温度150 ℃,保持3.5 min,以20 ℃·min-1升至200 ℃,保持5 min,再以5 ℃·min-1升至280 ℃,保持30 min。MS 条件:EI 源,电子能量70 eV,离子源温度200 ℃,接口温度250 ℃,SCAN 模式,质量扫描范围为50~500.根据GC-MS 总离子流色谱图中各组分的质谱,确定分子量,再通过NIST 标准谱库并参考甾醇标准和参考文献进行鉴定后,采用面积归一发计算各甾醇的百分组成[21]。
1.2.6 动物水平调节血脂作用研究
模型建立:30 只受试小鼠适应性喂养基础饲料7 d,1 周以后尾部采血,测定空腹血清总胆固醇(TC),按TC 水平和体重分为空白对照组、模型组、3 个剂量组[22],共5 组。对照组给予基础饲料,其他组给予高脂高糖饲料。对照组和模型组小鼠灌胃0.5 mL 的色拉油,各剂量组给予分别灌胃含有低、中、高剂量的刺松藻甾醇提取物,每天灌胃0.5 mL,植物甾醇3 种剂量以色拉油作溶剂配制,连续45 d,造模期间,自由饮水、摄食[23]。每周称体重1 次,隔日准确记录进食量。
血清的制备:最后一次给药后禁食不禁水5 h,各组小鼠眼眶取血,放入1.5 mL 离心管中,4 ℃下保存,并及时以2 500 r·min-1离心10 min,离心后取血清以备测定用。
指标测定:(1)血清脂质的测定 血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDLC)、低密度脂蛋白(LDL-C)均根据试剂盒要求采用酶法进行检测。
(2)肝脏系数的测定 将处死的小鼠分离肝脏,滤纸吸干后称其重量(g),按下式计算肝脏系数;肝脏系数(%)=肝脏重量(g)/体重(g)×100
(3)动脉硬化指数的测定 动脉硬化指数(AI)=(TC-HDL-C)/HDL-C
数据处理:实验数据采用SPSS 软件,经统计分析后以平均值±标准差(x±s)表示,组间差经t 检验。
2 结果与分析
2.1 刺松藻甾醇含量测定
最终谷甾醇标准品溶液的最大吸收波长在530 nm,吸收峰较为平缓,故选择530 nm 作为检测波长(图1)。制作谷甾醇标准曲线,结果见图2,标准曲线的回归方程为y=8.393 5x-0.033 9,R2=0.999 4。

图1 谷甾醇标准品紫外全波长扫描图Fig.1 Sitosterol standard UV wavelength scanning chart

图2 谷甾醇标准曲线Fig.2 Standard curve of sitosterol
对刺松藻甾醇样品溶液进行测定,采用2.1 的标准曲线计算甾醇含量,根据公式得到样品中甾醇含量为2.06 mg·g-1。
2.2 刺松藻中甾醇回流提取的最佳条件确定
由表2 可知,根据极差R 值大小可以看出影响刺松藻甾醇回流提取的因素顺序为乙醇浓度>提取时间>提取温度>料液比,其中乙醇浓度对甾醇的提取率影响最大。比较各因素的K 值可以得出最佳因素组合为A2B2C3D3,即回流提取刺松藻中甾醇的最佳条件为料液比1:20,提取时间4 h,提取温度90 ℃,乙醇浓度95%。

表2 正交实验结果分析表Tab.2 Results and range analysis of orthogonal test
2.3 刺松藻甾醇的红外光谱分析
通过红外光谱对混合物的结构特征进行分析(图3 所示),3 350 cm-1是羟基的伸缩振动,2 950,2 933和2 892 cm-1处强的吸收峰是饱和CH 的伸缩振动,1 700 cm-1左右是C=C 双键的伸缩振动,1 460 和1 382cm-1是饱和CH 的变角振动,1 040 cm-1左右是C-O 的伸缩振动。综合分析并参照参考文献表明,该混合物符合甾醇的基本光谱特征[24]。

图3 刺松藻甾醇的红外光谱图Fig.3 IR spectrum of sterols from C.fragile
2.4 刺松藻甾醇的GC-MS 分析
对刺松藻中甾醇进行GC-MS 进行分离和鉴定,所得各峰的质谱经计算机检索和数据库比对鉴定出各个甾醇的结构(表3 和图4)。结果表明刺松藻中甾醇的种类较少,主要含有胆甾醇,24-乙基-胆甾-5,23-二烯-3β-醇和24-甲基-胆甾-5-烯-3β-醇乙酸酯[25],比例约为1:3:8。

图4 刺松藻中所含甾醇Fig.4 Sterols in the alga C.fragile

表3 各甾醇的m/z 及百分含量Tab.3 m/z and percents of all kinds of sterols
2.5 刺松藻甾醇对小鼠血脂水平的影响
由表4 可见,实验45 d 后,对照组和高脂模型组的血清TC 之间存在显著性差异(P<0.05),对照组的血清TC 明显低于高脂模型组。实验组较高脂模型组的血清TC 低,但实验组之间无显著性差异。说明刺松藻植物甾醇对小鼠血清TC 有降低作用,但无明显效果。

表4 刺松藻植物甾醇对小鼠血脂水平的影响(x±s,n=5)Tab.4 Effects of phytosterol on the serum lipid levels in mice
对照组和高脂模型组的血清TG 之间存在显著性差异(P<0.05),对照组的血清TC 明显低于高脂模型组。实验组均与高脂模型组的血清TG 之间存在显著性差异(P<0.05),且低于对照组血清TG,说明刺松藻植物甾醇能显著降低小鼠血清TG。实验组中低剂量组和中剂量组降低血清TG 效果差异不明显,但高剂量组与其他两组实验组降低血清TG 效果差异显著(P<0.05)。
对照组、高脂模型组、低剂量组和中剂量组之间血清LDL-C 无显著差异。但中剂量组较对照组和高脂模型组血清LDL-C 低。高剂量组与高脂模型组存在显著差异(P<0.05),说明高剂量刺松藻甾醇能显著降低小鼠血清LDL-C。
高脂模型组较对照组血清HDL-C 显著降低。与对照组比较,实验组的血清HDL-C 较对照组均略有下降,但各组间差异不显著。说明刺松藻植物甾醇对血清HDL-C 水平无明显影响。
2.6 刺松藻植物甾醇对小鼠体重、肝重及肝系数的影响
结果如表5 所示,高脂模型组和实验组的终体重均较对照组显著增高(P<0.05),但实验组的终体重均较高脂模型组显著降低(P<0.05),且高剂量组终体重显著低于低剂量组和中剂量组。实验组终体重与剂量呈依赖关系,说明刺松藻甾醇能显著降低小鼠体重。
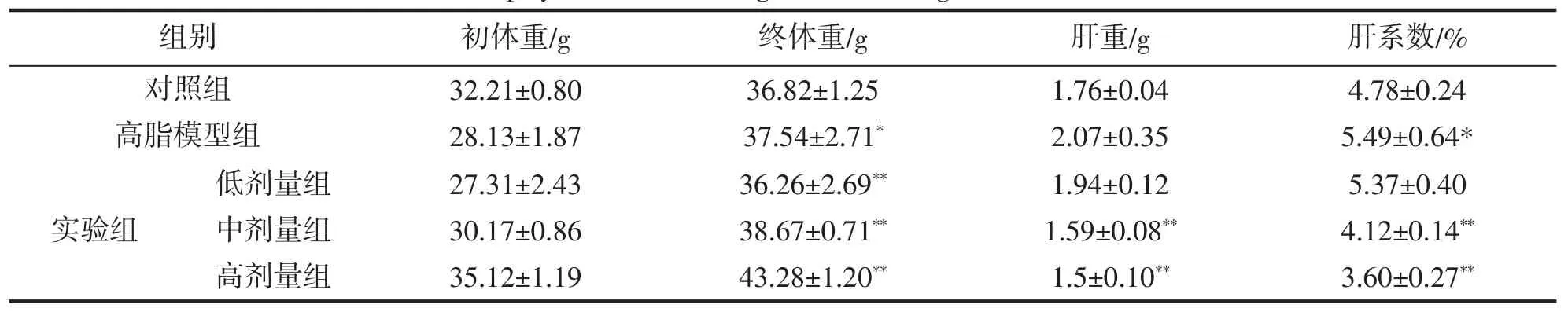
表5 刺松藻植物甾醇对小鼠体重、肝重及肝指数的影响(x±s,n=5)Tab.5 Effects of phytosterol on weight,liver weight and liver index of mice
高脂模型组较对照组肝重质量增大,低剂量组较高脂模型组肝重质量降低。中剂量组和高剂量组较高脂模型组肝重质量显著降低(P<0.05),说明刺松藻甾醇能降低肝重质量。
高脂模型组较对照组肝系数显著增大(P<0.05),低剂量组较高脂模型组肝重质量降低。中剂量组和高剂量组较高脂模型组肝重质量显著降低(P<0.05),说明刺松藻甾醇能降低肝系数。
2.7 刺松藻甾醇对小鼠动脉硬化指标的影响
LDL-C 与心血管病发作直接相关,而HDL-C 则与心血管病的发作具有相反的关系[26]。结果如表6 所示,高脂模型组较对照组高密度脂蛋白胆固醇与低密度脂蛋白胆固醇的比值(HDL-C/LDL-C)略有降低。实验组HDL-C/LDL-C 与剂量呈正相关,说明刺松藻甾醇略有降低HDL-C/LDL-C 水平的作用。高脂模型组和实验组的高密度脂蛋白胆固醇与总胆固醇的比值(HDL-C/TC)均低于对照组,且高脂模型组和实验组差别不大,说明刺松藻甾醇对HDL-C/TC 基本无影响。高脂模型组动脉硬化指数(AI)较对照组明显升高,实验组较高脂模型组逐渐降低,说明刺松藻甾醇对AI 水平有降低作用。

表6 刺松藻甾醇对小鼠动脉硬化指标的影响(x±s,n=5)Tab.6 Effect of phytosterol on arteriosclerosis indicators in mice
3 结论
刺松藻作为大型野生绿藻中,是东海海域的优势藻类,对刺松藻活性成分的研究有助于其开发利用。本文对刺松藻中甾醇成分进行细致研究。本文采取了乙醇回流和皂化来提取甾醇,以磷硫铁试剂作为显色剂,利用分光光度法进行含量测定。在乙醇回流提取过程中各因素对甾醇含量的影响顺序为乙醇浓度>提取时间>提取温度>料液比,得到最佳的提取条件为乙醇浓度95%,料液比1:20,温度95 ℃,提取时间4 h,该工艺条件下提取的甾醇含量为2.14 mg·g-1。通过光谱学和GC-MS 对甾醇进行鉴定,主要含有胆甾醇,24-乙基-胆甾-5,23-二烯-3β-醇和24-甲基-胆甾-5-烯-3β-醇乙酸酯。
血脂异常是动脉粥样硬化性心脑血管疾病的危险因素,特别是升高的LDL-C 是动脉粥样硬化的发生、发展的主要危险因素[27]。本实验结果显示,刺松藻甾醇提取物尤其中高剂量条件下能有效降低高脂模型中小鼠的体重、肝重和肝系数,以及小鼠血清TG 和LDL-C,降低AI,从而调节血脂水平。但目前刺松藻中甾醇提取物降血脂方面的研究还未见报道,这有利于深入开发海洋生物资源,有利于刺松藻药用价值的多元开发利用,也为植物甾醇的提取提供了新的途径。
