燕麦β-葡聚糖、多酚及黄酮的抑菌活性研究
2020-06-05
(长江师范学院现代农业与生物工程学院,重庆408100)
燕麦属一年生植物,是重要的谷类作物之一,在中国、美国、加拿大等世界各地作为粮食、牧草和饲料均有种植。燕麦有皮燕麦和裸燕麦之分,其中我国主要以裸燕麦为主[1-2]。燕麦富含蛋白质、不饱和脂肪酸、维生素和矿物质等诸多营养成分[3],尤其是其富含的β-葡聚糖、多酚、黄酮、皂苷、生物碱等物质表现出的良好生物活性,使其被越来越多的人所熟知[4-5]。有学者研究发现燕麦β-葡聚糖具有调节血糖、降血脂、提高免疫力、改善肠道功能、抗氧化、抗癌等诸多功效[6-7],其中β-葡聚糖的分子量是影响其生理功效的重要因素之一。李文全等[8]研究发现大分子燕麦β-葡聚糖可促进粪胆固醇和胆汁酸的排出,抑制肝脏甘油三酯(triglyceride,TG)和胆固醇的沉积,增加胆汁酸的合成。王英[9]发现燕麦β-葡聚糖可增加胃肠道食糜黏性,抑制肠道酶活性,延缓胃排空,降低餐后血糖水平,增加饱腹感。任锦丽等[10]发现燕麦β-葡聚糖还可改善肾功能,有效延缓糖尿病肾病大鼠的肾脏组织结构损伤。另外燕麦中含有多种酚类物质,如阿魏酸及其衍生物、黄酮类化合物、花青素和燕麦蒽胺等,燕麦蒽胺是仅存在于燕麦中的一种N-肉桂酸衍生物,不存在于其他谷物中[11],不同品种燕麦中多酚含量也存在差异[12]。已有研究表明燕麦多酚具有较好抗氧化活性,且能有效预防酒精造成的急性肝损伤[13-15]。黄酮类化合物是膳食多酚的主要亚类之一,其具有较强的抗氧化活性和抗癌活性[16]。
燕麦β-葡聚糖、多酚及黄酮的提取及抗氧化活性功能屡有报道,但对其抑菌活性的研究较少。本研究以燕麦为原料,提取其中的燕麦β-葡聚糖、黄酮及多酚物质,选用大肠埃希氏菌、枯草芽孢杆菌、产酯酵母以及黑曲霉为指示菌,探究其抑菌活性,为燕麦在食品防腐方面的开发利用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 主要试验材料及试剂
燕麦米、马铃薯:新大兴爱家超市;燕麦β-葡聚糖(标准品):西格玛奥德里奇(上海)贸易有限公司;芦丁:合肥博美生物科技有限责任公司;没食子酸、葡萄糖、氯化钠:天津市大茂化学试剂厂;卡拉胶:海南省琼海市长青琼脂厂;牛肉膏、蛋白胨:北京奥博星生物技术有限责任公司。
1.1.2 试验菌种及培养基
大肠埃希氏菌(CMCC(B)44102)、枯草芽孢杆菌(CMCC(B)63501)、黑曲霉(CMCC(F)98003):上海鲁微科技有限公司;产酯酵母:长江师范学院生物工程微生物实验室提供。
培养基配制:参考蒋咏梅[17]的马铃薯培养基(potato dextrose agar,PDA)配方以及牛肉膏蛋白胨培养基配方进行配制。
1.1.3 仪器与设备
FZ102型微型植物粉碎机:天津市泰斯特仪器有限公司;CI540DWS型自动压力蒸汽灭菌器:致微(厦门)仪器有限公司;L550型医用离心机:长沙高新技术产业开发区湘仪离心机仪器有限公司;LRHS-150-Ⅱ型恒温恒湿培养箱:上海跃进医疗器械有限公司;ZHJH-C1112C型超净工作台、ZFD-5040型全自动新型鼓风干燥箱:上海智城分析仪器制造有限公司;T6新世纪型紫外可见分光光度计:北京普析通用仪器有限责任公司。
1.2 试验方法
将燕麦米置于鼓风干燥箱中,于50℃条件下烘干4 h,然后用植物粉碎机粉碎,过50目筛备用。
1.2.1 燕麦β-葡聚糖的提取
采用超声辅助浸提法提取[18]:称取预先制备好的燕麦粉20 g,加水400 mL,调节pH值至10.0,于50℃条件下超声浸提35 min,采用耐高温α-淀粉酶去除淀粉,加入20%的HCl溶液静置过夜离心除蛋白,加入无水乙醇沉淀离心得β-葡聚糖沉淀,将β-葡聚糖加水溶解定容至5 mL,即得β-葡聚糖提取液。
1.2.2 燕麦多酚的提取
称取预先制备好的燕麦粉20 g,加入50.6%的乙醇400 mL,于60℃水浴中浸提65 min,离心去除沉淀,将滤液旋转浓缩至10 mL,所得溶液即为燕麦中多酚提取液[19]。
1.2.3 燕麦黄酮的提取
称取预先制备好的燕麦粉20 g,加入70%的乙醇320 mL,于55℃条件下超声提取90 min,然后离心,去除沉淀,将滤液旋转浓缩至10 mL,所得溶液即为燕麦中黄酮提取液[20]。
1.2.4 燕麦β-葡聚糖标准曲线的绘制
以燕麦β-葡聚糖为标准品,采用刚果红分光光度法在545 nm波长条件下测定各吸光度值[21]。
燕麦β-葡聚糖标准溶液的配制:准确称取0.020 g燕麦β-葡聚糖,加少量去离子水,在70℃水浴条件下搅拌溶解,待其溶解完全后,取出冷却至20℃,加去离子水定容至200 mL,得标准溶液(0.1 mg/mL)。
刚果红溶液:准确称取刚果红试剂0.020 g,用磷酸缓冲液(0.1 mol/L、pH 8.0)溶解并定容至200 mL。取10mL 试管 6 只,分别加入 0、0.2、0.4、0.6、0.8、1.0 mL燕麦β-葡聚糖标准储备液(0.1 mg/mL),用去离子水补至1.0 mL,然后各加入4.0 mL刚果红溶液(0.1 mg/mL),摇匀,于20℃的水浴中静置30 min,在545 nm波长条件下测定吸光度值,以燕麦β-葡聚糖的质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
1.2.5 燕麦多酚标准曲线的绘制
精确称取25 mg没食子酸,用水溶解并定容至250 mL,得标准溶液(0.1 mg/mL)。取10 mL试管6只,分别加入 0.0、0.2、0.4、0.6、0.8、1.0 mL 没食子酸标准溶液,然后各加入1 mL福林酚试剂,摇匀,加15%Na2CO3溶液2mL,定容至10 mL,20℃条件下20℃下静置2 h,在760 nm处测定吸光度值,以没食子酸的质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线[19]。
1.2.6 燕麦黄酮标准曲线的绘制
称量预先烘干至恒重的芦丁标准品32.2 mg,用70%的乙醇溶解定容至500 mL,摇匀,得芦丁标准溶液(0.064 4 mg/mL)。取10 mL试管6只,分别加入标准溶液 0.00、0.25、0.50、1.00、1.50、2.00 mL,然后各加入0.10 mol/L AlCl3溶液 1.00 mL、1.0 mol/L 的 CH3COOK溶液1.50 mL,用70%的乙醇定容至5 mL后摇匀,于20℃下静置30 min,于420 nm处测定吸光度值,以芦丁的质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线[20]。
1.2.7 指示菌液的制备
将供试细菌(大肠埃希氏菌、枯草芽孢杆菌)接种于牛肉膏蛋白胨固体斜面培养基上,供试真菌(产酯酵母、黑曲霉)接种于马铃薯培养基(PDA培养基)上,分别置于37℃(细菌)和28℃(真菌)恒温恒湿培养箱中培养48 h,连续传代2次。在无菌条件下取活化好的菌株,用接种环分别挑取1环菌种放入100 mL无菌生理盐水中,振荡混合均匀,制成菌悬液,备用。
1.2.8 抑菌试验
滤纸片法:将提取的各燕麦活性物质稀释成0.00、0.06、0.12、0.24、0.36、0.48 mg/mL 的系列溶液,用镊子夹取经高压蒸汽灭菌后的滤纸片(6 mm),将其浸泡在不同浓度的提取物溶液中备用;在无菌条件下,加入0.1 mL供试菌种悬液,用涂布器均匀涂布于培养基表面,然后将经作用液浸泡后的滤纸片置于含菌培养基表面,放于培养箱中培养24 h,观察抑菌圈的形成,采用十字交叉法测定抑菌圈直径,重复3次,取平均值。当抑菌圈直径大于6 mm时,表示有抑菌作用;若对照组也产生抑菌圈,表示试验失败无效[22]。
牛津杯法:将已灭菌的培养基冷却至60℃左右,倒入培养皿内,每皿约20 mL待其凝固;在无菌条件下,吸取0.1 mL菌悬液置于平板内,用涂布器涂布均匀;然后将经灭菌处理的牛津杯(内径6 mm,外径8 mm)垂直摆放于培养基表面,轻轻按压使其与培养基无隙接触,加入 0.00、0.06、0.12、0.24、0.36、0.48 mg/mL的系列溶液0.25 mL,放在培养箱里培养24 h,观察抑菌圈并记录数据,重复3次,取平均值。当抑菌圈直径大于8 mm时,表示有抑菌作用;若对照组也产生抑菌圈,表示试验失败无效。
1.3 数据处理
2 结果与分析
2.1 燕麦β-葡聚糖标准曲线
以燕麦β-葡聚糖质量浓度为横坐标,相应吸光度值为纵坐标,绘制标准曲线,如图1。

图1 β-葡聚糖标准曲线Fig.1 Standard curve of β-glucan
得到曲线方程为:y=0.038 7x-0.011,根据曲线方程计算得提取液中燕麦β-葡聚糖的含量为0.526 mg/mL。
2.2 燕麦多酚标准曲线
以没食子酸质量浓度为横坐标,相应吸光度值为纵坐标,绘制标准曲线,如图2。
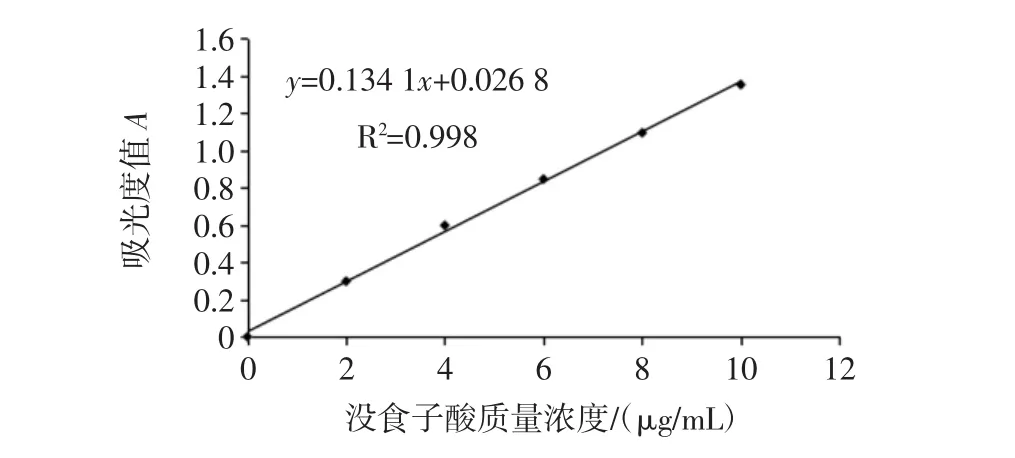
图2 没食子酸标准曲线Fig.2 Standard curve of gallic acid
得到曲线方程为:y=0.134 1x+0.026 8,根据曲线方程计算得提取液中燕麦总酚的含量为0.586 mg/mL。
2.3 燕麦黄酮标准曲线
以芦丁质量浓度为横坐标,相应吸光度值为纵坐标,绘制标准曲线,如图3。
得到曲线方程为:y=0.028 6x+0.013 6,根据曲线方程计算得提取液中燕麦总黄酮的含量为0.537 mg/mL。
2.4 燕麦β-葡聚糖的抑菌效果
2.4.1 滤纸片法测定燕麦β-葡聚糖的抑菌效果
将经过系列浓度梯度燕麦β-葡聚糖提取液浸泡后的滤纸片置于含菌培养基上,测定其抑菌圈,记录数据见表1。

图3 芦丁标准曲线Fig.3 Standard curve of rutin

表1 滤纸片法测定燕麦β-葡聚糖的抑菌效果Table 1 The antibacterial effects of oat β-glucan determined by filter paper method
由表1数据可知,燕麦β-葡聚糖提取物对4种供试菌抑制作用不同,抑菌作用顺序为大肠埃希氏菌>枯草芽孢杆菌>产酯酵母>黑曲霉。当燕麦β-葡聚糖浓度为0.36 mg/mL时对大肠埃希氏菌和枯草芽孢杆菌具有明显抑菌作用,但对产酯酵母和黑曲霉抑菌作用不显著,抑菌圈大小均随燕麦β-葡聚糖浓度的增大而增大,说明燕麦β-葡聚糖的浓度对其抑菌作用存在影响。
2.4.2 牛津杯法测定燕麦β-葡聚糖的抑菌效果
采用牛津杯法测定燕麦β-葡聚糖提取液对4种供试菌的抑菌活性,测定抑菌圈,得数据见表2。

表2 牛津杯法测定燕麦β-葡聚糖的抑菌效果Table 2 The antibacterial effects of oat β-glucan determined by Oxford cup method
由表2中数据可知,该方法显示燕麦β-葡聚糖提取物对4种供试菌均有一定抑制作用,抑菌作用大小顺序与滤纸片法测得一致,为大肠埃希氏菌>枯草芽孢杆菌>产酯酵母>黑曲霉。当燕麦β-葡聚糖浓度为0.12 mg/mL时对大肠埃希氏菌和枯草芽孢杆菌具有明显抑菌作用,比滤纸片法作用较明显。对产酯酵母和黑曲霉抑菌作用与空白相比在浓度为0.36 mg/mL才表现出显著差异,但抑菌圈大小也随燕麦β-葡聚糖浓度的增大而增大,该结论与滤纸片法一致。
苏亚平[23]研究表明酵母β-葡聚糖对大肠杆菌、金黄色葡萄球菌、沙门氏菌等有明显抑制效果。唐艳红等[24]研究报道燕麦β-葡聚糖对大肠埃希氏菌、啤酒酵母均有显著抑制作用,最低抑菌浓度为2%,但对黑曲霉抑制作用不明显。Khan等[25]研究了酵母β-葡聚糖的抗菌活性,提出酵母β-葡聚糖的抑菌作用机理可能是由于低分子量的酵母β-D-葡聚糖进入细胞,扰乱微生物的新陈代谢,从而导致微生物细胞裂解死亡。该试验采用滤纸片法及牛津杯法测定燕麦β-葡聚糖的抑菌活性,发现燕麦β-葡聚糖对4种供试菌有较弱抑菌作用,所得抑菌作用顺序为大肠埃希氏菌>枯草芽孢杆菌>产酯酵母>黑曲霉。数据显示燕麦β-葡聚糖对大肠埃希氏菌、枯草芽孢杆菌的抑制作用在浓度较高时才凸显,这可能与燕麦β-葡聚糖作用液浓度太低或者成分纯度有关,后期可考虑提高葡聚糖作用浓度及纯度来进行抑菌探究。
2.5 燕麦多酚的抑菌效果
2.5.1 滤纸片法测定燕麦多酚的抑菌效果
滤纸片法测定燕麦多酚的抑菌效果见表3。

表3 滤纸片法测定燕麦多酚的抑菌效果Table 3 The antibacterial effects of oat polyphenols determined by filter paper method
表3中数据显示,燕麦多酚提取物对4种供试菌均有一定抑制作用,抑菌作用顺序为大肠埃希氏菌>枯草芽孢杆菌>产酯酵母>黑曲霉。其中对大肠埃希氏菌及枯草芽孢杆菌作用较明显,在燕麦多酚提取物浓度为0.12 mg/mL和0.24 mg/mL时抑菌圈大小与空白对照组对比即表现出显著差异。对产酯酵母及黑曲霉的抑菌效果较差,在浓度为0.36 mg/mL和0.48 mg/mL时其抑菌圈才表现出显著差异,抑菌圈大小随燕麦多酚浓度的增大而增大。
2.5.2 牛津杯法测定燕麦多酚的抑菌效果
采用牛津杯法测定燕麦多酚提取液对4种供试菌的抑菌活性,测定抑菌圈,得到数据见表4。

表4 牛津杯法测定燕麦多酚的抑菌效果Table 4 The antibacterial effects of oat polyphenols determined by Oxford cup method
表4中数据显示燕麦多酚提取物对4种供试菌均有一定抑制作用,抑菌作用大小顺序与滤纸片法测得一致,为大肠埃希氏菌>枯草芽孢杆菌>产酯酵母>黑曲霉。当燕麦多酚浓度为0.06 mg/mL时对大肠埃希氏菌和枯草芽孢杆菌的抑菌作用与空白相比就表现出极显著差异,抑菌圈大小相对于滤纸片法也偏大。对产酯酵母和黑曲霉抑菌作用与空白相比在浓度为0.24 mg/mL和0.36 mg/mL才表现出显著差异,抑菌圈大小也随燕麦多酚浓度的增大而增大,与滤纸片法结论一致。
郝教敏等[26]研究发现燕麦多酚可抑制猪肉中微生物的快速繁殖,且添加量越大,抑菌效果越好。多酚具有的抑菌活性,是由于多酚能够破坏菌体的细胞壁,使碱性磷酸酶渗出,增加细胞膜通透性,从而导致金属离子、蛋白质的渗漏而使细胞代谢紊乱;另外多酚还可与蛋白质结合,使蛋白质变性或抑制酶活力进而破坏代谢过程[27]。数据显示燕麦多酚提取物具有较强抑菌活性,且提取物对4种供试菌的抑菌圈大小随着提取物浓度的增加而增大,抑菌作用顺序为大肠埃希氏菌>枯草芽孢杆菌>产酯酵母>黑曲霉。
2.6 燕麦黄酮的抑菌效果
2.6.1 滤纸片法测定燕麦黄酮的抑菌效果
滤纸片法测定燕麦黄酮的抑菌效果见表5。

表5 滤纸片法测定燕麦黄酮的抑菌效果Table 5 The antibacterial effects of oat flavonoids determined by filter paper method
由表5数据可知,燕麦黄酮提取物对4种供试菌抑菌效果存在差异,其抑菌作用顺序为大肠埃希氏菌>枯草芽孢杆菌>产酯酵母>黑曲霉。其中对大肠埃希氏菌和枯草芽孢杆菌的抑菌效果比较明显,对大肠埃希氏菌的抑菌作用在提取物浓度为0.12 mg/mL时抑菌圈大小与空白对照即存在显著差异,而对枯草芽孢杆菌在提取物浓度为0.36 mg/mL时抑菌作用才凸显,对产酯酵母和黑曲霉得抑菌效果较弱,在浓度为0.48 mg/mL才表现出微弱抑菌效果,其整体抑菌作用仍随着燕麦黄酮提取物浓度的增大而增强。
2.6.2 牛津杯法测定燕麦黄酮的抑菌效果
采用牛津杯法测定燕麦黄酮提取液对4种供试菌的抑菌活性,测定抑菌圈,得到数据见表6。

表6 牛津杯法测定燕麦黄酮的抑菌效果/mmTable 6 The Antibacterial effects of oat flavonoids determined by Oxford cup method/mm
表6中数据显示燕麦黄酮提取物对4种供试菌均有抑制作用,抑菌作用大小顺序与滤纸片法测得一致,为大肠埃希氏菌>枯草芽孢杆菌>产酯酵母>黑曲霉。当燕麦黄酮浓度分别为0.06 mg/mL和0.12 mg/mL时对大肠埃希氏菌和枯草芽孢杆菌的抑菌作用与空白相比就表现出极显著差异,抑菌圈与滤纸片法相比较大。对产酯酵母和黑曲霉抑菌作用与空白相比在浓度为0.24 mg/mL才表现出显著差异,抑菌圈大小也随燕麦多酚浓度的增大而增大,与滤纸片法结论一致。
黄酮类化合物是多酚化合物中的一种,钟珍等[28]发现菱角壳黄酮提取物对金黄色葡萄球菌和假单胞菌有较强的抑菌作用,对热杀索丝菌相对较弱,对大肠杆菌、乳酸菌及酵母菌均无抑菌作用。本试验采用滤纸片法及牛津杯法探究燕麦黄酮的抑菌效果,数据显示燕麦黄酮对大肠埃希氏菌、枯草芽孢杆菌、产酯酵母以及黑曲霉4种供试菌均有抑制作用,作用大小顺序为大肠埃希氏菌>枯草芽孢杆菌>产酯酵母>黑曲霉,且其抑制作用随其浓度增大而增强。
3 结论
鉴于多糖组成及结构的相似性,试验采用滤纸片法和牛津杯法对燕麦β-葡聚糖对大肠埃希氏菌、枯草芽孢杆菌、产酯酵母以及黑曲霉4种供试菌的抑菌效果进行探索。本文利用滤纸片法和牛津杯法对燕麦β-葡聚糖、多酚及黄酮对大肠埃希氏菌、枯草芽孢杆菌、产酯酵母及黑曲霉的抑菌活性进行探索。研究结果表明燕麦中不同提取物对4种供试菌的抑菌作用有所差别,其中燕麦β-葡聚糖对4种供试菌的抑菌作用较弱,燕麦多酚及黄酮提取物的抑菌活性相对较强,且相同作用浓度条件下的燕麦多酚提取物的抑菌作用最强,黄酮次之,β-葡聚糖最差,抑菌作用顺序为大肠埃希氏菌>枯草芽孢杆菌>产酯酵母>黑曲霉,但3种提取物对4种供试菌的抑菌圈大小都随着提取物浓度的增加而增大。目前对燕麦多酚、黄酮及β-葡聚糖的抑菌相关研究较少,研究显示燕麦多酚、黄酮及β-葡聚糖存在一定抑菌活性,这表明燕麦β-葡聚糖、多酚及黄酮作为天然防腐剂在食品工业中具有潜在应用前景,但对其抑菌机理还有待进一步研究。
