高吸附Pb2+的异常威客汉姆酵母QF-1-1吸附Pb2+特性及机理
2020-06-01李丽杰贺银凤
李丽杰,贺银凤
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
随着经济与工业的迅速发展,农药的使用、铅冶炼企业的废物处理、含铅汽油燃烧后的汽车尾气、废铅蓄电池非法拆解等使铅污染日益加重,而铅污染会通过空气、水、土壤及农作物、食品等最终进入人体。铅对人体是多系统、多亲和性的毒物[1-2],对人类健康构成了巨大威胁。
对于去除环境及食品中的铅污染问题,微生物吸附法因其具有无污染、成本低等优点已成为广泛认可的铅脱除方法。目前,对于这类微生物的研究主要集中在乳酸菌上。但已有研究发现,除乳酸菌外,酵母菌对重金属铅同样具有良好的吸附能力,并且有些酵母菌可以应用于食品发酵工业中。众多学者发现酿酒酵母(Saccharomyces cerevisiae)对Pb2+、Cd2+、Cr2+、Hg2+等具备较高的吸附性能,在水溶液中对各离子的去除率可以达到90%以上[3-5]。Ilyas等[6]从工业废水中分离出的热带假丝酵母PS33培养8 d后,能从35 mmol/L含Pb2+培养基中除去87% Pb2+。本实验室自内蒙古包头重金属污染区土壤分离筛选到4 株高抗、高吸附性的异常威客汉姆酵母(Wickerhamomyces anomalus),其对Pb2+的耐受质量浓度在6 000~7 000 mg/L之间,去除率可达78.94%~91.67%,具备一定的研究应用潜力[7]。
随着研究的进展,人们发现酵母菌对重金属的吸附主要通过胞外结合的被动吸附和胞内主动累积2 个阶段。胞外吸附又包括表面络合、离子交换、无机微沉积、静电吸附、氧化还原和酶促以应等[8]。而胞内的主动累积可能涉及细胞壁外层与重金属结合的某些透膜酶、水解酶和多肽以及对重金属结合物进行区隔的一些转运系统[9]。由此可见,酵母菌吸附重金属机理较为复杂,并且不同酵母菌的吸附特性和吸附机理不尽相同。
本研究以前期筛选获得的一株高吸附铅的异常威客汉姆酵母为研究对象,对其Pb2+吸附特性及机制进行研究,结果为阐明酵母菌Pb2+吸附的机理提供依据。异常威客汉姆酵母作为产香酵母被广泛应用到白酒、葡萄酒、酱油、醋、面包等发酵食品和发酵饲料中,因此也可为此酵母菌能进一步应用于环境、食品、人体中去除Pb2+的应用研究提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
W. anomalus QF-1-1分离自内蒙古包头土壤中,对重金属Pb2+具备较高的吸附能力,由内蒙古农业大学食品学院食品生物技术团队提供。
YPD液体培养基:2%葡萄糖、2%蛋白胨、1%酵母粉,pH 6.0(115 ℃,20 min)。
1.2 仪器与设备
HF-SAFE 1500型生物安全柜 力康生物医疗科技控股有限公司;SX-500型全自动高压灭菌锅 日本Tomy Digital Biology公司;AAS990火焰原子吸收光谱仪北京普析通用公司;HZQ-C气浴恒温振荡器 常州金坛精达仪器制造有限公司;PB-10型数显酸度计 德国Sartorius公司;5810R型高速低温离心机 德国Eppendorf公司;CP224C型电子天平 奥豪斯仪器(上海)有限公司;LABCONCO冷冻干燥机 北京照生行仪器设备有限公司;单道移液枪 德国艾本德股份公司。
1.3 方法
1.3.1 QF-1-1活化及供试菌液的制备
甘油保存的异常W. anomalus QF-1-1解冻后,取100 μL菌液(体积分数2%的接种量)接种于20 mL YPD培养基中,在恒温培养箱中振荡培养24 h(30 ℃,160 r/min),获得一代菌。之后按照相同接种量,将QF-1-1活化3 代。将活化好的3 代菌液离心(6 000 r/min,6 min,4 ℃)弃上清液,用超纯水洗涤菌体3 次(6 000 r/min,6 min,4 ℃)后制备成质量浓度0.3 g/mL的菌悬液用于后续实验。
1.3.2 QF-1-1对Pb2+的吸附
本研究采用摇瓶法,取20 mL待测Pb2+溶液置于50 mL三角瓶中,30 ℃水浴振荡箱保温1 h,加入供试菌液至要求的质量浓度,继续于水浴振荡箱中(30 ℃、160 r/min)振荡培养一定时间。吸附结束后,吸附液离心(12 000 r/min,10 min)取上清液,用火焰原子吸收光谱仪测定Pb2+含量,计算酵母菌对Pb2+的去除率及吸附量。
1.3.3 各因素对QF-1-1吸附Pb2+的影响
1.3.3.1 pH值的影响
按照1.3.2节的实验操作,分别在吸附时间140 min,Pb2+溶液的初始质量浓度100 mg/L,菌体质量浓度11 g/L,Pb2+溶液的初始pH值为4、4.5、5、5.5、6条件下,计算酵母菌对Pb2+的去除率及吸附量。
1.3.3.2 Pb2+溶液初始质量浓度的影响
按照1.3.2节的实验操作,分别在吸附时间140 min,Pb2+溶液的初始pH 5.5,菌体质量浓度11 g/L,Pb2+溶液的初始质量浓度为100、200、300、400、500 mg/L条件下,计算酵母菌对Pb2+的去除率及吸附量。
1.3.3.3 菌体质量浓度的影响
按照1.3.2节的实验操作,分别在吸附时间140 min,Pb2+溶液的初始pH 5.5,Pb2+溶液的初始质量浓度100 mg/L,菌体质量浓度为7、9、11、13、15 g/L条件下,计算酵母菌对Pb2+的去除率及吸附量。
1.3.3.4 吸附时间的影响
按照1.3.2节的实验操作,分别在菌体质量浓度11 g/L,Pb2+溶液的初始pH 5.5,Pb2+溶液的初始质量浓度100 mg/L,吸附时间为60、80、100、120、140、160 min条件下,计算酵母菌对Pb2+的去除率及吸附量。
1.3.4 表面基团掩蔽对QF-1-1吸附Pb2+的影响
为了探究QF-1-1表面基团在Pb2+吸附中发挥的作用,将活化3 代离心所得的湿菌体用不同的方式进行化学处理,使得菌体表面的羧基、氨基及磷酸基团被掩蔽,再进行吸附Pb2+的实验,通过测定掩蔽前后菌体吸附Pb2+的差异,评价不同基团在QF-1-1吸附Pb2+中的作用。
将1.3.1节活化3 代离心所得到的湿菌体加至盐酸浓度为0.1 mol/L的无水甲醇溶液中,调节其质量浓度为10 g/L(以菌体干质量计),30 ℃水浴振荡箱中160 r/min振荡24 h以掩蔽羧基[10];加至甲醛-甲酸混合溶液(1∶2,V/V)中,调节其质量浓度为1 g/L,30 ℃水浴振荡箱中160 r/min振荡6 h以掩蔽氨基和羟基[11];加至亚磷酸三乙酯(97%)-硝基甲烷混合溶液(1.25∶1,V/V)中,调节其质量浓度为1 g/L,30 ℃水浴振荡箱中160 r/min振荡6 h以掩蔽磷酸基团[12]。将以上处理的菌体用超纯水洗涤 3 次(6 000 r/min,6 min,4 ℃),按照1.3.1节进行供试菌液的制备,并按照1.3.3节得到的最佳条件进行Pb2+的吸附实验,以未经基团掩蔽处理的菌体做对照实验。
1.3.5 化学试剂处理对QF-1-1吸附Pb2+的影响
将1.3.1节离心所得到的湿菌体,分别加入到0.1 mol/L氨水、盐酸、硫酸、乙酸、乙醇、氯化钠、氢氧化钠中,使其质量浓度为2 g/L,于水浴振荡箱中(30 ℃、160 r/min)处理60 min,用超纯水洗涤3 次(6 000 r/min,6 min,4 ℃),而后用去离子水漂洗至pH值不再变化,收集湿菌体,制成0.30 g/mL的菌悬液[13-14]。按照1.3.2节的方法测定各种化学试剂处理后QF-1-1对Pb2+的吸附能力,以未经化学试剂处理的菌体做对照实验。
1.3.6 QF-1-1对Pb2+吸附稳定性研究
按照1.3.2节所述方法进行吸附实验,将铅溶液和菌体分开得到沉淀菌体,12 000 r/min离心10 min获得吸附完成后的菌体,计算菌体的Pb2+吸附量。分别加入与上清液等体积的超纯水、0.1 mmol/L和1.0 mmol/L的EDTA溶液以及1.5 mmol/L和15 mmol/L的HNO3、0.1 mol/L HCl、0.05 mol/L H2SO4、0.1 mol/L NaCl 8 种解吸附溶液[15-17],于160 r/min,30 ℃振荡30 min后,12 000 r/min离心10 min获得上清液,利用获得的菌体重复上述处理过程3 次。用原子吸收光谱仪测定每次解吸后上清液中的Pb2+含量,按式(1)、(2)计算每种溶液的解吸率及菌体上未被洗脱的Pb2+占比:
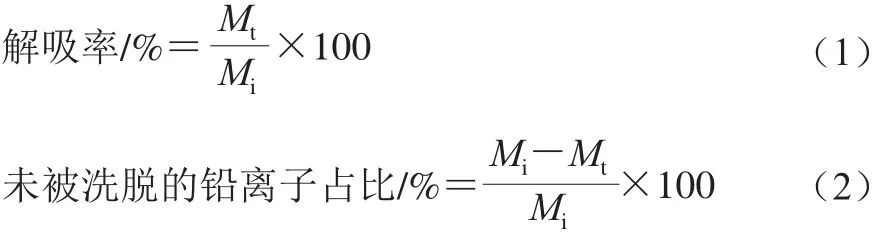
式中:Mi为吸附完成时菌体上Pb2+浓度;Mt为解吸溶液中Pb2+的浓度。
1.3.7 QF-1-1对Pb2+去除率和吸附量的计算
标准曲线的绘制:以硝酸铅绘制标准曲线,以Pb2+溶液的质量浓度(0~100 mg/L)为横坐标轴,火焰原子吸收分光光度计的吸光度为纵坐标轴,得到线性回归方程y=0.009 9x+0.01,R2=0.999 6。
根据样品测定得到的吸光度,代入线性回归方程求出Pb2+的含量,并利用式(3)、(4)计算吸附量(mg/g,以湿菌质量计算)和去除率:
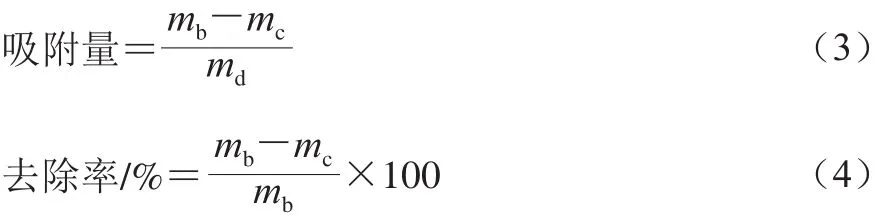
式中:mb为未接种QF-1-1处理溶液中的Pb2+含量/mg;mc为QF-1-1处理后溶液中的Pb2+含量/mg;md为QF-1-1的添加量/g。
1.4 数据处理
每组实验重复3 次,利用SPSS 20.0进行单因素方差分析与显著性差异分析,数据结果以 ±s表示。图表利用Excel软件进行绘制,差异显著,P<0.05。
2 结果与分析
2.1 各因素对QF-1-1吸附Pb2+的影响结果
2.1.1 Pb2+溶液初始pH值的影响
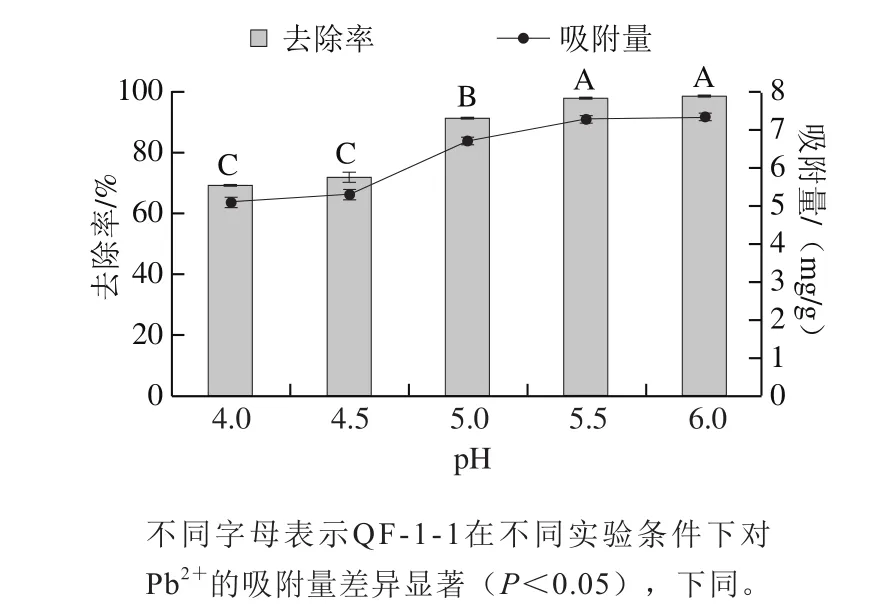
图1 pH值对QF-1-1吸附Pb2+的影响Fig. 1 Effect of pH value on QF-1-1 adsorption toward Pb2+
pH值在微生物吸附重金属的过程中起重要作用,它可以通过改变溶液中金属离子的溶解度、离子交换过程以及细胞壁上羧酸盐、磷酸盐、氨基和巯基官能团的电离状态影响吸附平衡时间和吸附能力[18]。具有活性的生物吸附基团接受或丧失质子的能力也主要取决于pH值[19]。由图1可知,随着pH值升高,QF-1-1对Pb2+的吸附量和去除率均呈上升趋势,变化趋势相同。当pH值低于4.5时,吸附量和去除率均较低,这可能是因为溶液中大量存在的水合H+会与Pb2+竞争QF-1-1细胞壁上吸附活性位点,并使菌体细胞壁质子化,增加细胞表面的静电斥力,使得吸附量较低。随着pH值的升高,吸附量急剧升高,并在pH 5.5时基本趋于稳定,此时吸附量为7.29 mg/g、去除率为97.89%,与pH 6时无显著性差异。原因是随着pH值的增加,羧基和氨基配体等官能团的去质子化使细胞表面将携带更多的负电荷,这有利于铅离子通过电化学吸引和吸附作用而结合在细胞表面[20-21]。
Xing Sicheng[22]、Al-Fakih[23]等研究也表明,由于在低pH值下Pb2+和带正电的生物质之间会存在静电排斥作用,微生物的铅累积能力会随着pH值的升高而增加。但当pH值高于6时,铅离子会沉淀。故选取pH 5.5进行后续实验,同时可以避免pH值过高导致OH-和Pb2+生成氢氧化铅沉淀,对吸附实验造成影响。
2.1.2 Pb2+溶液初始质量浓度的影响
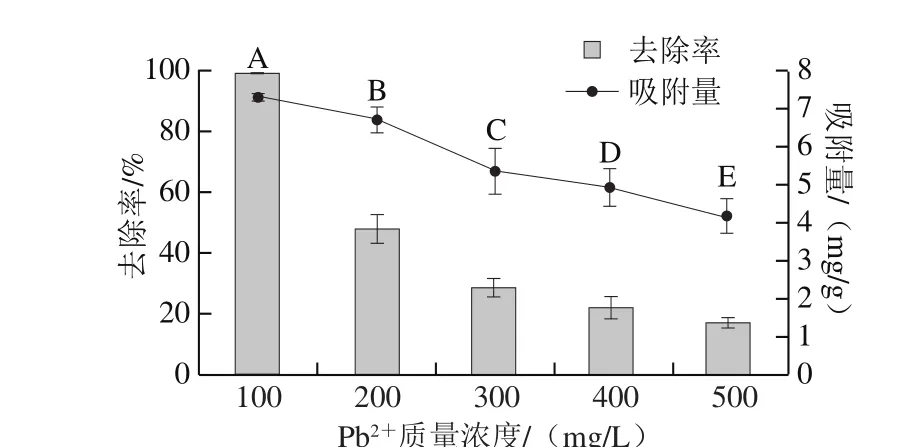
图2 Pb2+质量浓度对QF-1-1 吸附Pb2+的影响Fig. 2 Effect of initial Pb2+ concentration on QF-1-1 adsorption toward Pb2+
由图2可知,随着Pb2+溶液质量浓度的升高,QF-1-1对Pb2+吸附量和去除率均逐渐下降,在500 mg/mL时达到最低,去除率和吸附量分别为17.02%和4.16 mg/g。其原因可能是当Pb2+质量浓度为100 mg/L时,Pb2+的量与细胞表面的吸附位点趋于平衡,溶液中所有的Pb2+几乎全部被吸附,然而随着Pb2+质量浓度的升高,细胞表面对Pb2+吸附位点开始饱和,导致去除率和吸附量均逐渐下降[24-25]。因此后续实验选择Pb2+溶液质量浓度为100 mg/L。Pb2+溶液质量浓度对各种微生物吸附Pb2+的影响研究结果不尽相同,本研究与Gunjal[19]、Ma Yanyan[26]等的结论基本一致。而Li Xiaohui[18]和Wahab[21]等研究发现,随着Pb2+的初始质量浓度增加,木贼镰刀菌和荧蒽降解菌FA1对Pb2+去除率逐渐下降,但是吸附量却表现出持续增加或逐渐上升随后下降的趋势。说明不同微生物对Pb2+的吸附能力表现不同。
2.1.3 菌体质量浓度的影响
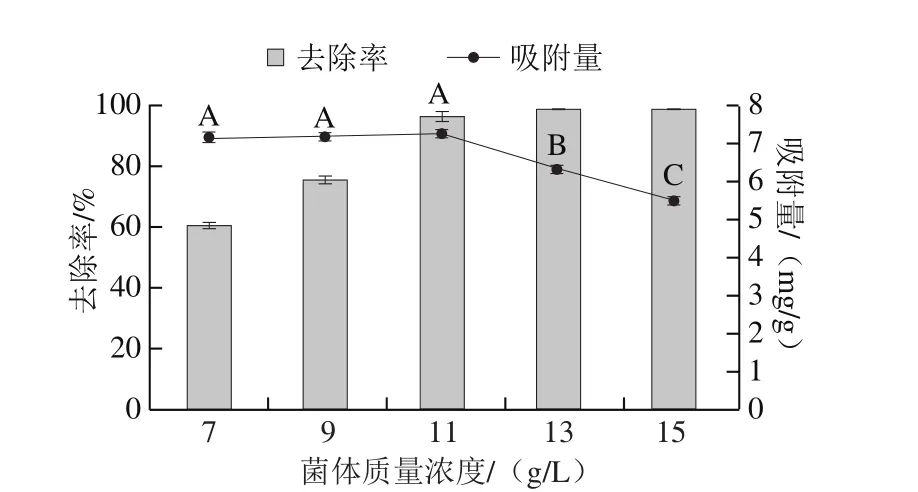
图3 QF-1-1菌体质量浓度对吸附Pb2+的影响Fig. 3 Effect of cell concentrations on Pb2+ absorption by QF-1-1
由图3可知,随着菌株QF-1-1质量浓度的增加,其对Pb2+的吸附量和去除率的影响不同。当菌体质量浓度小于11 g/L时,吸附量随着菌浓度的增加缓慢增加,去除率快速上升,由60.54%升至96.52%,并在菌体质量浓度11 g/L时吸附量达到最大值7.27 mg/g。而当菌体质量浓度大于11 g/L时,吸附量逐渐下降,去除率趋于平稳。这与诸多学者研究的绿色木霉对Ni2+、酿酒酵母对Cd2+、产碱菌属对Pb2+的吸附结果一致[4,27-28]。原因可能是当菌体质量浓度为11 g/L时,菌的吸附位点恰好和溶液中游离的Pb2+含量平衡,而随着菌浓度的增加,菌体表面的部分吸附位点未饱和,而此时对Pb2+的去除几乎完全,因此造成单位吸附位点吸附量降低。此外,菌体表面积的聚集或重叠以及对Pb2+的可用吸附位点的竞争对生物吸附效率产生不利影响,可能使一部分结合位点消失,从而出现吸附量下降、去除率基本不变的现象[29]。也可能是由于在高的菌体浓度下,会发生部分细胞聚集从而导致细胞壁的三维结构和以应基团(COO-和NH3+)之间的内部连接,从而减少了金属离子在菌体中的扩散和吸附结合位点的可及性[30]。
2.1.4 吸附时间的影响
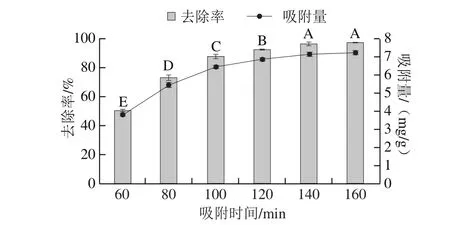
图4 吸附时间对QF-1-1吸附Pb2+的影响Fig. 4 Effect of adsorption time on Pb2+ adsorption by QF-1-1
由图4可知,QF-1-1对Pb2+去除率和吸附量变化趋势相同,在吸附时间为60 min时,去除率已经达到50.89%,完成吸附过程的一半,说明该菌株对重金属Pb2+大部分的吸附在短时间内即可完成,是一个较为快速的过程。该吸附过程主要是菌体细胞表面的吸附作用,可能是重金属离子通过表面络合、静电吸附、离子交换或者与细胞壁上的某些官能团结合[31]。该吸附过程取决于细胞表面上官能团的可用性和金属离子的性质[21]。随着时间进一步延长,吸附量和去除率继续呈现上升趋势,但增加缓慢,在140 min时去除率和吸附量已经基本趋于稳定,去除率和吸附量分别为95.44%和7.10 mg/g,与160 min无显著差异。推测原因可能是随着细胞的通透性改变和离子交换等作用,重金属离子通过无机微沉淀、氧化还原作用等进一步进入细胞质壁间,所以吸附过程逐渐减缓,直至表面结合位点饱和并达到平衡[27-28]。
2.2 QF-1-1菌体表面基团对Pb2+吸附能力的比较
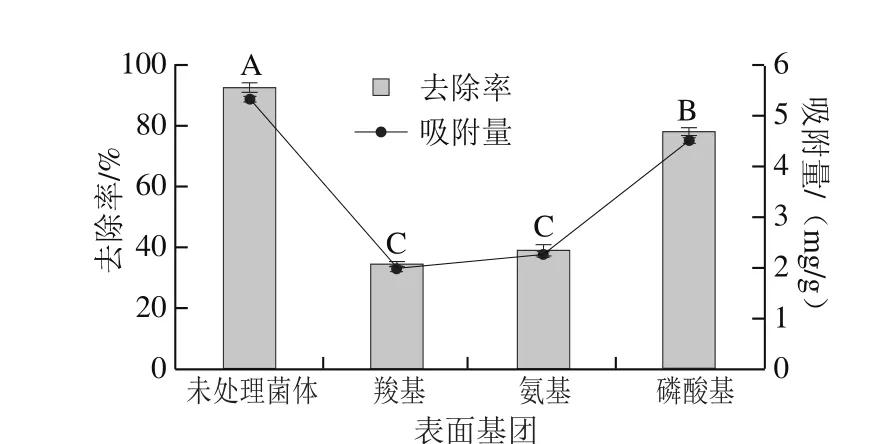
图5 掩蔽菌体表面基团对菌株QF-1-1吸附Pb2+的影响Fig. 5 Effect of chemical treatment of different functional groups on the cell surface on Pb2+ adsorption by QF-1-1
据报道,羧基、氨基及磷酸基团这3 个官能团的螯合活性,是所有细菌与Pb2+结合的原因[22]。由图5可知,与未处理的菌体比较,经基团掩蔽后的菌株QF-1-1的去除率及吸附量都显著下降。其中经羧基、氨基、磷酸基掩蔽后的菌株QF-1-1的去除率从92.61%分别下降到34.13%、38.69%、77.84%,差异极显著(P<0.01)。说明3 种基团在菌株QF-1-1吸附Pb2+过程中均发挥了很重要的作用,贡献率为羧基>氨基>磷酸基,而其中羧基和氨基的贡献率没有显著性差异(P>0.05)。韩润平等[32]也发现啤酒酵母的羧基酯化后,其吸附能力下降35%。Salah[3]和邵昭[33]等证实酵母中存在的羧基,氨基和磷酸基是金属离子的主要生物吸附位点。Gazem等[34]对曲霉菌吸附Cu2+、Pb2+的研究也得到了类似的结论,说明在微生物吸附重金属的过程中,起主要作用的官能团是一致的。
2.3 化学试剂处理对QF-1-1吸附Pb2+的影响
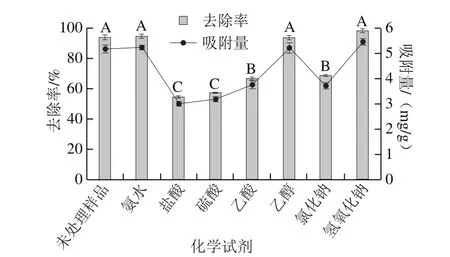
图6 化学试剂处理对菌株QF-1-1吸附效果的影响Fig. 6 Effect of different chemical treatments on Pb2+ adsorption by QF-1-1
由图6可知,与对照相比,经氨水、氢氧化钠及乙醇处理后,菌株QF-1-1的去除率及吸附量均有所升高,去除率从93.76%分别上升到94.58%、98.24%和93.83%,但是差异不显著(P>0.05)。其原因是氨水和氢氧化钠提供了—OH,改变了菌株QF-1-1表面的某些化学性质,使菌体的电位电负性增加,造成菌体表面具有更多的负电荷活性基团,如羧基、氨基等,使其更易接受Pb2+而使去除率升高。邵昭[33]和Gazem等[34]通过对酵母菌和曲霉菌的研究得到了类似的结果。乙醇使吸附能力提高可能是因为乙醇使蛋白质变性,破坏细胞结构,造成细胞壁表面的官能团暴露[13]。
与对照相比,经盐酸、硫酸及乙酸处理后,QF-1-1对Pb2+的去除率及吸附量均大幅降低,差异极显著(P<0.01)。其中经盐酸处理后的去除率最低,从93.76%下降到54.20%。其原因可能是酸使QF-1-1表面具有一定的H+而呈现正电性,与Pb2+相斥,从而使去除率降低。而氯化钠处理后,QF-1-1的去除率从93.76%下降到68.25%,差异极显著(P<0.01),原因是正离子Na+与Pb2+相斥,从而使Pb2+去除率降低。Li Chunsheng等[35]研究发现鲁氏酵母对Cd2+和Pb2+的去除率和吸附量均随着NaCl浓度的增加明显降低,而酿酒酵母对Cd2+的吸附表现与鲁氏酵母相同,对Pb2+的吸附量却呈现先增加后减低的趋势。
Ma Ning等[36]研究表明,在6 mg/L和20 mg/L Cd2+2 种质量浓度下,随着NaCl浓度的提高,毕赤酵母对Cd2+的吸附量逐渐下降,但酿酒酵母对Cd2+的吸附量却随着NaCl浓度的提高呈现先升高后降低的趋势。在去除率方面,在2 种Cd2+浓度下,毕赤酵母对Cd2+去除率均呈现上升趋势,但酿酒酵母对Cd2+去除率影响不大。以上结论表明,NaCl对酵母菌吸附重金属的影响与酵母菌的种类、是否在培养基中、NaCl的浓度、重金属种类及浓度均有密切关系。
2.4 QF-1-1对Pb2+的吸附稳定性
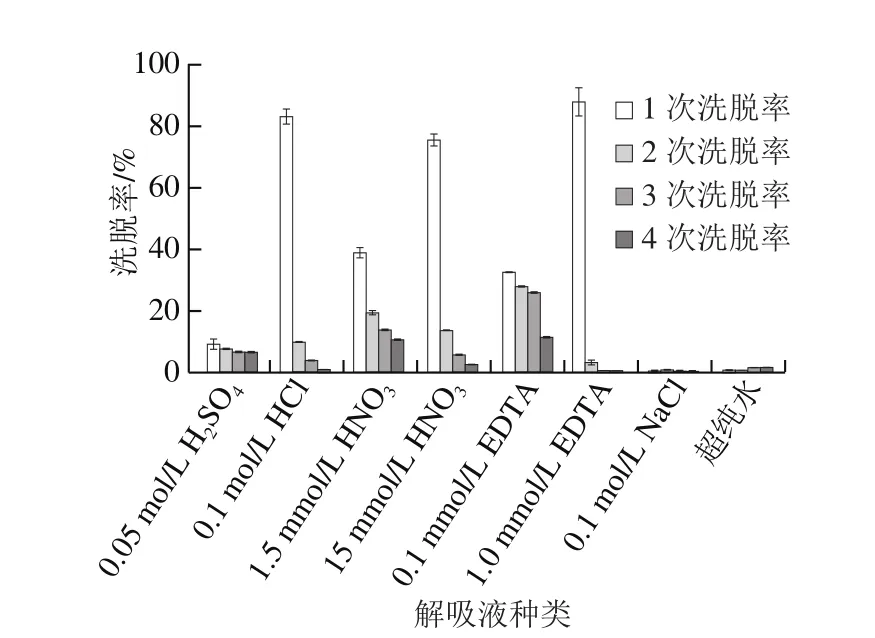
图7 QF-1-1吸附Pb2+后解吸附实验结果Fig. 7 Desorption of adsorbed Pb2+ from QF-1-1
由图7可知,8 种洗脱剂中超纯水和0.1 mol/L NaCl几乎无洗脱作用,0.1 mol/L HCl、15 mmol/L HNO3、1.0 mmol/L EDTA第1次洗脱率已达到80%以上,经4 次洗脱后,菌体内只有不到4.1%的Pb2+。1.5 mmol/L HNO3、0.05 mol/L H2SO4洗脱能力在8 种洗脱剂中居中。酸型解吸液中含有大量的H+,可竞争Pb2+结合位点,从而可使吸附的Pb2+解吸[37]。不同酸解吸效果不同,原因可能是Pb2+被解吸下来后与硝酸根结合形成易溶于水、溶于酸的PbNO3,与Cl-形成易溶于酸的PbCl2,而Pb2SO4只能溶于浓硫酸和碱性条件下微溶于水,因此,HNO3的解吸能力最好,HCl次之,H2SO4最差。而EDTA与金属离子螯合作用强,很容易将Pb2+从细胞表面解吸下来。Yeşim等[38]也证明HNO3是比CaCl2和蒸馏水更有效的洗脱剂,并且0.05 mol/L的硝酸可有效地解吸生物吸附的金属离子[3]。本研究结果与高雁斐[17]和Gunjal[19]等结论一致。但与Yin Ruijie等[16]对植物乳杆菌CCFM8661吸附Pb2+后的解吸情况稍有差异,植物乳杆菌CCFM8661对Pb2+总洗脱率小于QF-1-1。可以推测QF-1-1对Pb2+主要是胞外吸附,是铅离子与细胞表面的物质如羟基、羧基等官能团或者胞外分泌物发生的化学结合作用。
3 结 论
本研究结果揭示异常W. anomalusQF-1-1菌株体外吸附Pb2+的机理。首先考察了吸附条件对QF-1-1吸附Pb2+的影响,结果表明,当Pb2+溶液的初始pH 5.5、Pb2+溶液的初始质量浓度100 mg/L、菌体质量浓度11 g/L、吸附时间140 min时吸附效果较好,吸附量最大为7.29 mg/g,去除率为97.89%。基团掩蔽实验结果发现,羧基、氨基、磷酸基3 种基团在菌株QF-1-1吸附Pb2+过程中均发挥了重要的作用,贡献率为羧基>氨基>磷酸基。化学试剂处理实验结果表明,经碱处理后,菌株QF-1-1对Pb2+的去除率及吸附量均有所升高,但是差异不显著(P>0.05)。经酸处理后去除率及吸附量均大幅降低,差异极显著(P<0.01),表明电荷性质的改变对Pb2+吸附有重大的影响。QF-1-1对Pb2+吸附稳定性实验表明,0.1 mol/L HCl、15 mmol/L HNO3、1.0 mmol/L EDTA解吸能力最强,经4 次洗脱后进入菌体内的Pb2+小于4.1%。初步断定,QF-1-1对Pb2+的吸附机理主要是表面吸附。本研究初步阐明了异常威客汉姆酵母QF-1-1吸附Pb2+的作用过程,为此酵母菌能进一步应用于环境、食品、人体中去除Pb2+的应用提供一定的参考依据。
