包覆花色苷W1/O/W2型乳液的消化特性及其缓释效果
2020-06-01徐伟丽张玉琪朱元昊鲁兆新
徐伟丽,张玉琪,朱元昊,鲁兆新
(哈尔滨工业大学化工与化学学院,黑龙江 哈尔滨 150001)
花色苷(anthocyanins,ACNs)是一类水溶性色素,广泛分布于花卉、水果、蔬菜和谷物中[1]。自然界中主要的ACNs是黄酮基(2-苯基-苯并吡咯基)盐的多羟基糖苷和多乙氧基衍生物[2]。流行病学研究表明,ACNs对许多慢性疾病都有改善作用,如心血管疾病、糖尿病、关节炎和癌症等[3-4],特别是饮食和局部应用ACNs可有效抑制皮肤或胃肠道癌症[5-6]。ACNs的生物活性使其成为功能性食品中最有效的成分之一。然而,一旦ACNs与原始植物组织分离而不进行有效的保护则很难稳定下来。光照、温度、碱性条件以及氧气或酶的存在都对ACNs的稳定性和活性起着至关重要的作用[7-8]。此外,提取的ACNs经人体消化系统处理后其生物活性也会遭到破坏[9-10]。因此,探索一种稳定ACNs的有效封装技术对ACNs的商业应用具有重要的现实意义。
W1/O/W2型乳液已被证明是保护和控制亲水性生物活性化合物释放的最佳微胶囊技术之一,可通过将油包水(W1/O)单乳液在连续水相(W2)中分散而形成[11-12]。同时,体外消化模型作为一种了解胶囊组分理化变化和控制释放的工具,也引起了人们的广泛关注[13-14]。目前研究虽已表明,内水相、油相和乳化剂的理化性质都对经胃肠道消化的胶囊化生物活性成分的包封率、稳定性和释放起着至关重要的作用[15-18],但对W1/O/W2型乳液的微观结构变化研究较少。对于W1/O/W2型乳液从口腔到胃肠道的消化,尤其是小肠消化模型中有无脂肪酶的比较研究信息有限。此外,在负载ACNs的W1/O/W2双乳液系统中使用酪蛋白作为乳化剂的研究目前鲜见报道。因此,本研究主要目的是:1)以含有聚甘油-聚蓖麻酸酯(polyglycerol polyricinoleate,PGPR)的玉米油为油相,酪蛋白钠溶液为外水相,将葡萄皮粉中提取的ACNs包封在W1/O/W2型乳液中;2)分析双乳液的形态和贮存稳定性;3)表征体外模拟口腔、胃和肠道消化过程中富含ACNs乳液的微观结构、粒径、Zeta电位、靶向输送和抗氧化活性。该研究拟为食品和医药产品中通过W1/O/W2型微载体系统输送水溶性生物活性成分并对其进行控释提供理论支持和实验依据。
1 材料与方法
1.1 材料与试剂
玉米油 市售;葡萄皮粉 加拿大约瑟夫天然产品公司;牛乳酪蛋白钠盐、猪胰α-淀粉酶、猪胃蛋白酶、猪胰酶、脂肪酶、猪胆盐、6-羟基-2,5,7,8-四甲基色满-2-羧酸(Trolox)、2,2’-偶氮二(2-甲基丙基咪)二盐酸盐、1,1-二苯-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、L-抗坏血酸、荧光素、苯甲基磺酰氟美国Sigma Aldrich公司;飞燕草素、矢车菊素、天竺葵色素、锦葵花素 美国Indofine Chemical公司;盐酸、柠檬酸、苯甲酸钠 加拿大Sigma Scientific公司;PGPR(4175) 美国Palsgaard公司;氯化钠、甲醇、异丙醇、甲酸、己烷、乙醇 加拿大Caledon实验室。
1.2 仪器与设备
微流化器 加拿大ATS公司;Polytron PT 2500 E匀浆器 瑞士Kinematica AG公司;Amicon-Ultra 15-离心过滤装置 德国Millipore公司;光学显微镜、AxioCam MRC5照相机 德国Zeiss公司;Zetasizer激光粒度仪英国Malvern仪器公司;ARES-LS1流变仪 美国TA仪器公司;UV微板读数器 美国Bio-Tek仪器公司。
1.3 方法
1.3.1 酪蛋白溶液和葡萄皮提取物的制备
将酪蛋白钠粉末溶于去离子水中,溶液质量分数2.5%,搅拌约2 h,4 ℃贮存过夜以完全水合。葡萄皮提取物的制备参考文献[18]。
1.3.2 W1/O/W2型乳液的制备
方法参考文献[18]。将30 g葡萄皮提取物逐滴添加到70 g油相(包括66 g玉米油和4 g PGPR)中,于10 000 r/min均质10 min以制备W1/O初乳。将W1/O初乳(20 g)加入到80 g外水相溶液中,6 000 r/min均质5 min。然后,将其在500 bar的压力下通过微流化器以获得W1/O/W2复乳。
1.3.3 模拟体外消化
方法参考文献[18]。将2 mL蒸馏水加入到2 mL消化物中,涡旋混合。于Amicon-Ultra 15-离心过滤装置中,6 000 r/min离心30 min,收集滤液用于分析和测定。无样品的消化液用作对照。
1.3.4 显微镜观察
参考文献[18]方法。在100 倍油浸物镜下观测乳液的微观结构。
1.3.5 乳状液的稳定性
将收集的不同消化步骤的乳状液转移到试管中,用塑料盖密封,并在25 ℃保存24 h。数码相机拍摄乳状液的照片。
1.3.6 粒径和Zata电位的测定
方法参考文献[19]。将消化后的乳液收集到试管中,并用双蒸水稀释至质量分数0.5%。在25 ℃条件下用Zetasizer测量稀释后乳液的Zata电位和粒径。
1.3.7 凝胶电泳
用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测各种消化条件下蛋白质的变化[20]。
1.3.8 高效液相色谱(high performance liquid chromatography,HPLC)法检测ACNs
参考文献[18]方法。在520 nm波长处定量外标(即氯化飞燕草素、氯化矢车菊素、氯化天竺葵素和氯化锦葵色素),并基于峰面积建立校准曲线。
1.3.9 ACNs从W1/O/W2型乳液中的释放
参考文献[18]方法。使用2 mL双蒸水稀释2 mL W1/O/W2乳液,并使用Amicon-Ultra 15-离心过滤装置以6 000 r/min离心30 min。收集滤液用于HPLC分析以评估ACNs的包埋率。
1.3.10 抗氧化活性评价
参考文献[17,21-22]方法。在517 nm波长处,通过分光光度法测定样品对DPPH自由基清除率;采用485 nm激发波长和528 nm发射波长,测定提取物的氧自由基吸收能力(oxygen radical absorbance capacity,ORAC),结果表示为Trolox当量(μmol);使用可见UV微板读数器在593 nm波长处读取吸光度测定铁还原能力(ferric ion reducing antioxidant power,FRAP),结果表示为抗坏血酸当量(μmol/L)。
1.4 统计分析
数据为3 次独立实验结果的 ±s,采用单因素方差分析比较均值。所有统计分析均使用SPSS 14.0进行。
2 结果与分析
2.1 W1/O/W2型乳液的形态及贮存稳定性
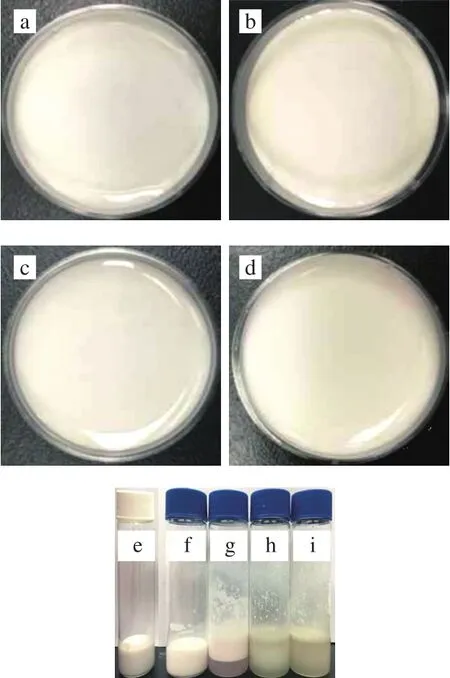
图1 W1/O/W2型乳液的照片Fig. 1 Photographs of W1/O/W2 emulsions
采用W1/O/W2型乳液包封ACNs提取物,并对其形态和稳定性进行评价。图1a~d表明,W1/O/W2型乳液均匀,表面光滑,未见气孔或裂纹。显微镜分析显示,许多小液滴位于大液滴的内部(图2a),根据Florence和Whitehill分类显示该乳液是B型W1/O/W2多重乳液[23]。乳液在4 ℃保存8 周后仍均匀,无明显的絮凝、聚结现象(图1b~d),液滴呈球形并均匀分散在系统中(图2f)。贮藏后,Zata电位为(59.53±0.74)mV,与新鲜乳液(58.20±1.04)mV相比无明显变化,说明W1/O/W2型乳液具有良好的稳定性。经体外胃肠消化并在4 ℃贮存24 h后,W1/O/W2型乳液出现明显的相分离现象(图1g~i),表明乳液由于脂滴的聚集而变得不稳定。
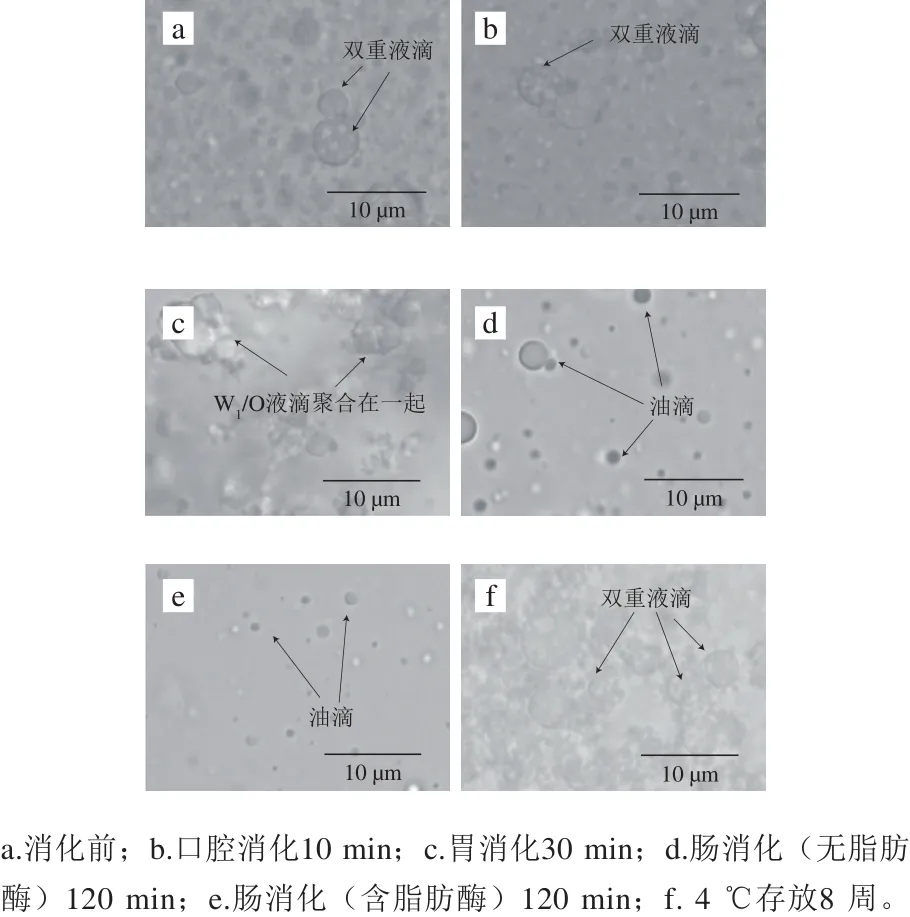
图2 W1/O/W2型乳液体外消化模型的显微照片(×100)Fig. 2 Photomicrographs of W1/O/W2 emulsions after in vitro digestion (× 100)
2.2 体外模拟消化对W1/O/W2型乳液微观结构的影响
利用显微镜(图2)和激光衍射(图3、4)评估体外消化不同阶段W1/O/W2型乳液微观结构变化。初始W1/O/W2型乳液平均粒径为(149.33±1.44)nm(PDI=0.190±0.024),呈双峰尺寸分布,粒径尺寸分布在100~900 nm和3 500~6 500 nm范围内。口腔消化(第I阶段)后,粒径大小保持不变(d=(142.50±3.19) nm),粒径尺寸分布在90~1 300 nm和2 600~6 500 nm范围内(图4),表明α-淀粉酶不影响乳液的微观结构。胃消化(第II阶段)后,乳液平均粒径显著增加(P<0.01),这可能归因于胃蛋白酶对乳化蛋白的消化。在胃消化过程中双乳液液滴结构塌陷导致W1/O液滴释放并聚集在一起(图2c),这可能是相分离的主要原因(图1g)。然而,Frank[24]、Giroux[25]和Shima[26]等的研究表明双乳液在人工胃孵育期间是稳定的。此外,Xiao Jie等[27]发现双乳液结构在胃消化过程中塌陷并释放大部分内部水相。上述研究结果的不一致与乳化剂或模拟胃条件(如pH值、离子浓度等)的差异有关。
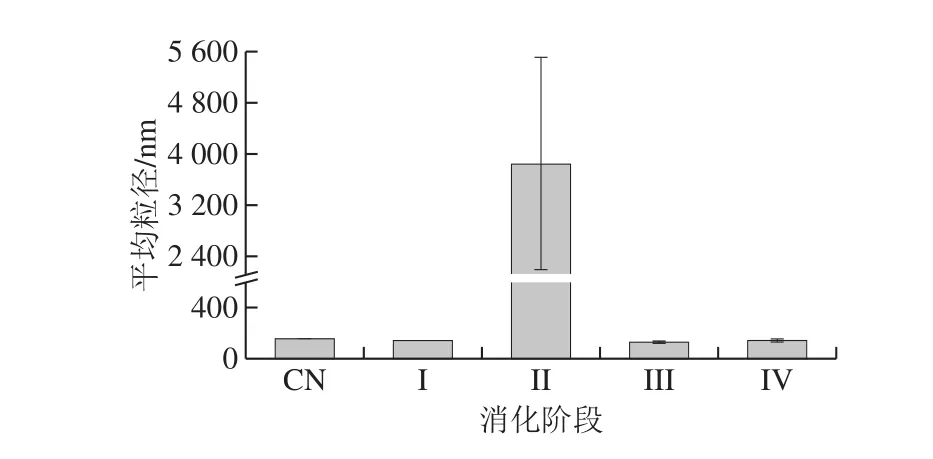
图3 W1/O/W2型乳液在不同体外消化阶段的平均粒径Fig. 3 Mean particle diameters of W1/O/W2 double emulsion droplets in different in vitro digestion phases
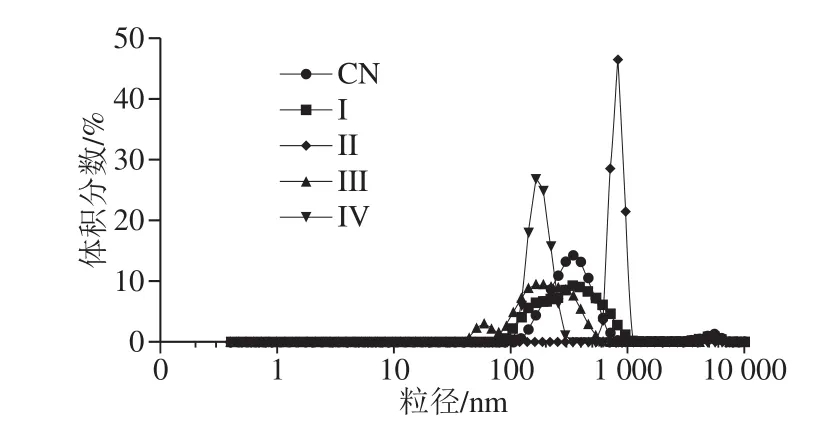
图4 W1/O/W2型乳液体外消化前后的粒径分布Fig. 4 Particle size distribution of W1/O/W2 double emulsions containing ACNs before and after in vitro digestion
当乳液从模拟胃进入到肠道消化后,平均粒径(第III阶段d=(130.27±5.57)nm,粒径范围在40~650 nm和4 800~6 500 nm之间;第IV阶段d=(141.17±8.48)nm)显著降低(P<0.05)(图2d、e和图3、4)。这可能是由于在胰酶或/和脂肪酶的作用下,W1/O液滴被破坏,内部水相被释放,油相经胆盐进一步乳化形成更小的油滴所致(图2d、e),这与Frank[24]和Shima[26]等的结果一致。
2.3 体外模拟消化对W1/O/W2型乳液Zeta电位的影响
研究监测了体外消化不同阶段乳液电荷(即Zeta电位)的变化情况。结果表明所有乳液样品均具有负Zeta电位。最初的乳液(pH 6.6~6.8)呈现出较强的负电位((-58.20±1.04)mV),这主要取决于外部乳化剂(图5)。模拟口腔消化(pH 6.6~6.8)后乳液的Zeta电位降至(-50.93±0.84)mV,而胃消化(pH 2.0)后乳液Zeta电位的绝对值最小((-4.36±0.16)mV)。其他研究也报道了在模拟胃液中蛋白质包裹脂滴的Zeta电位的类似结果[19,28-29]。β-酪蛋白容易形成交联界面层[30],但在模拟胃消化过程中,在酶和酸作用下容易降解,解释了液滴的表面层被部分破坏的原因。而Zeta电位绝对值越小,表明液滴表面所携带的电荷越少,液滴越容易聚集在一起,这是胃消化后乳液平均粒径显著增加的原因之一。

图5 体外消化后封装ACNs的W1/O/W2型乳液的Zeta电位Fig. 5 Zeta potential of W1/O/W2 double emulsions containing ACNs after in vitro digestion
当乳液在模拟小肠条件下(pH 6.8)处理时,Zeta电位的绝对值(III期为(59.53±0.26)mV,IV期为(67.50±0.65)mV)甚至高于原乳液。乳液电荷的变化可归因于:1)溶液的酸碱度和离子强度的变化;2)消化液中的带电颗粒吸附到乳化剂层上[19,28-29]。此外,本研究中测试的乳液在体外胃和肠道消化过程中比具有相似乳化剂和油相的乳状液携带更多的负电荷[31]。这可能与消化液的成分和酸碱度、油相的成分以及乳液中内部水相的存在有关。
2.4 体外消化对W1/O/W2型乳液表面蛋白的作用
如图6所示,经α-淀粉酶水解后,蛋白条带与原双乳液相比保持不变(图6I)。胃消化30 min后,蛋白条带消失,并观察到一些分子质量较低的微弱肽带(图6II),这与Andrade等[22]研究结果一致。乳液经胃消化后进入肠道消化2 h,肽段进一步水解形成较小的胰蛋白酶抗性肽(图6III、IV)。第III、IV阶段之间的肽带没有差异。SDS-PAGE也证实经模拟胃肠消化后,W1/O/W2型乳液的双层结构已被破坏。

图6 模拟体外消化后酪蛋白稳定双乳液的SDS-PAGE图谱Fig. 6 Reducing tricine SDS-PAGE patterns of casein-stabilized double emulsions after in vitro simulated digestion
2.5 体外消化对W1/O/W2乳液ACNs释放的影响
如图7所示,W1/O/W2型乳液ACNs包封率为(82.99±2.38)%。经口腔消化后,ACNs仍保留在双乳液的内相里,证明α-淀粉酶对乳液的微观结构没有破坏作用。相比口腔消化,胃消化后ACNs释放率(约12%)显著升高(P<0.05)。这可能是酶消化过程中,W1/O液滴释放到外部水相并与周围水相扩散或聚结所致[24,32-34]。Shima等[26]的研究表明双乳液不受人工无酶胃液影响,包封率不变。以上结果证实添加胃蛋白酶(或其他相关酶)会破坏乳液结构,随后导致ACNs的部分释放。Frank[24]、Oidtmann[35]以及Flores[36]等也报道了类似发现。然而,Xiao Jie[27]、Andrade[22]等的研究结果显示W1/O/W2型乳液的内水相(W1)由于液滴结构的崩溃而主要在胃消化阶段释放。

图7 W1/O/W2型乳液中ACNs的封装效率Fig. 7 Encapsulation efficiency of ACNs into W1/O/W2 double emulsions
本研究表明乳液经肠道消化后ACNs释放率达到最大(第III阶段为(39.87±4.57)%,第IV阶段为(43.89±3.84)%)。主要原因可能是经胰蛋白酶或/和脂肪酶消化后W1/O液滴的油层被水解导致释放出ACNs。本实验结果与Frank[24]、Flores[37]、Gir o u x[25]和S him a[26]等研究结果一致。相以,Aditya等[38]报道体外无酶肠道消化1 h内,超过45%的姜黄素从W1/O/W2型乳液中释放。这种差异可能与人工消化液的化学成分、封装方法、壁材类型或内部水相的理化性质有关[22]。值得注意的是,HPLC法测定的ACNs释放率可能低于实际值。其原因可能是:1)ACNs与肽的相互作用[39];2)释放的ACNs在小肠条件下不稳定,降解速度更快[40]。
2.6 体外消化对W1/O/W2型乳液抗氧化活性的影响
如图8所示,经口腔消化后,乳液的DPPH自由基清除率、ORAC和FRAP值无明显变化,而在体外胃肠消化后,其抗氧化活性显著提高(P<0.05)。胃消化后仍有(70.53±5.31)%的ACNs滞留在油滴中。然而,与原乳液和经口腔消化后的乳液相比,此时的乳液具有更高的抗氧化活性(P<0.05)。其主要原因可能是由于ACNs分子具有亲水性,使得其很容易扩散到亲水性介质中[38]。此外,胃肠酶水解酪蛋白产生的抗氧化肽可能也会增加乳液的抗氧化活性[41]。经胰酶或脂肪酶模拟肠道消化后,抗氧化活性最高,这可以用乳液释放出最高量的ACNs解释。Ydjedd等[42]的研究结果也表明在肠道消化过程中,从乳液中释放出的酚类和类黄酮含量最高。本实验结果与Flores[36-37]、Betz[43]和Oidtmann[35]等研究结果一致,表明微胶囊能够在模拟胃肠消化过程中稳定ACNs并维持高抗氧化活性。相以,Cofrades等[44]研究表明,由于生物活性化合物的损失,体外胃肠消化显著降低了双乳液和凝胶双乳液的抗氧化活性。
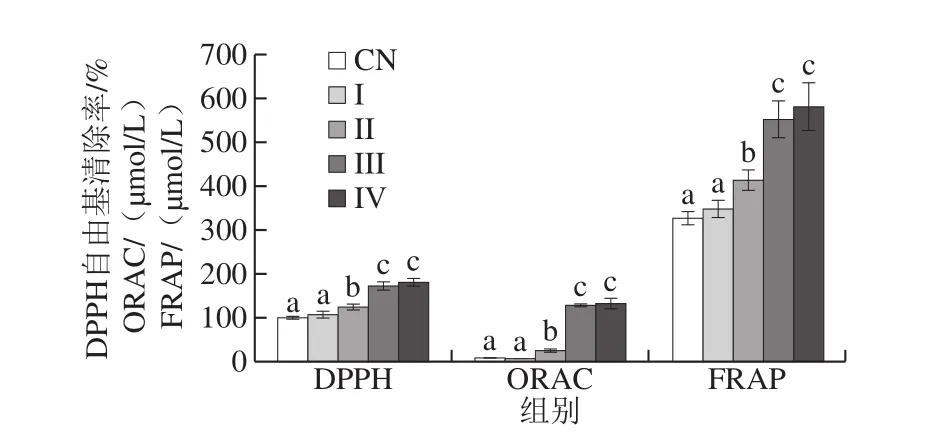
图8 采用DPPH、ORAC和FRAP法测定封装ACNs的W1/O/W2型乳液体外消化前后的抗氧化活性Fig. 8 Antioxidant activities of W1/O/W2 micro-emulsions containing ACNs evaluated by DPPH, ORAC and FRAP assays before and after in vitro digestion
3 结 论
本研究以W1/O/W2型乳液封装ACNs提取物,该体系具有较高的包封率(82.99±2.38)%和较好的贮存稳定性。原W1/O/W2型乳液的平均粒径为(149.33±1.44)nm,经口腔消化后,平均粒径保持不变。与其他体外消化阶段相比,胃消化后乳液的平均粒径显著增加(P<0.05),所带电荷量最低(Zeta电位为(-4.36±0.16)mV)。模拟肠道消化后平均粒径显著减小(P<0.05),Zeta电位绝对值为(-67.50±0.65)mV达最高。显微结构图片、SDS-PAGE、包埋率和抗氧化活性的结果证实,模拟胃消化可以破坏双乳液的双层结构,释放出较小的W1/O液滴并聚集在一起形成较大的颗粒,ACNs主要保留在W1相中。在肠道消化过程中(第III、IV阶段),油相水解进一步破坏了W1/O液滴的结构,检测到ACNs最高释放量和抗氧化活性。结果显示W1/O/W2型乳液可以有效地保护ACNs免受模拟口腔和胃消化的影响,证明它是控制食品和医药产品中生物活性化合物释放的有应用潜力的微型载体系统。
