组蛋白乙酰化酶对牙周膜干细胞内质网应激激活的调控研究*
2020-05-27贾婷婷张贤华
薛 芃 胡 楠 白 阳 蔡 川 贾婷婷 张贤华
慢性牙周炎发病机制和发展过程复杂。在慢性牙周炎长期炎症微环境下,其内质网应激(endoplasmic reticulum stress,ERs)激活,未折叠蛋白反应(unfolded protein response,UPR)相关因子持续高表达,正常来源牙周膜干细胞(healthy periodontal ligament stem cells,H-PDLSCs)成骨分化能力持续降低。前期研究结果发现,短期炎症微环境可导致ERs 和UPR 一过性升高[1,2]。因而猜想,长期和短期炎症微环境对ERs 和UPR 的激活作用不同,可能是在长期炎症微环境使细胞发生了转录水平或者转录后水平的调控。组蛋白乙酰化酶(histone acetyltransferases,HATs)可以在炎症微环境影响下改变PDLSCs 转录后调控功能[3-5];HATs 还可影响ERs 表达[6-8]和干细胞分化功能[9,10]。因此,本研究通过筛选HATs 在炎症微环境来源的PDLSCs(periodontitis periodontal ligament stem cells,P-PDLSCs)中的表达,继而深入探究通过HATs 影响PDLSCs 中内质网应激持续性激活的可能作用机制。
1.材料和方法
1.1 主要仪器 YJ-875 型超净工作台(苏州净化设备厂);二氧化碳恒温培养箱(Thermo,美国);6 孔板、平底96 孔板、底面积为25cm2培养瓶(Falcon,美国);体式显微镜、倒置相差显微镜及照相系统(Olympus,日本);透射电镜(FEI,美国);CFX96 实时荧光定量PCR 仪(Bio-Rad,美国);酶联免疫检测仪(Thermo,美国);紫外线分光光度仪(Eppendorf,德国)。
1.2 主要实验试剂 α-最低必需培养基(alphaminimum essential medium,α-MEM)、双抗磷酸盐缓冲液(phosphate buffered solution,PBS)、L-谷氨酰胺、青霉素及链霉素(Gibco,美国);胎牛血清(浙江天杭生物科技股份有限公司);胰蛋白酶(Amresco,美国);Ⅰ型胶原酶、维生素C、地塞米松、β-甘油磷酸钠(Sigma,美国);TRIzol Reagent(Invitrogen,美国);实时定量PCR 试剂盒及cDNA 反转录试剂盒(Takara,日本)。
1.3 样本收集与细胞分离培养 人正常来源牙周膜干细胞(H-PDLSCs):收集解放军总医院第一医学中心口腔颌面外科门诊30 至45 岁患者因正畸需要拔除、无龋的健康前磨牙或第三磨牙;人炎症来源牙周膜干细胞(P-PDLSCs):收集解放军总医院第一医学中心口腔颌面外科门诊30 至45 岁患者因牙周炎需要拔除的牙齿。本项研究时间为2018年1 月至2018 年12 月。研究经解放军总医院伦理委员会批准,所有受试者均签署了知情同意书。牙齿拔除后用含双抗(青、链霉素)的PBS 液反复冲洗,用锐利刀片剥离牙根表面的牙周膜组织,剪成1mm3小块接种于6 孔培养板内。每3 天换液1 次,待细胞从组织块边缘爬出并生长达80%汇合即原代牙周膜细胞;取原代牙周膜细胞,调整细胞密度至10~15 个/ml 接种于96 孔板(每孔0.1ml),37℃、CO2孵箱培养24h,标记单细胞孔后继续培养;待形成克隆并达孔底面积1/3~1/2 时,胰酶消化,将多单克隆来源细胞悬液混合,体外扩增继续培养。取第3 至5 代进行实验。
1.4 实时定量PCR 检测HATs 在P-PDLSCs中表达 经上述方法传代的第4 代P-PDLSC 消化、离心收集后,将细胞密度调整至2×105个/ml,接种至6 孔板,24h 后终止培养;采用Trizol 试剂提取细胞总RNA,测定RNA 样品浓度(A260/A280≥1.8);反转录合成cDNA,观察HATs 相关基因的表达情况,PCR 引物序列见表1。本项研究所用引物序列由Primer Premier 5.0 设计,上海生工生物工程技术有限公司合成。取1.0μl 反转录合成的cDNA 在10μl 反应体系中进行实时PCR扩增。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 作为内参,通过2-ΔΔCt(ΔCt=Ct目的基因-Ctβ-GAPDH,ΔΔCt=ΔCt目的基因-ΔCt对照,Ct 为循环次数)法检测各基因mRNA 相对表达量。每例样品及阴性对照均设3 个平行复孔,取均值。
1.5 小干扰RNA(Small interfering RNA,siRNA)的转染
1.5.1 转染方法 5μl Lipofectamine 2000 溶于250μl 无血清无双抗α-MEM 培养液制成A 液,室温孵育5min;5μl siRNA 溶于250μl 无血清无双抗α-MEM 培养液制成B 液;将A 液和B 液混合,室温放置20min。吸取细胞培养液,用无血清无双抗α-MEM 培养液清洗细胞一次,将1000μl 无血清无双抗α-MEM 培养液加入A 液和B 液的混合液,混匀后加入细胞培养板;转染6h 后,倒去含有转染混合物的培养基,PBS 清洗,每孔加入细胞培养液2ml,继续培养。
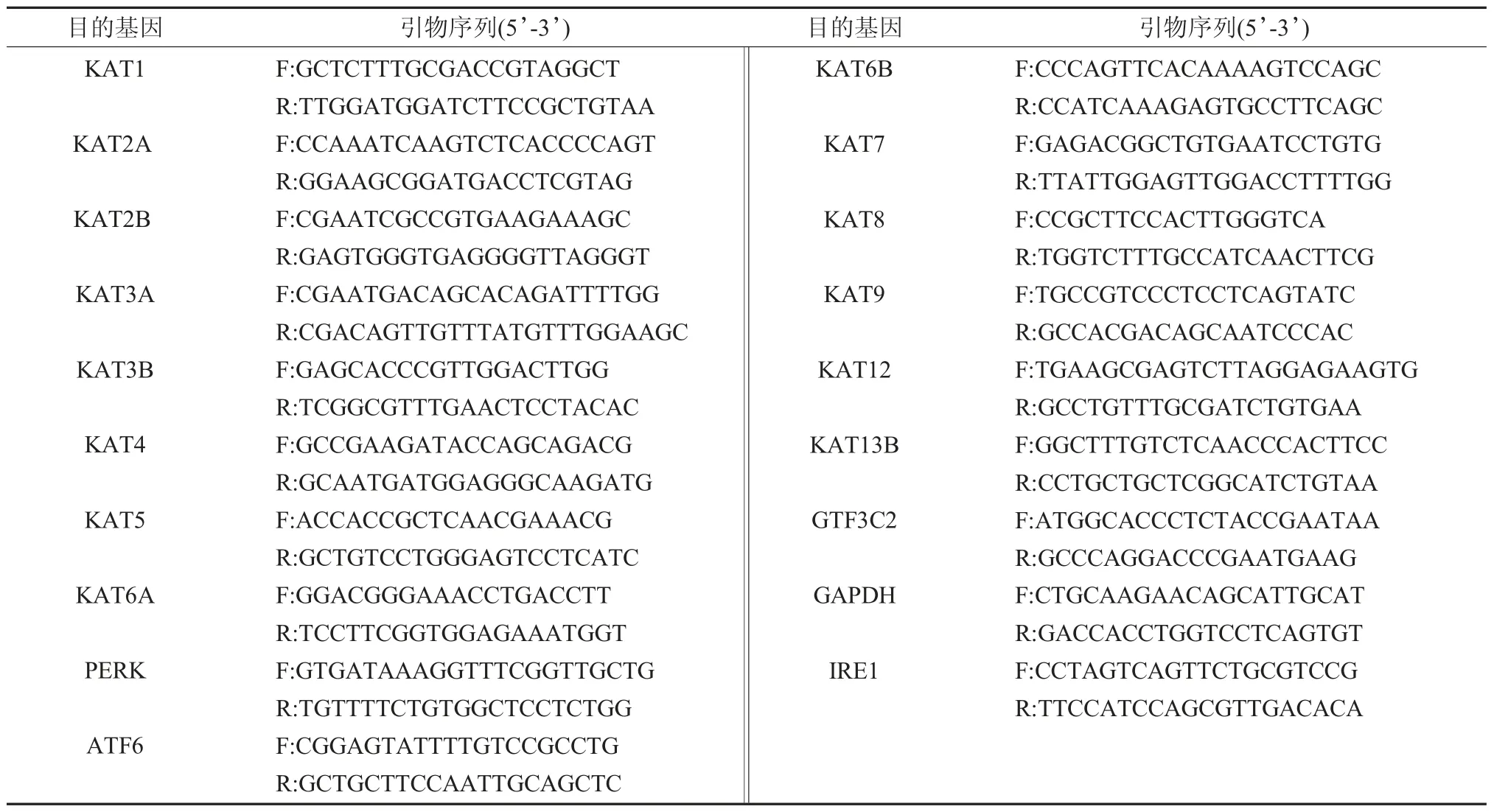
表1 本实验所用实时定量PCR目的基因引物序列及长度
1.5.2 转染效率检测 转染24h 后提取RNA,利用实时定量PCR 技术检测siRNA 干扰效率在mRNA 水平的表达。每个转染样品设置三个复孔。
1.5.3 siKAT2A、siKAT3B、siKAT6A 和siKAT6B 后UPR 信号分子表达检测 对H-PDLSCs进行siKAT2A、siKAT3B、siKAT6A 和siKAT6B转染,以正常H-PDLSCs 为对照组。转染24h 后提取RNA,利用实时定量PCR 技术检测UPR 信号分子(PERK、IRE1、ATF6)mRNA 的相对表达量,PCR 引物序列见表1。
1.6 透射电镜观察siKAT6B 后H-PDLSCs中内质网形态变化H-PDLSCs 以2~3×107个/孔接种于六孔板24h 后,使用胰酶常规消化,800rpm 离心5min,弃上清,将PBS 冲洗后的样品移入1.5 ml Ep 管,800rpm 离心5min,4℃固定12h,在室温下进行脱水、渗透、聚合、切片,使用3%的醋酸铀(30min)、枸橼酸铅(10min)双染。透射电镜观察细胞内质网形态和大小,评估内质网形态的变化。
1.7 统计学方法 采用SPSS 17.0 统计软件对结果数据行统计学分析,计量资料采用均数±标准差()表示,两组间比较采用独立样本t 检验;以双侧P<0.05 为差异有统计学意义。
2.结果
2.1 筛选4 个HATs 在P-PDLSCs 中的表达变化 有限稀释法克隆化培养PDLSCs 的鉴定见课题组之前已发表文章[1,11,12]。首先筛选了文献报道与炎症发生发展有密切关系,同时与内质网应激相关联的HATs,见表2。结果显示,与对照组比较,KAT2A、KAT3B、KAT6A 和KAT6B 4 个HATs在P-PDLSCs 中表达显著降低,差异具有统计学意义(P<0.05)。
2.2 低表达KAT6B 可以激活UPR 中PERK通路 成功证明KAT2A siRNA、KAT3B siRNA和KAT6A siRNA、KAT6B siRNA 沉默有效,表3。同时,KAT6B siRNA 可以引起UPR 中PERK 信号分子mRNA 相对表达量的升高,而对其他UPR信号分子表达无明显作用;而其他三个HATs siRNA 的使用并没有使UPR 信号分子mRNA 的表达量升高,表4。
表2 HATs 在P-PDLSCs mRNA 相对表达量()
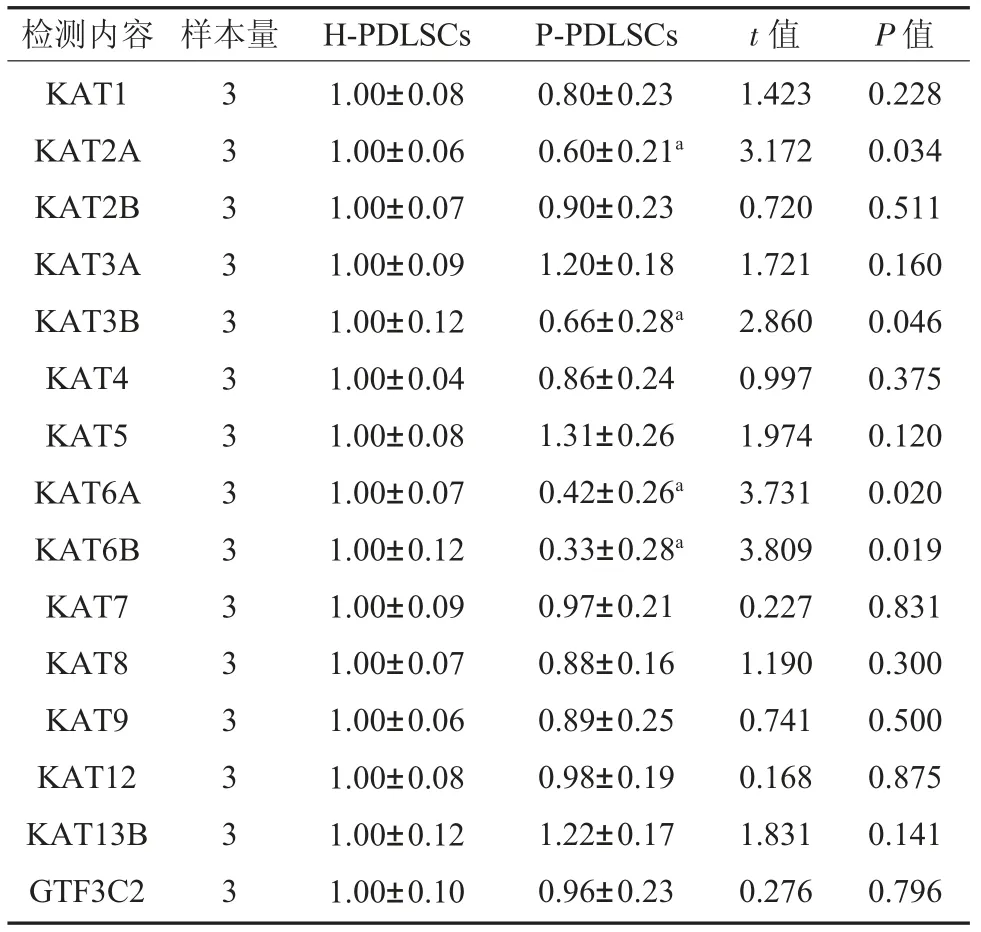
表2 HATs 在P-PDLSCs mRNA 相对表达量()
注:对照组:正常来源牙周膜干细胞;P-PDLSCs:炎症来源牙周膜干细胞;KAT1、KAT2A、KAT2B、KAT9 为组蛋白乙酰转移酶Gcn5/PCAF 家族成员;KAT5、KAT6A、KAT6B、KAT7、KAT8 为组蛋白乙酰转移酶MYST 家族成员;KAT3A、KAT3B 为组蛋白乙酰转移酶p300/CBP 家族成员;KAT4 为组蛋白乙酰转移酶TAF 家族成员;KAT12、KAT13B、GTF3C2 为组蛋白乙酰转移酶核受体共激活因子家族成员;a 表示与对照组相比P<0.05。
表3 4 个HATs siRNA mRNA 相对表达量()
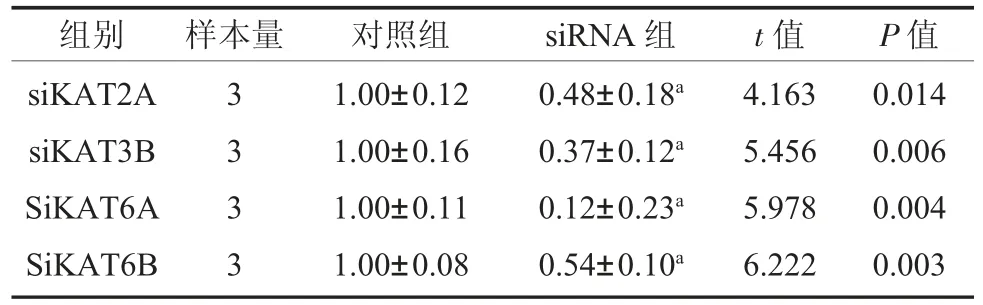
表3 4 个HATs siRNA mRNA 相对表达量()
注:对照组:正常来源牙周膜干细胞;KAT2A 为组蛋白乙酰转移酶Gcn5/PCAF 家族成员;KAT3B 为组蛋白乙酰转移酶p300/CBP家族成员;KAT6A、KAT6B 为组蛋白乙酰转移酶MYST 家族成员;a 表示与对照组相比P<0.05。
2.3 低表达KAT6B 后H-PDLSCs 中内质网形态变化 我们利用透射电镜技术观察在H-PDLSCs中使用KAT6B siRNA 后内质网形态的变化。结果显示,使用KAT6B siRNA 后,其内质网管腔呈现异常扩张和肿胀,且粗面内质网核糖体数量降低,图1。
表4 4 个HATs siRNA 对UPR关键信号分子作用mRNA 相对表达量()
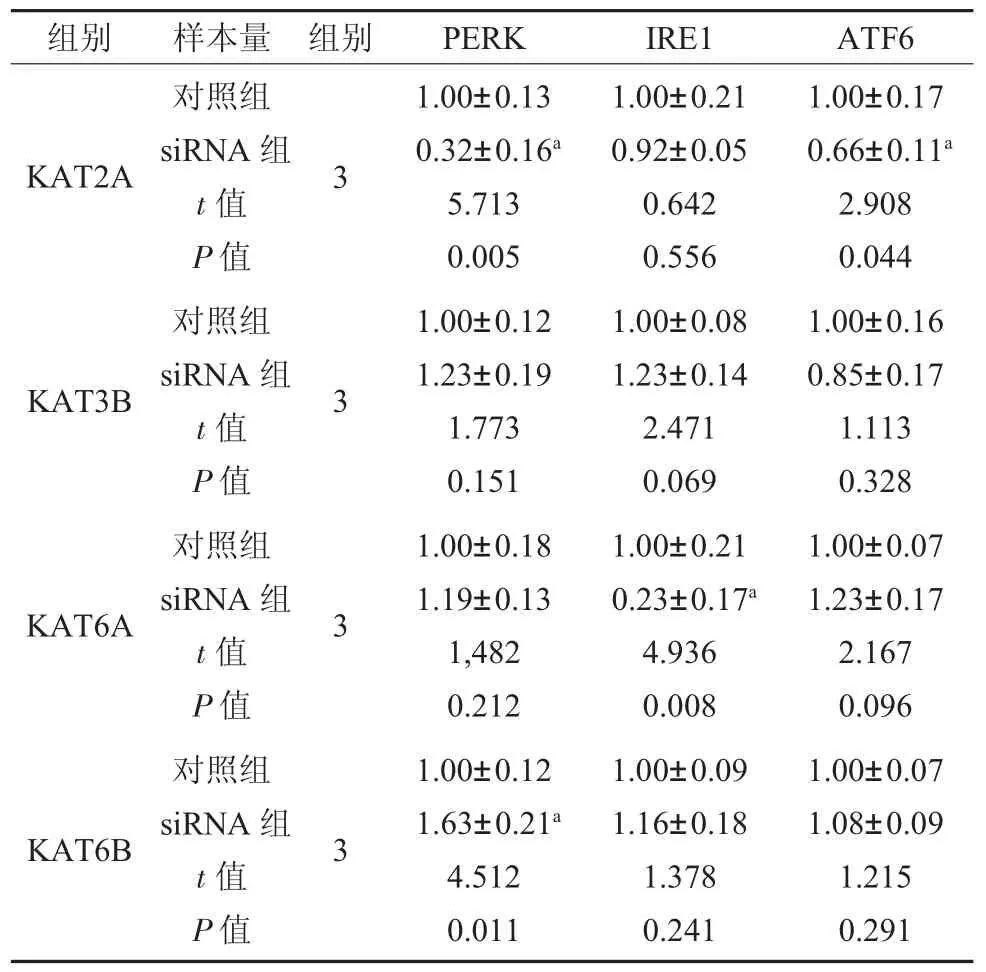
表4 4 个HATs siRNA 对UPR关键信号分子作用mRNA 相对表达量()
注:对照组:正常来源牙周膜干细胞;KAT2A 为组蛋白乙酰转移酶Gcn5/PCAF 家族成员;KAT3B 为组蛋白乙酰转移酶p300/CBP家族成员;KAT6A、KAT6B 为组蛋白乙酰转移酶MYST 家族成员;PERK 为蛋白激酶受体样内质网激酶;IRE1 为肌醇需要酶1;ATF6 为活化转录因子6;a 表示与对照组相比P<0.05。
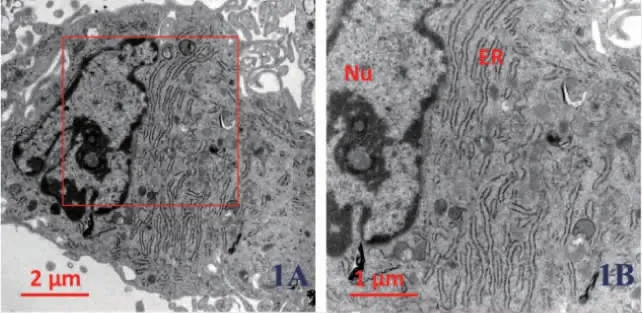
图1 正常牙周膜干细胞(H-PDLSCs)内质网形态的透射电镜观察
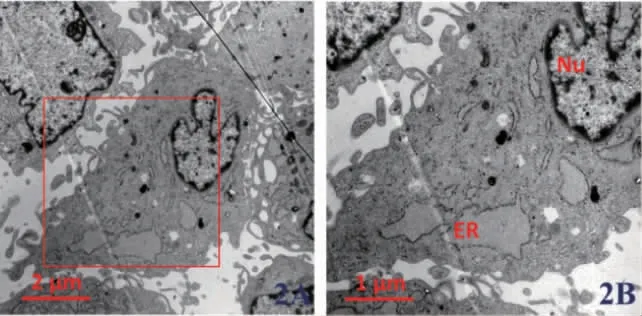
图2 低表达KAT6B 后正常牙周膜干细胞(H-PDLSCs)内质网形态的透射电镜观察
3.讨论
慢性牙周炎是以细菌感染为主的多因素进展性疾病,在其临床表现中,以牙槽骨丧失最为严重[13]。近年来越来越多的研究表明,细胞在受到缺血、低糖、低氧和感染等外界刺激时,其蛋白折叠和降解等程序将受到干扰,产生ERs,为了适应这种应激反应,细胞通过UPR 对细胞进行保护和调节。UPR是一个复杂和协调并存的细胞应答反应,它通过内质网的三种跨膜受体完成调控:蛋白激酶样内质网激酶(Protein kinase receptor like ER kinase,PERK)、转录激活因子6(Activating transcription factor 6,ATF6)和肌醇需要酶1(Inositol requiring enzyme1,IRE1)、也称作ERN1。细胞处于静息状态下,三种内质网跨膜蛋白与GRP78 稳定结合,保持非活性状态;细胞处于应激状态下,非折叠蛋白积聚,三种跨膜蛋白与GRP78 的解离,产生UPR。因此,UPR 的目的是减少非折叠蛋白的积压以及恢复内质网正常功能,使细胞正常存活[14]。如果应激不能有效缓解,这个保护性的信号通路就会转向促凋亡反应。本课题组首次发现ERs 在炎症来源的PDLSCs 中表达激活,且可通过UPR 的PERK 通路导致PDLSCs 成骨分化下降,证明炎症微环境下ERs 的产生是调控干细胞成骨分化的重要原因[1,2]。但炎症微环境下ERs 激活后如何持续影响炎症的进程尚不清楚。
近年来越来越多研究表明,慢性牙周炎与表观遗传修饰有关。表观遗传主要包括DNA 甲基化、微小RNA(micro RNA,mi RNA)修饰、组蛋白乙酰化和长链非编码RNA(long noncoding RNA,lnc RNA)修饰等[15]。组蛋白乙酰化属于表观遗传修饰其中一种,当组蛋白结构发生改变,影响基因转录。目前表观遗传与牙周炎的发生在组蛋白乙酰化领域的研究较为表浅,因此,本实验首先通过对比正常及牙周炎症来源的PDLSCs 中HATs 的表达水平,发现与H-PDLSCs 相比,P-PDLSCs 中KAT2A、KAT3B、KAT6A 和KAT6B 四个基因表达出现显著下降。此研究表明,HATs 与牙周炎发生发展具有明显相关,炎症微环境可以引起4 个HATs 的低表达。
为进一步明确筛选出的4 个低表达的HATs和内质网应激的激活的关系,我们利用siRNA 分别对4 个HATs 进行抑制,同时检测UPR 信号分子(PERK、IRE1、ATF6)mRNA 相对表达量。我们发现,只有低表达KAT6B 后可以导致PDLSCs中UPR 信号分子激活,而其他3 个HATs 低表达后,不能引起UPR 激活。同时,我们使用透射电镜直观观察到siKAT6B 后,内质网腔扩张,作为ERs 和UPR 被激活的标志[16]。这些实验结果显示,KAT6B 在对内质网应激和UPR 的激活中发挥了重要作用。
KAT6B 属于组蛋白乙酰转移家族中MYST 家族的成员,它结构包括NEMM(N 端Enok)结构域,1 段催化MYST 模块,2 段串联的锌指结构(Plant homeodomain,PHD)和1 段富含谷氨酸盐/天冬氨酸盐(Glutamate/aspartate-rich,ED)结构域和富含丝/蛋氨酸(Serine/methionine,SM)结构域[17-19]。KAT6B 的MYST 结构域具有乙酰化活性,可以乙酰化组蛋白H3 的赖氨酸9 和14;KAT6B的C 端结构域是富含SM 的酸性区域,它们存在潜在的转录激活活性,但对于这一区域的功能相应的报道较少。比如,KAT6B 与DNA 不直接结合,它们作为DNA 结合的转录激活因子的共调解因子存在[17];还有研究表明,KAT6B 可以介导RUNX转录因子的激活[17,20,21]。
综上所述,本项研究结果显示,牙周炎症微环境可以导致组蛋白乙酰化酶KAT6B 降低,同时导致ERs 和UPR 激活,但KAT6B 对UPR 持续激活的具体机制尚待深入研究。
