新型唾液生物标记物在口腔癌检测的研究进展
2020-05-27李惠芳
李惠芳 张 芳
口腔和口咽癌位居全身恶性肿瘤第6 位,90%以上为鳞状细胞癌[1]。就医意识弱,临床存在误诊、不当治疗等,患者确诊时已处于晚期。研究显示,OSCC 在T1 阶段确诊、治疗,5 年生存率为80%以上;晚期确诊,仅20%~30%[2];OSCC、口腔白斑高危人群的筛查可早期发现OSCC[3]。因此,口腔癌的早期诊断,特别在T1 阶段,甚至与口腔癌前病变区分,具有重要意义[2]。
口腔癌确诊“金标准”为病理学检查,有创且依赖专业人员。唾液包含较多反映机体病理、生理状态的生物学信息,收集方便无创,多次可靠,唾液组学在全身疾病的研究得到广泛关注[4]。过去20年,学者们已发现100 余种口腔癌唾液潜在标记物[5],转录组学和蛋白质组学标虽表现出较好预测值,但标记物联合运用,曲线下面积(Area Under Curve,AUC)仍未达0.90 理想水平[6]。
近五年,新的唾液标记物被发现,已知标记物的研究进一步深入,唾液蛋白组学、代谢组学库被建立、完善,新型唾液标记物较传统标记物体现出以下优势:(1)唾液标记物或测定板显示较高的AUC(单独或联合运用甚至超过0.90)、灵敏度和特异性;(2)不受口腔癌危险因素、慢性牙周炎影响;(3)部分标记物具有性别差异。这些优势为其早日用于临床提供可能。因此,本文就新型唾液生物标记物(表1)在口腔癌检测的研究进展作一综述。
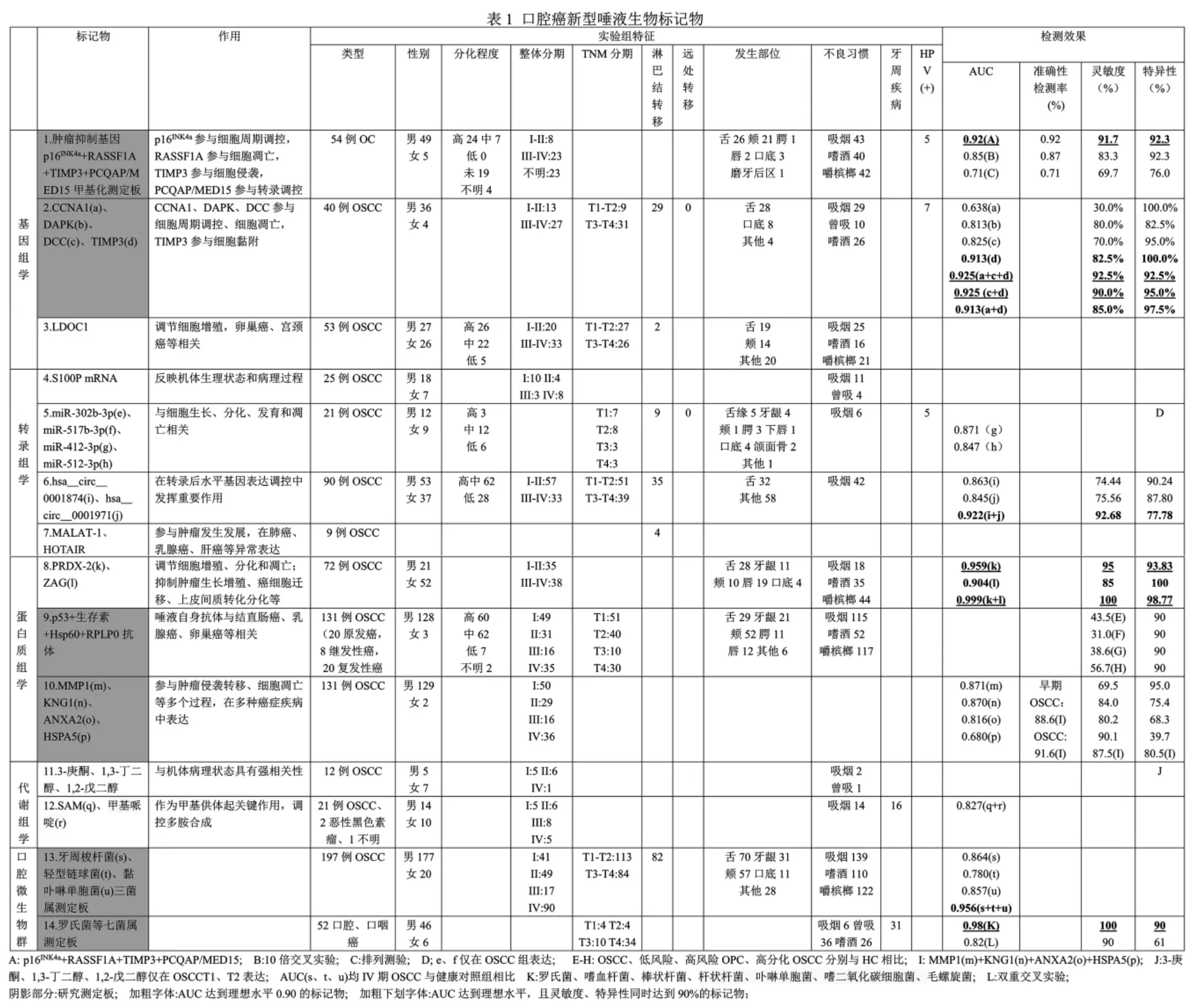
1.基因组学
多种形式的基因突变可影响蛋白合成,导致口腔癌发生。过去研究显示,p53 基因突变在唾液与组织具有一致性,近几年口腔癌唾液基因组学的研究热点集中于甲基化。
Liyanage 等[7]研究了54 例口腔癌患者和60 例健康人群唾液p16INK4a、RASSF1A、TIMP3、PCQAP/MED15 抑癌基因的表达,发现四者联合AUC、准确性、灵敏度、特异性为0.92、0.92、91.7%、92.3%,10 倍交叉实验(模拟临床运用效果)为0.85、0.87、83.3%、92.3%,排列测验(模拟临床运用效果)为0.71、0.71、69.7%、76.0%,四者联合具有从健康人群区分口腔癌的高效性,有望成为口腔癌筛查的理想工具。
Arantes 等[8]对OSCC 患者和健康人群各40 例唾液进行研究,发现甲基化的CCNA1、DAPK、DCC 和TIMP3 在OSCC 具有高特异性,与临床特征(性别年龄、HPV、临床分期、血管栓塞和神经浸润)无关,早期检测OSCC 有较好效果:CCNA1 的AUC、灵敏度、特异性为0.638、30.0%、100.0%,DAPK 为0.813、80.0%、82.5%,DCC 为0.825、70.0%、95.0%,TIMP3 为0.913、82.5%、100.0%,CCNA1+DCC+TIMP3 为0.925、92.5%、92.5%,DCC+TIMP3 为0.925、90.0%、95.0%,CCNA1+TIMP3 为0.913、85.0%、97.5%。这些标记物表现出检测OSCC 的潜力,有望临床运用该测定板。
LDOC1 是一种X 连锁肿瘤抑制因子基因,通过NF-κB 通路调节细胞增殖,与卵巢癌、宫颈癌等相关。Liu 等[9]qRT-PCR 检测了53 例OSCC患者和43 例健康对照者唾液LDOC1,发现女性OSCC 组显著上调,男性OSCC 组显著下调;然而,约60%的男性OSCC 患者有吸烟史(79.1%)、嚼槟榔史(66.6%)。高表达的LDOC1 有望成为女性OSCC 唾液标记物,低表达的LDOC1 能否排除吸烟、嚼槟榔等影响成为男性OSCC 标记物,有待进一步研究。
2.转录组学
转录组学参与基因表达调控、蛋白合成修饰。唾液易检出大量RNA,主要包括mRNAs、miRNAs,近年circRNAs、lncRNAs 开始受到重视。
mRNAs 虽只占细胞总RNA 的2%~5%,但种类最多、代谢活跃,可反映机体生理和病理状态。健康人唾液上清约3000 种mRNA,DUSP-1、H3F3A、IL-Iβ、IL-8、OAZ-1、SAT 和S100P的联合运用显示较高灵敏度和特异性[10]。唾液炎性状态影响唾液mRNAs 表达,Cheng 等[11]发现,OSCC 与中重度慢性牙周炎患者(无论吸烟与否)、健康人群相比,以上7 种mRNA 仅S100P 升高。唾液S100P mRNA 表达不受慢性牙周炎影响,有望成为OSCC 唾液潜在标记物。
miRNAs 是长约21~23 个核苷酸的非编码RNA,占人类基因的1%~5%,却调节约30%蛋白编码基因,与细胞生长、分化、发育和凋亡相关。miR-125a、miR-200a、miR-31 是已被报道的口腔癌唾液潜在标记物。近年发现,唾液miRNAs可由细胞外囊泡分泌,Gai 等[12]首次评估其在OSCC的表达,发现miR-302b-3p、miR-517b-3p 仅在OSCC 组表达;miR-412-3p、miR-512-3p 在OSCC 较健康对照组表达上调,AUC 分别为0.871、0.847。提示四者可作为OSCC 检测的可靠唾液标记物。
circRNAs 是一种无5' 帽或3' 聚尾的共价闭环结构,稳定性好、平均半衰期长,可对抗RNA外切酶、与miRNAs 结合抑制其活性。Zhao 等[13]微阵列筛选出OSCC 组12 个上调、20 个下调唾液circRNAs;随后对90 例OSCC 唾液qRT-PCR,发现OSCC 较健康对照组上调的hsa_circ_0001874AUC、灵敏度、特异性为0.863、74.44%、90.24%,下调的hsa_circ_0001971 为0.845、75.56%、87.80%,联合运用为0.922、92.68%、77.78%,卡方检验显示二者与TNM 分期、肿瘤病理分级相关。
lncRNAs 是长度大于200 个核苷酸的非编码RNA,可影响染色质重塑和甲基化、抑制miRNAs、调节蛋白质复合物的稳定性。57 例OSCC 组织的研究显示,OSCC 与健康对照组有160 个差异表达lncRNAs[14]。MALAT-1、HOTAIR 是目前热点lncRNA,Tang 等[15]qPCR 研究了9 例OSCC 唾液,发现所有患者均表达MALAT-1;5 位表达HOTAIR,4 例淋巴结转移患者中3 例阳性表达。唾液lncRNAs 在口腔癌的研究尚处起步阶段,值得关注。
3.蛋白质组学
蛋白质是遗传信息的最终产物,唾液蛋白质组学在阐明致病机制、靶向治疗等方面具有重要意义。MMP-9、白细胞介素是已被报道的口腔癌唾液潜在标记物。近年新发现139 种唾液蛋白可能与口腔癌相关[16],完善了口腔癌唾液蛋白库。
PRDX-2 属于硫醇特异性抗氧化酶家族,介导与细胞增殖、凋亡调节相关的多种信号通路;ZAG 属于巨球蛋白家族,与抑制肿瘤生长、上皮间质转化和激活凋亡相关。Heawchaiyaphum 等[17]研究了72 例OSCC 和78 例无癌对照组,发现二者在OSCC 唾液显著上调,不受危险因素(吸烟嗜酒、嚼槟榔、人乳头瘤病毒和EB 病毒)影响;检测早期OSCC,PRDX-2AUC、灵敏度、特异性为0.959、95%、93.83%,ZAG 为0.904、85%、100%,二者联合为0.999、100%、98.77%。提示二者单独或联合可作为OSCC 早期检测的可靠唾液标记物。
Wu 等[18]通过ELISA 与悬浮阵列结合的多路复用面板,研究了131 例OSCC、42 例低风险、44例高风险口腔癌前病变患者和131 例健康人群唾液,发现早期OSCC 较健康个体抗p53、生存素、Hsp60、RPLP0 抗体显著升高,与高分化OSCC相关,与临床特征(年龄、吸烟嗜酒、嚼槟榔、部位分期、淋巴结有无转移)不相关;将特异性确定为90%,四者检测OSCC 灵敏度分别23.7%、20.6%、17.6%、23.7%、29.0%,检测高分化OSCC 为30%、31.7%、23.3%、33.3%、38.3%,联合区分OSCC、低风险、高风险口腔癌前病变、高分化OSCC 为43.5%、31.0%、38.6%、56.7%。唾液自身抗体联合测定板具有早期检测OSCC 潜力,灵敏度有待提高。
Yu 等[19]通过LC-多重反应监测质谱定量131例OSCC、103 例低风险、130 例高风险口腔癌前病变患者、96 例健康人群49 种唾液蛋白,生成MMP1、KNG1、ANXA2、HSPA5 测定板:MMP1的AUC、灵敏度、特异性为0.871、69.5%、95.0%,KNG1 为0.870、84.0%、75.4%,ANXA2 为0.816、80.2%、68.3%,HSPA5 为0.680、90.1%、39.7%;四蛋白测定板灵敏度、特异性分别87.5%、80.5%,能检测88.6%的早期OSCC 和91.6%的OSCC,亦可评估高危口腔潜在恶变风险,有望运用至临床。
4.代谢组学
唾液代谢组学与机体生理、病理状态相关,反映基因、RNA、蛋白质的效应,表达存在性别、年龄、吸烟、受刺激状态等差异,既往口腔癌唾液代谢组学研究涉及甜菜碱、透明质酸、氨基酸等。
新近研究表明,VOCs(挥发性有机化合物)与机体病理状态强相关。Shigeyama 等[20]首次通过ZSM-5/聚二甲基硅氧烷杂化膜与气相色谱-质谱联用的薄膜微萃取技术,研究了12 例OSCC 与8 例健康对照组唾液,发现两组分别有42、73 种内源性VOCs(35 种相同),12 种在OSCC 表达频率改变;3-庚酮、1,3-丁二醇、1,2-戊二醇仅在OSCC 的T1、T2 阶段表达。该研究建立了OSCC患者和健康人群唾液代谢组学特征,并初步探讨VOCs 作为OSCC 唾液潜在标记物。
Ishikawa 等[21]运用毛细管电泳质谱分析了24例口腔癌患者和44 例健康对照者未受刺激全唾液亲水代谢物,发现45 种有统计学差异,SAM 联合甲基哌啶从健康人群筛查口腔癌AUC 为0.827。差异表达的唾液代谢物有望用于口腔癌筛查;SAM联合甲基哌啶检测效果较好,单独运用不甚明确。
5.口腔微生物群
口腔微生物群包括细菌、病毒、真菌,口腔癌致病因素影响微生物群组成。近年,宏基因组技术有助于研究口腔癌微生物基因组、毒力特性及与机体免疫的相互作用。
Yang 等[22]对197 例不同时期OSCC 和51 例健康个体口腔漂洗样本的微生物测序,发现梭菌属(牙周梭杆菌、微小单胞菌、星状链球菌、流感嗜血杆菌和产线梭杆菌AUC 分别0.864、0.883、0.856、0.696、0.800)丰度增加,而链球菌(轻型链球菌0.780)、嗜血杆菌(副流感嗜血杆菌0.805)、卟啉单胞菌(黏卟啉单胞菌0.857)和放线菌属随OSCC 进展减少,牙周梭杆菌、轻型链球菌、黏卟啉单胞菌三菌属研究测定板区分IV 期OSCC 与健康对照组AUC 为0.956。
Lim 等[23]同法分析了52 例口腔、口咽癌患者、11 例高危人群和10 例健康人群口腔漂洗样本,测定出6 个已知门类和28 个菌属,罗氏菌、嗜血杆菌、棒状杆菌、杆状杆菌、卟啉单胞菌、嗜二氧化碳细胞菌低丰度表达于口腔癌和口咽癌组,毛螺旋菌则高表达,七菌属测定板AUC、灵敏度、特异性分别0.98、100%、90%,双重交叉实验为0.82、90%、61%,该测定板有望用于临床检测。
6.小结
相比既往研究,新型口腔癌唾液标记物AUC较高,不受危险因素、慢性牙周炎等影响,为探寻理想标记物提供诸多新进展。期待在以下方面有更深入研究:1.全面测定标记物单独或联合AUC,确定灵敏度、特异性最佳结合点,联合交叉验证、排列实验等,筛选理想标记物;2.统一检测技术质控标准,使研究数据具有可比性;3.对照组设定更多考虑口腔癌危险因素、慢性牙周炎等对特异性的影响;4.关注标记物在口腔癌前病变或状态的差异表达,以评估癌变风险。综上,新型口腔癌唾液标记物及联合测定板显示较好的检测效果,但临床检测、早期筛查效果暂不明确;加快临床运用并验证可靠性及重复性,成为亟待解决的问题。
