跑台运动对肥胖大鼠腹侧纹状体多巴胺水平及胰岛素信号的调控作用
2020-05-21王海军尚宁宁赵华恩陈巍
王海军 尚宁宁 赵华恩 陈巍
1 河北科技师范学院体育与健康学院(秦皇岛066004)
2 河北师范大学体育学院(石家庄050024)
高脂饮食是一种天然奖赏源,与其它营养素比较,可诱发更高的奖赏效应[1]。最新的研究还发现,食物中的脂肪含量是导致啮齿动物体重增加的重要因素[2]。此外,长期高脂饮食还会降低奖赏系统(reward system)对进食的反应,个体需要增加进食量才可以产生预期的食物奖赏效应,由此引发的过度进食(overeating)在很大程度上促进了肥胖(obesity)的发生[3]。多巴胺(dopamine,DA)是脑内一种重要的神经递质,中脑黑质致密部的DA 神经元投射至背侧纹状体调控躯体运动,中脑腹侧被盖区(ventral tegmental area,VTA)DA 神经元投射至腹侧纹状体,参与情绪、动机及奖赏行为的调节。受到食物相关信息刺激时,VTA-DA 神经元由单放电转变为爆发式放电,放电模式的变化使腹侧纹状体DA水平明显增加,促使个体出现觅食动机并触发进食后的奖赏效应[4]。由于胰岛素受体广泛分布于VTA-DA神经元,因此胰岛素信号对DA神经元的功能活动的调控有重要影响[5]。在进食过程中胰岛素被释放至循环中,经主动转运穿越血脑屏障进入脑内。一方面通过作用于腹侧被盖区,降低DA神经元兴奋性减少进食动机[6];另一方面通过作用于腹侧纹状体促进DA在轴突终末的释放提高奖赏效应[7]。食物奖赏不足被认为是肥胖者产生过度进食的重要原因。可见,降低VTA-DA 神经元胰岛素抵抗对缓解肥胖者过度进食行为可能具有积极影响。在过去的几十年,运动锻炼可显著改善肥胖相关胰岛素抵抗已经取得共识[8-9]。近年来,关于运动是否能够通过奖赏机制调控进食行为及能量摄入防治肥胖备受关注[10]。前期研究显示,运动干预可改善高脂饮食诱导的小鼠腹侧纹状体胰岛素信号障碍,并降低其体重与高脂饮食偏爱[11]。这是否与运动提高DA神经元胰岛素敏感度调节DA释放有关尚需要进一步阐明。本研究以高脂饮食方案建立肥胖大鼠模型,采用中等强度跑台运动对肥胖大鼠进行干预,观察腹侧纹状体胰岛素信号相关蛋白表达、DA水平及进食行为的影响,探讨运动锻炼防治肥胖的神经生物学机制。
1 材料与方法
1.1 实验对象及分组
实验对象为清洁级雄性SD 大鼠(5 周龄,体重170~190 g)60只,购买于北京维通利华实验动物技术有限公司,动物分笼饲养,自由饮水进食,动物房明暗交替周期为12小时,温度控制在(25 ± 2)℃,相对湿度为(50 ± 5)%,保持动物的生活环境通风与卫生。大鼠在动物房内适应性饲养1周后随机分为普通饲料组(RG组,n=24)和高脂饲料组(HG组,n=36)。12周后将高脂组中的肥胖大鼠随机分为肥胖组(OG组,n=12)与肥胖运动组(OEG 组,n=12)。普通组随机分为对照组(CG组,n=12)与运动对照组(CEG组,n=12)。
1.2 肥胖大鼠模型的建立
RG组大鼠给予普通饲料(2.90 kcal/g,13%脂肪,64% 糖,23% 蛋白质);HG 组大鼠给予高脂饲料(4.20 kcal/g,51%脂肪,33%糖,16%蛋白质)。饲养12周后,以体重超过RG组大鼠平均体重20%作为肥胖模型成功的标准[12],肥胖成模率为66.6 %。在保持原有饮食习惯的基础上,CEG 组与OEG 组大鼠进行8 周跑台运动干预,运动干预采用电动跑台进行训练,坡度设置为0度,正式训练的前10 min跑速为10 m/min,然后以15 m/min 运动30 min,最后10 min 调整为18 m/min。此运动干预强度约相当于50%~70%最大摄氧量的强度[13]。周一至周五每日训练1 次,持续进行8周。在运动干预同时将CG组与OG组大鼠置安静跑台内同样时间。
1.3 食物偏爱测试
食物偏爱测试(food preference test)于运动干预最后的一周进行,共进行3次测试,每次测试之间的间隔48 h,测试时各组大鼠保持原有饲养习惯,同时给予15%的蔗糖溶液与含5%脂肪的纯牛奶,大鼠可自由进食饮水。计算24小时内蔗糖溶液、牛奶与不同饲料的消耗量及能量摄入。第3 次实验前大鼠禁水禁食24 h,计算每日单位体重不同食物的能量消耗与总能量消耗的比例。大鼠对不同食物的偏爱=(24小时单位体重摄入该食物的能量/24 小时单位体重总能量摄入)×100%。
1.4 样品采集及处理
最后一次运动结束后48小时,每组各取6只大鼠,在大鼠腹腔注射(0.35 ml/100 g)10 %的水合氯醛溶液进行麻醉大鼠,打开胸腔后用注射针头插入左心室灌注生理盐水,同时剪开右心耳流出液体变澄清时,迅速取出脑组织,置-80℃保存待测。将附睾周、肾周、腹股沟及网膜周等部位的内脏脂肪完整分离,精确称重后以公式“内脏脂肪率=四部位脂肪含量/体重×100 %”来计算其内脏脂肪率。
1.5 腹侧纹状体DA水平检测
在第12周肥胖建模成功后,每组取6只大鼠,采用腹腔注射10 %水合氯醛(0.35 ml/100 g)将大鼠麻醉后,固定于脑立体定位仪上,使颅骨前囟与后囟保持在同一个平面上。按大鼠脑立体定位图谱[14]在腹侧纹状体(AP:+1.60 mm,ML:2.5 mm,DV:7.0 mm)处植入导轨,并采用螺丝钉和牙科水泥将其固定,采用生物硅胶将暴露的脑组织封住,大鼠苏醒24 小时后,恢复常规饲养。最后一次运动干预结束48 h后,开始进行透析,透析前先将大鼠禁食12 小时,将探针插入导轨并与微透析泵相连,将人工脑脊液以2 μl/min 的速度持续灌入,弃掉前30 min 的流出液,然后每30 min 收集一个样品,60 min 后将0.5 μg 生理盐水溶于10 %DMSO随人工脑脊液灌入腹侧纹状体,150 min后让大鼠进食含5%脂肪的牛奶,间隔15 min 后将0.5 μg 胰岛素溶于10 % DMSO随人工脑脊液灌入脑内,将透析采集到的样品置-80 ℃保存待测。在实验结束后测定探针回收率,尼氏染色确定脑组织切片微透析探针导轨位置。采用高效液相色谱-电化学技术测定透析液中DA 含量。色谱柱为2.1 mm×150 mm,将柱温设置为30 ℃,流速设置为0.2 ml/min,工作电压设置为0.52 V。根据标准品所对应的峰面积绘制浓度-峰面积标准曲线计算DA的浓度。
1.6 纹状体胰岛素信号蛋白表达检测
采用western blot 检测纹状体胰岛素受体(insulin receptor,InsR)、蛋白激酶B(protein kinase B,Akt)及其磷酸化(p-Akt-Thr308)蛋白的表达。腹腔注射10 %水合氯醛(0.35 ml/100 g)麻醉,迅速断头取全脑,在冰盒上分离左脑,置于液氮-80 ℃中保存。待检测时取出保存的脑组织,将脑组织放置冰面上,在冰面上快速分离出纹状体,剪碎后置RIPA 裂解液中裂解30 min,匀浆后超声粉碎,静置30 min 后,经12000 r/min 离心10 min 后取上清液进行分装,采用BCA 法对上清液的蛋白浓度进行测定,然后煮沸样品。在待测样品中加入10% β-巯基乙醇,每孔上样30 μg,采用恒压电泳,4% 浓缩胶加以80 V恒压电约20~30 min;进入分离胶时改用100 V 恒压电约60 min。湿转法转膜(PVDF),5%脱脂奶粉37℃恒温封闭60 min。加入稀释的单克隆抗体(abcam,InsR:1/1000;Akt:1/5000;p-Akt-Thr308:1/1000),室温下孵育过夜后,TBST洗膜5×5 min,加入辣根过氧化物酶标记的二抗(1∶5000,中杉金桥,ZB-2301),室温孵育2 h,曝光后显影,同一PVDF 膜检测内参蛋白,显影完毕后,采用QuantityOne软件分析光密度值。
采用免疫组织化学技术对腹侧纹状体InsR、Akt及其磷酸化p-Akt-Thr308 蛋白定位进行检测,对脑组织进行石蜡包埋,切片,常规脱蜡、脱水、PBS 缓冲液洗、孵育、正常羊血清37℃封闭;去除血清后PBS缓冲液洗3×10 min;一抗4℃孵育12 h(InsR:1/200,Akt:1/200,p-Akt-Thr308:1/500);PBS 缓冲液洗3×10 min;二抗室温孵育2 h;PBS 缓冲液洗3×10 min;辣根酶标记链霉卵白素工作液室温孵育2 h;DAB显色,贴片,苏木素复染,梯度乙醇脱水,透明,封片,拍照,对每个脑组织蜡块连续切片,每隔5 张选取1 张切片,每个样本选取3 张切片,每张切片选3 个不同的视野,使用Image-Pro Plus 6.0 软件测量腹侧纹状体目标蛋白的平均光密度值。
1.7 统计学处理
采用SPSS 20.0软件进行数据的统计学处理,所有的计量资料均以均数±标准差(±s)表示。 RG组与HG 组大鼠体重及能量摄入的比较采用独立样本T 检验(Independent Samples T Test),不同组别大鼠腹侧纹状体DA 水平的变化情况比较采用双因素方差分析(Two Way ANOVA),其余变量组间均数比较均采用单因素方差分析(One Way ANOVA),采用事后检验多重比较LSD 分析组间差异,均采用P<0.05 为差异具有统计学意义。
2 结果
2.1 大鼠体重、体成分及能量摄入的变化
经过12 周高脂饮食饲养,HG 组大鼠体重显著高于RG 组(P<0.01)。经过8周的跑台运动干预,OEG 组大鼠体重较OG 组显著降低(P<0.01)(图1A)。与CG组比较,CEG 组大鼠体重变化率降低(P<0.01),与OG组比较,OEG 组大鼠体重变化率亦降低(P<0.01)(图1B)。与CG 组比较,OG 组大鼠内脏脂肪率显著增加(P<0.01),而与OG 组比较,OEG 组大鼠内脏脂肪率出现显著下降(P<0.05)(图1C)。此外,与RG组比较,HG组大鼠每日能量摄入量显著增加(P<0.01);CEG 组与OEG组大鼠分别与CG组和OG组比较能量摄入量未见显著变化(P>0.05)(图1D)。
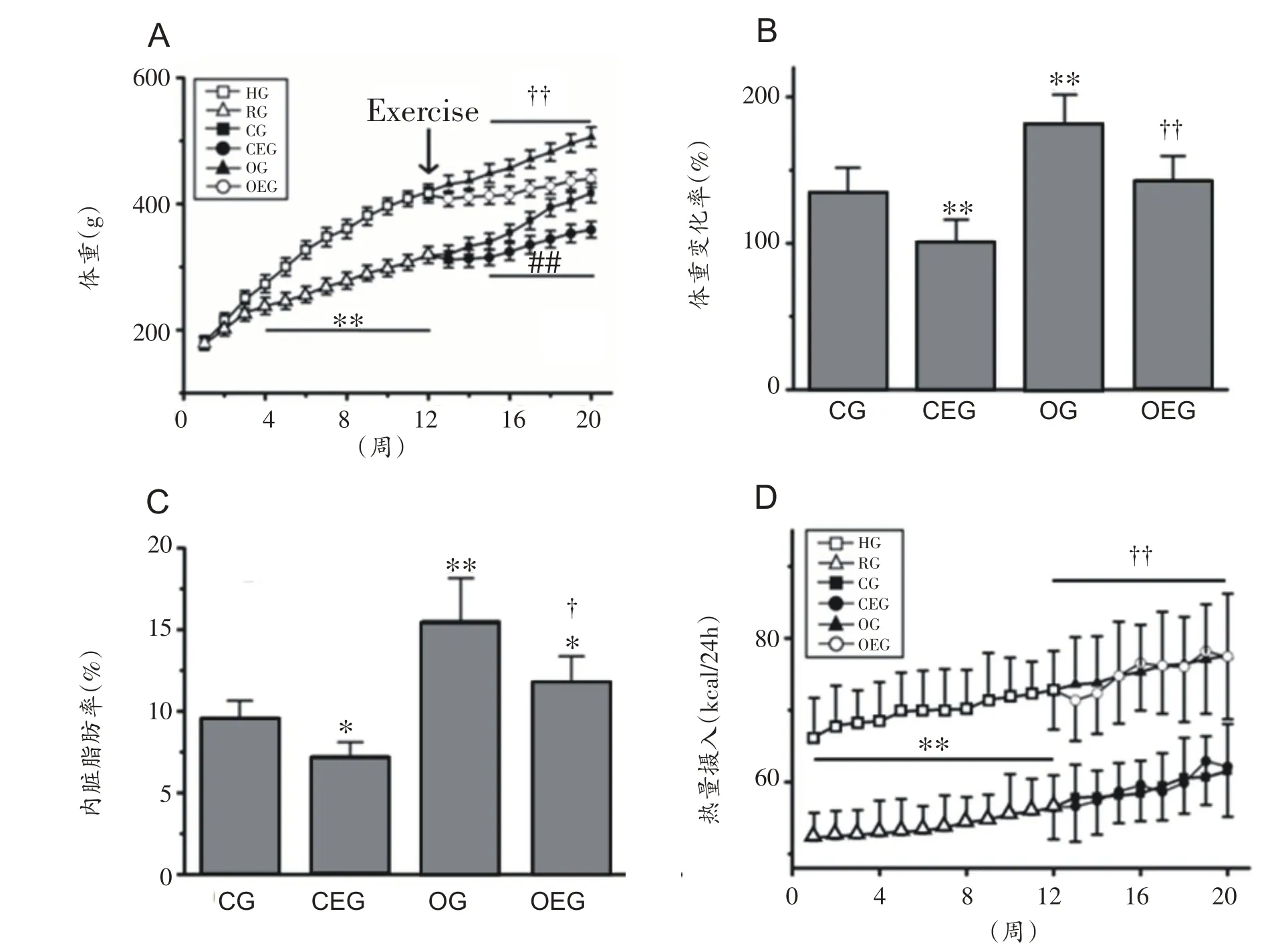
图1 大鼠体重、体成分及能量摄入的变化
2.2 大鼠食物偏爱变化
图2A食物偏爱试验结果显示,与CG 组比较,OG组大鼠对蔗糖溶液与牛奶的偏爱度显著降低(P<0.01,P<0.01),而对高脂饲料的偏爱度却明显增加(P<0.01)。然而,OEG 组大鼠对蔗糖溶液与牛奶的偏爱度较OG组大鼠明显增加(P<0.01,P<0.01),对高脂饲料的偏爱度显著减少(P<0.01)。如图2B-D所示,禁食24 h后,记录24 h大鼠对不同食物的摄取量,OG组大鼠在前3 h对高脂饲料和牛奶所摄取的比例均显著高于CG 组大鼠(P<0.01,P<0.01),而对蔗糖溶液的摄取量显著低于CG 组大鼠(P<0.01);此外,与OG 组比较,OEG 组大鼠在前3 h 对蔗糖溶液的摄取比例显著升高(P<0.01),而对高脂饲料与牛奶的摄取比例显著减少(P<0.01,P<0.01)。
2.3 大鼠腹侧纹状体DA水平的动态变化
如图3A所示,与CG 组比较,OG 组大鼠腹侧纹状体DA基础水平显著下降(P<0.01),与OG组比较,OEG组大鼠腹侧纹状体DA 基础水平显著增加(P<0.05)。如图3B 所示,双因素方差分析显示,本研究中组别与不同时间点对大鼠腹侧纹状体DA 水平均存在显著主效应,F(3,100)=129.003,P<0.01;F(4,100)=16.170,P<0.01;组别与不同时间点两个因素无显著交互项效应,F(12,100)=0.588,P>0.05。进食牛奶接受胰岛素刺激30 min 后,各组大鼠腹侧纹状体DA 水平与胰岛素干预前比较均显著上升,但是胰岛素诱导的腹侧纹状体DA 增加比例存在显著的组间差异(P<0.01),与CG组比较,OG组大鼠腹侧纹状体DA变化率显著降低(P<0.01),而OEG 组大鼠较OG 组大鼠腹侧纹状体DA水平变化率显著增加(P<0.01)。
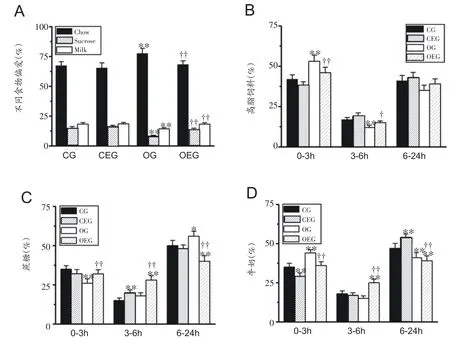
图2 大鼠食物偏爱变化
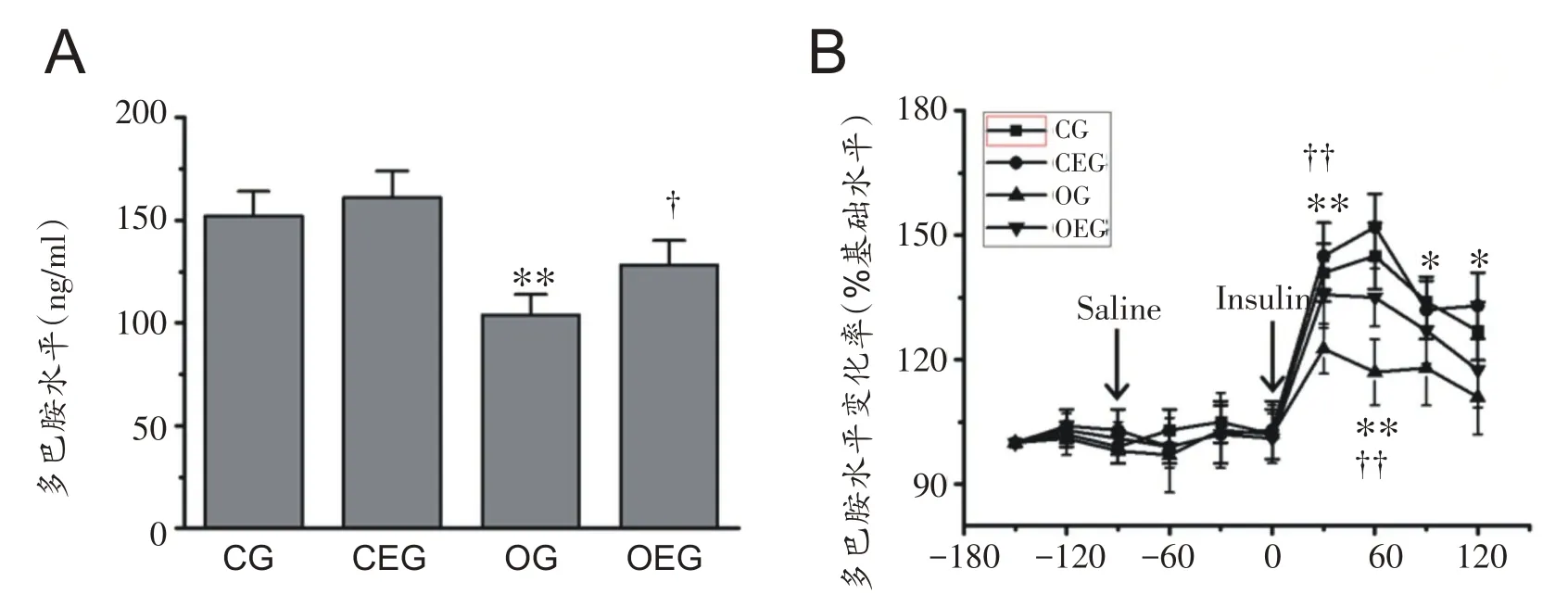
图3 大鼠腹侧纹状体DA水平变化比较
2.4 大鼠纹状体胰岛素信号蛋白表达变化
如图4A-B 所示,与CG 组比较,OG 组大鼠纹状体胰岛素受体的表达与蛋白激酶磷酸化水平分别下降了21.65%和53.28%,差异显著(P<0.01,P<0.01);此外,OEG大鼠纹状体胰岛素受体表达与蛋白激酶磷酸化水平分别增加12.87%和48.87%,且差异显著(P<0.01,P<0.01)。
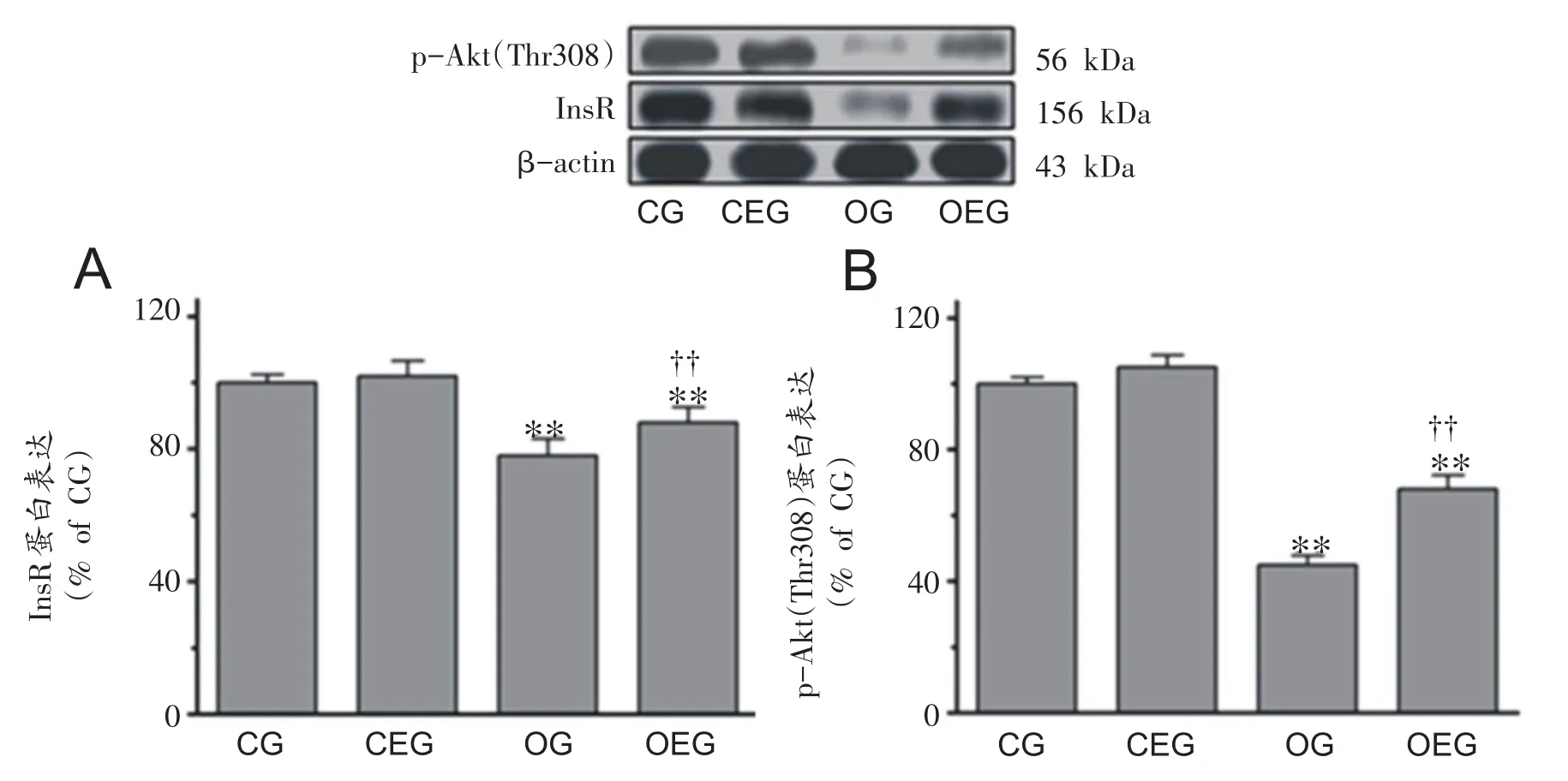
图4 大鼠纹状体胰岛素信号蛋白表达变化
2.5 大鼠腹侧纹状体胰岛素信号蛋白定位表达变化
如图5所示,大鼠腹侧纹状体胰岛素受体与蛋白激酶磷酸化的阳性表达呈棕黄色染色,与CG 组比较,OG 组大鼠腹侧纹状体胰岛素受体与蛋白激酶磷酸化的阳性表达均出现下降,差异显著(P<0.01,P<0.01);此外,与OG 组相比,OEG 组大鼠腹侧纹状体胰岛素受体与蛋白激酶磷酸化蛋白的阳性表达均明显增加,且差异显著(P<0.05,P<0.05)。
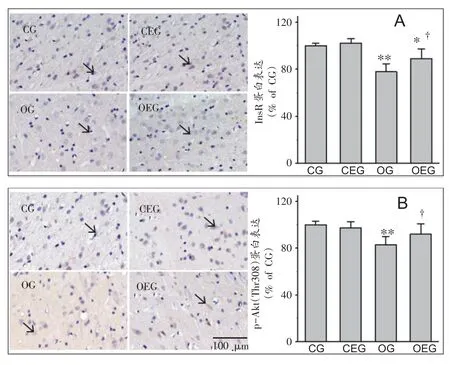
图5 大鼠腹侧纹状体胰岛素信号蛋白定位表达比较
3 讨论
人类的摄食行为受能量稳态及奖赏机制的双重调节,中脑腹侧被盖区所发出的DA能神经元投射至伏隔核作为大脑奖赏系统的核心环路,其受到适口性食物及其相关信息的刺激时,通过释放DA 到伏隔核,可促进觅食动机出现并触发食物奖赏[3-4]。进食过程中伴随着血糖升高,外周胰岛素也迅速达到峰值,并且可通过血脑屏障转运体进入中枢神经系统,作为饱食信号激活下丘脑的腹内侧核和弓状核神经元抑制进食行为[15]。除此之外,胰岛素还可以通过调节腹侧被盖区DA神经元的功能,降低其对适口性食物及相关信息的反应减少进食行为[6,7,16]。众所周知,过量摄入高脂饮食可使动物体重迅速增加进而导致肥胖,同时诱发胰岛素抵抗,外周胰岛素抵抗通常伴随着中枢胰岛素抵抗,这可能会改变胰岛素对腹侧被盖区-腹侧纹状体DA神经传递的调节,进而诱发进食行为异常[17]。越来越多的研究认为,肥胖与DA系统功能障碍导致的过度进食(overeating)有关[10,18]。虽然,规律的运动锻炼可通过多途径对肥胖者健康产生有益的影响已被充分认识,然而对于运动防治肥胖的神经生物学机制却未阐明[10]。前期研究显示,跑台运动可通过上调腹侧被盖区-腹侧纹状体酪氨酸羟化酶与DA 受体的表达降低肥胖小鼠高脂饮食偏爱[19,20]。由此推测,运动锻炼防治肥胖的机制可能与其改变饮食结构有关。
本研究所采用的运动干预方案为跑台训练,但所采取的运动强度较小,属于有氧运动,运动持续时间适当,训练过程中也未采取声、光、电等形式的刺激,因此,大鼠在训练过程中表现出较好的自主性。本研究发现,8 周有氧跑台运动明显抑制了肥胖大鼠体重增长,降低了内脏脂肪的含量,而且并未明显增加能量摄入,表明本研究所采用的运动干预方案可有效控制肥胖大鼠体重的增长,并改善其内脏脂肪率。本研究还发现,长期高脂饮食摄入可降低大鼠的蔗糖偏爱,并提高了其对脂肪的偏爱度,同时发现空腹后肥胖大鼠再次摄食初期的脂肪摄入量明显增加。而运动干预可缓解这一现象。脂肪与糖和蛋白质比较,其能量密度高,具有更强的适口性,对大脑奖赏系统也可以产生更强烈的刺激作用[21,22]。某些条件下,富含脂肪的适口性食物激活大脑奖赏系统所产生的进食动机可能会抵消机体的能量平衡信号,增加进食行为[23]。蔗糖偏爱试验被广泛用于评价动物对天然奖赏物的摄取程度,蔗糖偏爱度降低通常与肥胖相关的食物奖赏不足有关[24]。这提示高脂饮食导致肥胖后可引起奖赏系统敏感性下降,导致食物奖赏不足,而运动干预在一定程度上调节了高脂饮食的偏爱程度,这可能与奖赏系统敏感性的提高有关。有研究发现,12 周高强度有氧运动可明显降低肥胖青少年能量摄入[25]。Fearnbach 等的研究也证实,一次45 分钟65%VO2max 的踏车运动可降低肥胖青少年神经系统对食物相关刺激的反应程度,但对体重正常者未产生影响[26]。Moody 等认为运动能够减少动物高脂饮食偏爱并降低体重的原因是运动奖赏代偿了食物奖赏[27]。由于运动锻炼可促进中脑DA 神经元释放神经递质,因此推测运动降低食欲可能与纹状体DA释放增加有关,但是其调控机制并未阐明。
长期摄入高脂饮食引起肥胖,并诱发“胰岛素抵抗”,使外周血胰岛素水平升高,外周胰岛素可通过其转运体穿过血脑屏障进入中枢,神经细胞也可对胰岛素产生抵抗[17,28]。运动提高肥胖大鼠奖赏系统敏感性,并降低高脂饮食偏爱,是否与运动改善中枢胰岛素敏感度有关?为了证实这一推测,本研究采用微透析-高效液相色谱-电化学技术检测了胰岛素对腹侧纹状体DA水平调节的影响,结果发现长期高脂饮食的肥胖大鼠腹侧纹状体DA水平显著降低,接受胰岛素刺激后所有组大鼠腹侧纹状体DA水平均显著增加,但肥胖大鼠腹侧纹状体对胰岛素的反应程度却显著降低,提示可能存在中枢“胰岛素抵抗”。胰岛素对中脑-纹状体系统DA 神经传递具有重要的调节作用。胰岛素进入脑内后作用于腹侧被盖区DA 神经元可激活多巴胺转运体(DAT)促进DA重摄取,减少进食动机[6-7]。而胰岛素在腹侧纹状体可通过激活胆碱能的中间神经元促进DA 释放,进而提高奖赏效应,这些效应均依赖于磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(Akt)途径[6-7]。可见,胰岛素无论是作用于腹侧被盖区,还是作用于腹侧纹状体,虽然其调节机制不同,但其最终效应均是抑制进食行为。前期研究证实,长期高脂饮食可引起中脑DA 合成降低,导致腹侧纹状体DA 水平下降及食物奖赏不足,在进食过程中为了产生预期的食物奖赏,个体通常需要增加摄食量以代偿伏隔核DA水平[7]。值得注意的是,运动干预可提高肥胖大鼠胰岛素介导的腹侧纹状体DA的释放,这可能正是运动降低肥胖大鼠高脂饮食偏爱的重要原因。同时也提示,运动可能提高了腹侧纹状体神经元对胰岛素的敏感度。
为了检验运动干预对肥胖大鼠腹侧纹状体胰岛素信号转导的影响,本研究采用分子生物学技术对大鼠腹侧纹状体胰岛素受体与Akt 磷酸化水平进行了定量与定位检验,结果发现,肥胖大鼠腹侧纹状体胰岛素受体与Akt磷酸化表达水平显著降低,表明高脂饮食诱导的肥胖会抑制胰岛素在腹侧纹状体处的信号传导,进而引起胰岛素对腹侧纹状体DA 释放的调节功能减弱。Nicole等的研究也发现,高脂饮食可抑制大鼠黑质与纹状体Akt 磷酸化水平,影响DA 代谢,进而增加摄食行为[29]。这提示高脂饮食同样诱导了大鼠中枢胰岛素抵抗,可见肥胖导致的外周胰岛素抵抗与中枢胰岛素抵抗具有一致性。运动锻炼对肥胖相关胰岛素抵抗的改善已得到充分验证,本研究不仅发现运动干预可有效改善肥胖大鼠胰岛素抵抗及胰岛素敏感度,而且还发现,运动干预可提高肥胖大鼠腹侧纹状体胰岛素受体及Akt磷酸化水平。这些研究结果提示,运动干预可以通过提高胰岛素敏感度促进腹侧纹状体DA 的释放,进而改善肥胖大鼠食物奖赏不足减少高脂膳食的摄入。
4 结论
跑台运动可通过提高腹侧纹状体胰岛素信号转导,促进腹侧纹状体DA 释放,增加腹侧纹状体DA 水平,促进奖赏系统功能恢复,改善肥胖大鼠对高脂饮食的偏爱及过度进食现象,进而有助于控制肥胖大鼠体重增长。其相关分子机制可能与运动干预调节腹侧纹状体胰岛素PI3K/Akt信号途径有关。
