佛手苷内酯对磷酸三钙磨损颗粒所致假体周围骨溶解的影响
2020-05-21万烨东陈泽维王枫陈孝贞卢俊青毛红娇侯玮玮张云
万烨东 陈泽维 王枫 陈孝贞 卢俊青 毛红娇 侯玮玮 张云
1 绍兴文理学院医学院(浙江绍兴312000)
2 浙江大学医学院附属口腔医院(浙江杭州310000 )
人工关节置换术是用人工材料制成的假体关节置换和代替损伤或病损关节,能有效减轻患者关节疼痛、重建关节功能,提高患者生活质量,是目前治疗晚期严重骨关节疾病的最重要手段。然而,随着关节置换病例的增加和时间的延长,假体晚期松动问题日益突出。大量研究表明,聚乙烯(polyethylene,PE)、钛(titanium,Ti)和磷酸三钙(tricalcium phosphate,TCP)等三类关节假体植入体内后,经过长期磨损、碰撞产生大量的磨损颗粒,这些微米粒径的细小颗粒聚集于假体表面会刺激假体周围组织细胞释放肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)、白介素1β(interleukin-1 beta,IL-1β)和白介素6(interleukin-6,IL-6),诱导假体周围破骨细胞生成和炎症性骨溶解[1-3]。目前治疗假体周围骨溶解主要有双膦酸盐和抗炎药物,这些药物虽然有一定的治疗效果,但均存在诸多副作用,不宜长期服用。因此,寻找一种高效、毒副作用少,能长期应用于治疗假体周围骨溶解及关节松动的药物已迫在眉睫。
佛手苷内酯(bergapten,BP)为一种天然的香豆素类化合物,广泛存在于佛手、新鲜芹菜、柠檬、欧芹和欧防风等食品中,具有抗炎、降血酯和抗肿瘤等活性[4,5]。以往研究与我们前期实验结果显示佛手苷内酯可抑制核因子κB 受体活化因子配体(receptor activator of nuclear factor-κ B ligand,RANKL)和脂多糖(lipopolysaccharide,LPS)介导的破骨细胞生成、存活及骨吸收[6,7]。而关于佛手苷内酯对TCP 磨损颗粒诱导的假体周围炎症性骨溶解的影响如何,目前尚不清楚。本研究应用前期成功构建的TCP磨损颗粒诱导小鼠颅骨溶解模型,研究佛手苷内酯对假体周围骨溶解、破骨细胞生成、炎症因子释放、炎症小体活化及细胞焦亡的影响,探讨佛手苷内酯对TCP 磨损颗粒诱导的假体周围骨溶解的保护作用及分子机理,为研究防治假体周围骨溶解及关节松动提供实验依据。
1 材料和方法
1.1 实验动物
SPF 级雄性6~8 周龄ICR 小鼠,体重18~22 g,清洁级,购自浙江省医学科学院实验动物中心,动物许可证号:SCXK(浙)2014-0001,合格证号1603090018。
1.2 小鼠颅骨溶解模型的构建[3]与实验分组
SPF级雄性6~8周龄ICR小鼠60只随机分为假手术组(Sham组)、TCP磨损颗粒组(TCP组)、佛手苷内酯5 mg/kg 组(BP 5 mg/kg 组)、佛手苷内酯10 mg/kg 组(BP 10 mg/kg 组)和佛手苷内酯20 mg/kg 组(BP 20 mg/kg 组),每组12只。各组小鼠称量体重后分别经腹腔注射1.5%戊巴比妥钠(60 mg/kg)麻醉后,无菌条件下取颅顶正中矢状切口,长约0.8 cm,分离皮下组织,露出面积为1 cm×1 cm 方形颅骨区域。其中Sham 组进行原位缝合,其余四组取TCP磨损颗粒(30 mg)置于颅顶处后缝合皮肤。假手术和佛手苷内酯组小鼠于术后第2 天于颅顶部位分别注射生理盐水和佛手苷内酯,隔日注射1 次,持续2 周。实验结束后,各组小鼠称量体重后通过摘除眼球取血;同时取出颅骨(以正中矢状缝为中心的方形区域),磷酸缓冲盐溶液(phosphate buffer saline,PBS)、滤纸吸去多余水分后分析天平称量颅骨湿重(mg)。
1.3 测试指标与方法
1.3.1 TRAP染色观察假体周围骨溶解
各组小鼠的颅骨经4%多聚甲醛固定10 min、超声清洗5 min 后,置于系列梯度乙醇(50%、80%、90%和100%)中脱水,自然晾干后放入TRAP染色液中室温避光染色60 min。PBS 清洗2 次后,置于IX70 显微镜下观察颅骨表面侵蚀程度,并利用Image Pro Plus 6.0图像处理软件分析正中矢状线区域骨溶解面积。
1.3.2 HE染色观察假体周围破骨细胞生成
各组颅骨经4%多聚甲醛固定24 h 和10% EDTA(pH 7.4)脱钙2周后进行石蜡包埋,后经切片机对颅骨矢状面连续切片(厚度为7 μm),脱蜡后行HE 染色。每只小鼠颅骨随机选取5张切片置于IX70显微镜下观察3 个视野中破骨细胞生成情况变化。利用Image Pro-Plus 6.0(美国Media Cybernetics公司)软件计算正中矢状缝区域三个核及以上破骨细胞数目。
1.3.3 ELISA法检测
实验结束后,各组小鼠分别于眼眶后静脉丛采血1.0 ml 置于EP 管中,待血液凝固后于(4 °C,3000 r/min)离心10 min,取上清液即为血清。
取96孔培养板,每孔加入20 μl血清,分别按照说明书检测小鼠血清中TNF-α、IL-1β、白介素18(interleukin-18,IL-18)和RANKL水平。
1.3.4 Western blot检测蛋白表达[8]
各组假体周围骨组织加入RIPA 裂解液置于冰上裂解30 min。经12000 r/min 离心15 min 收集上清液,应用BCA™试剂盒检测各组总蛋白浓度。每孔加入等量蛋白样品行12%SDS-PAGE 分离,电泳完成后将蛋白转移到PVDF 膜上,经5%脱酯奶粉常温封闭2 h后,分别加入兔抗NLRP3(1∶1000 稀释)、兔抗ASC(1∶1000 稀释)、兔抗IL-1β (1 ∶1000 稀释)、兔抗cleaved caspase-1(1:1000 稀释)和小鼠抗β-actin(1∶1000 稀释)等单克隆抗体于4 °C 孵育过夜。次日经TBST 洗涤3 次后加入HRP 标记的二抗室温孵育2 h,TBST 清洗3 次加入ECL 显色液;通过凝胶成像系统扫描分析各蛋白表达的变化。
1.4 统计学处理
统计处理用GraphPad Prism 5.0软件进行分析,数据均采用均数±标准差(±s)表示。各组采用单因素方差(one-way ANOVA)分析,并利用纽曼-科伊尔斯(Newman-Keuls)检验进行组间比较,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠体重和颅骨湿重变化
表1显示,从实验开始至结束,Sham 组、TCP 组和BP 各剂量组小鼠体重均相似,无显著性差异,表明BP对小鼠体重基本无影响。而各组小鼠的颅骨湿重差异明显,表现为:与Sham组比较,TCP 组颅骨湿重明显减少(P<0.05);与TCP组比较,BP组小鼠颅骨湿重显著增加(P<0.05),并呈一定的剂量依赖性(P<0.05)。
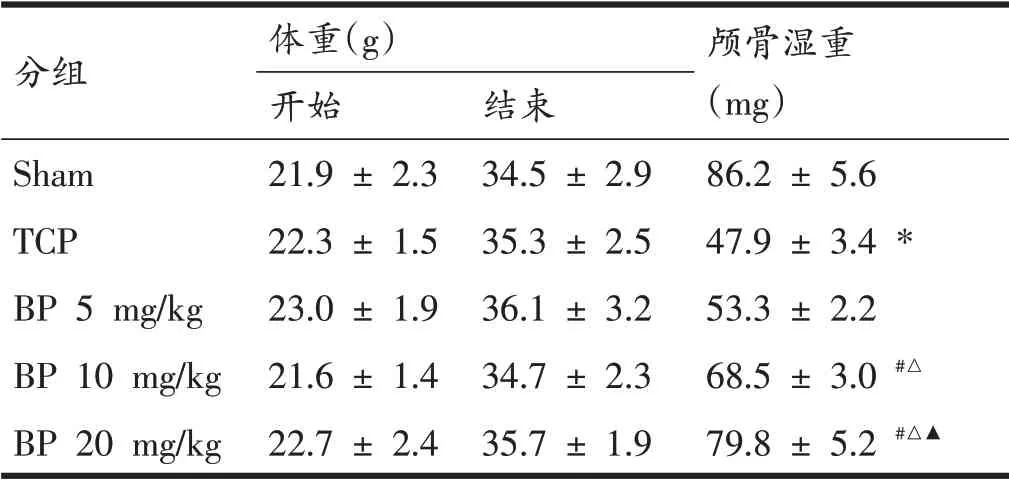
表1 各组小鼠体重和颅骨湿重比较(n=12)
2.2 各组小鼠颅骨假体周围骨溶解程度比较
与Sham 组比较,TCP 组小鼠颅骨假体周围(正中矢状缝)发生明显骨溶解,骨溶解面积显著增加(P<0.05);与TCP 组比较,BP 组小鼠颅骨表面骨溶解程度显著减轻,其中BP 20 mg/kg 组的骨溶解面积减少更为明显,仅为TCP 组小鼠骨溶解面积的37.13%(P<0.05)。见图1。
2.3 各组小鼠颅骨假体周围破骨细胞生成比较
与Sham 组比较,TCP 组小鼠假体周围破骨细胞生成显著增多(图2,P<0.05),血清中TRAP 和capthesin K 活性及RANKL 含量明显增加(表2,P<0.05);与TCP组比较,BP 组假体周围破骨细胞生成明显减少(图2,P<0.05),血清中TRAP、capthesin K 活性和RANKL 水平显著减少(表2,P<0.05)。
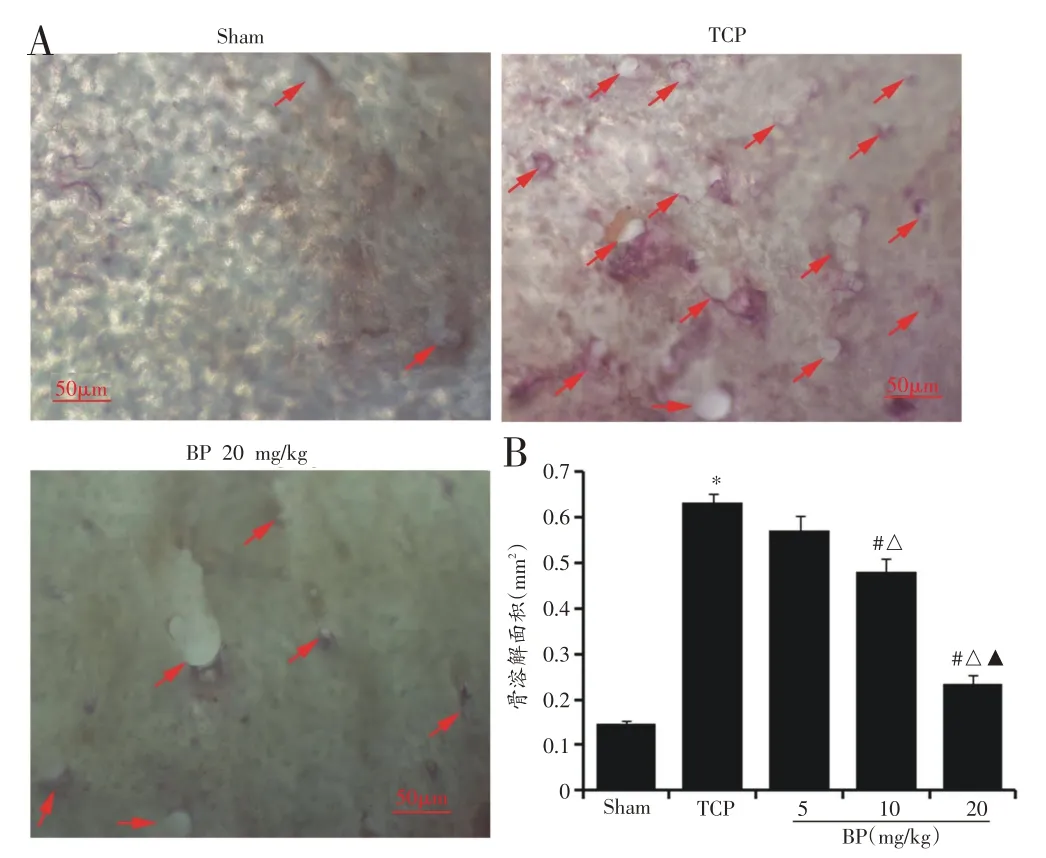
图1 TRAP染色观察小鼠假体周围骨溶解情况(n=6)
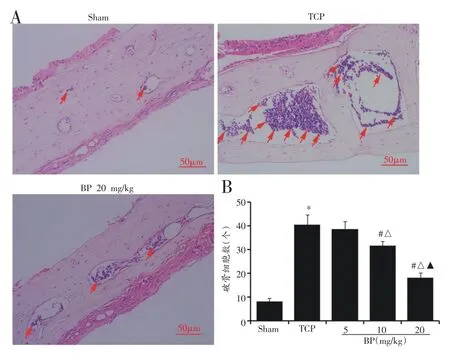
图2 HE 染色观察小鼠假体周围破骨细胞生成(n=6)

表2 各组小鼠血清中破骨细胞生成相关蛋白活性或含量的变化(n=12)
2.4 各组小鼠血清中炎症因子释放情况
与Sham组比较,TCP 组小鼠血清中TNF-α、IL-1β和IL-18水平明显增加,分别为Sham组的1.79倍、3.54倍和2.78 倍(表3,P<0.05);与TCP 组比较,BP 组小鼠血清中TNF-α、IL-1β和IL-18 水平明显减少(P<0.05,表3)。
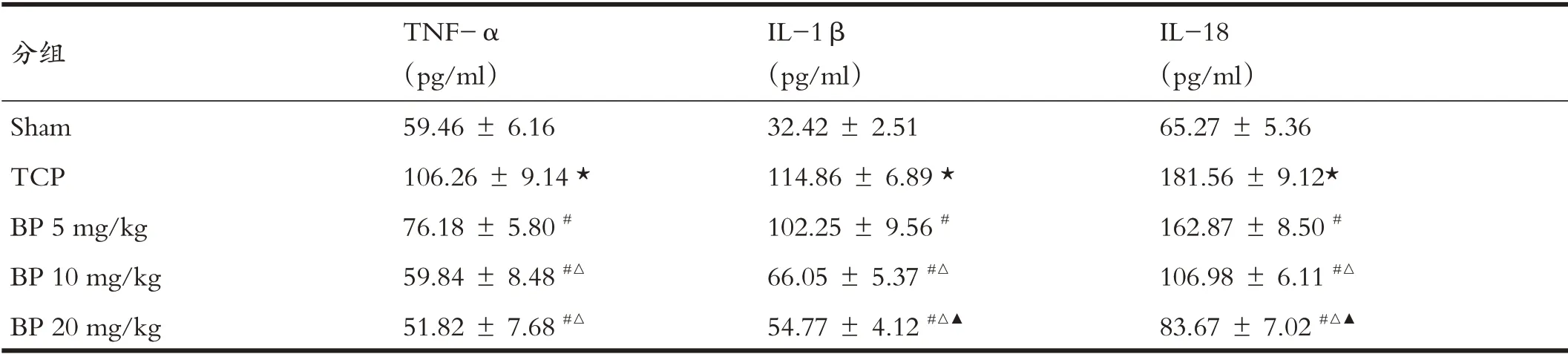
表3 ELISA法检测各组小鼠血清中炎症因子的水平(n=12)
2.5 各组小鼠假体周围骨组织炎症小体活化及细胞焦亡的比较
上述实验结果显示低剂量组(5 mg/kg)对TCP 磨损颗粒所致小鼠颅骨溶解及相关指标的影响不明显,且与TCP比较,差异无统计学意义(P>0.05),故在此仅设10 mg/kg 和20 mg/kg 两个剂量组研究BP 对炎症小体活化及细胞焦亡的影响。Western blot结果显示:与Sham 组比较,TCP 组小鼠假体周围骨组织中NLRP3、ASC、cleaved caspase-1和IL-1β表达均明显上调,血清中IL-1β、IL-18 水平和LDH 释放显著增加(图3,P<0.05)。与TCP 组比较,BP 组骨组织中NLRP3、ASC、cleaved caspase-1和IL-1β表达及血清中IL-1β、IL-18水平和LDH释放明显减少(表3、图3,P<0.05)。
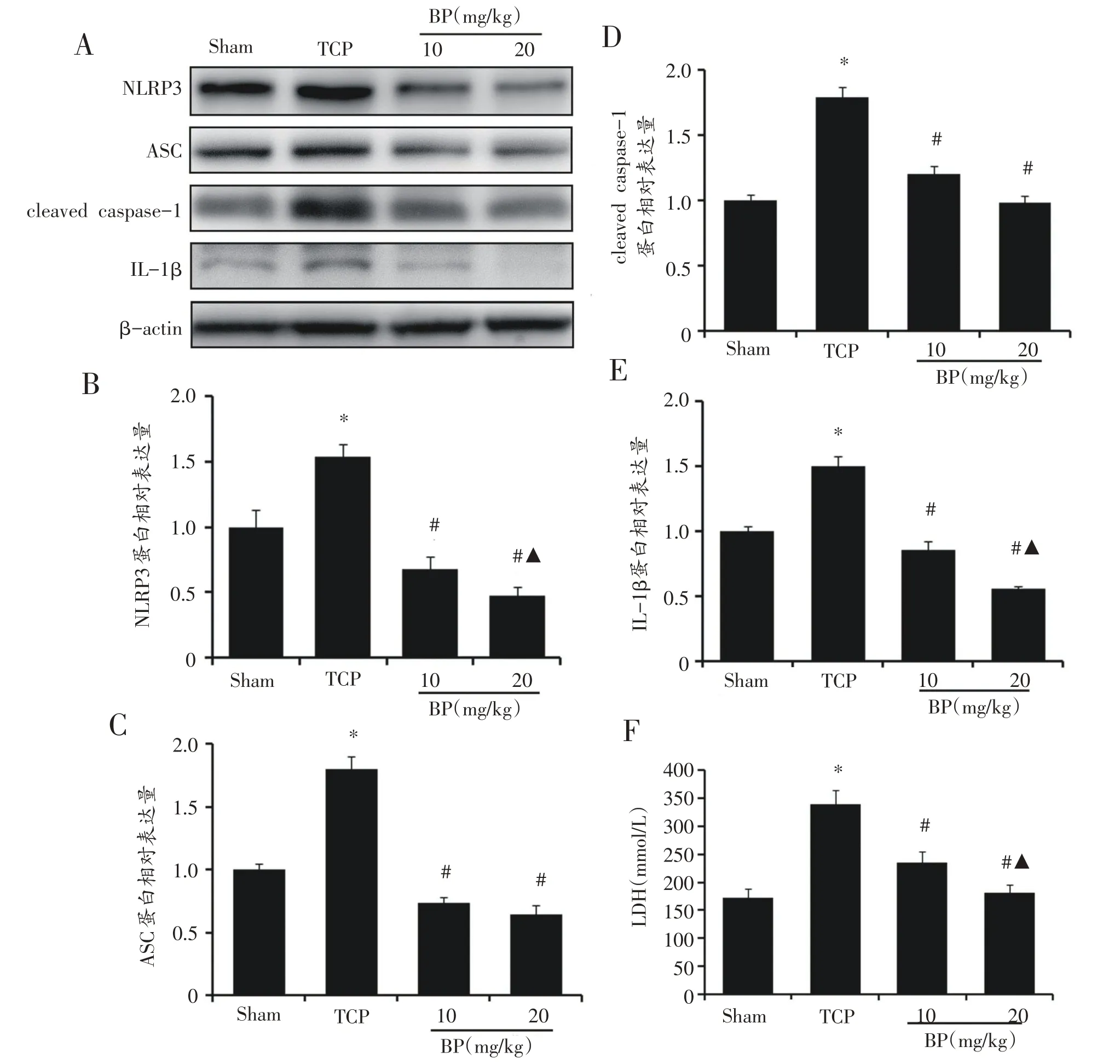
图3 Western blot法检测小鼠假体周围骨组织炎症小体的活化(n=6)
3 讨论
人工关节置换术是治疗终末期关节疾患、重建关节功能的重要手段。大量研究表明,人工关节假体经过长期磨损、碰撞会产生大量的磨损颗粒包埋于假体周围组织中,这些颗粒可诱导假体周围组织细胞释放多种炎症因子,促进假体周围破骨细胞分化、骨溶解和关节晚期松动,最终导致关节置换失败及关节二次翻修[1-3]。本研究首先应用TRAP 染色证实了TCP 磨损颗粒可诱导小鼠颅骨中缝发生明显的骨溶解,成功模拟了关节假体周围磨损颗粒诱导的骨溶解病理过程,与以往报道结果基本一致。这表明该模型可用于磨损颗粒诱导假体周围骨溶解的干预治疗。
佛手苷内酯是从天然食品佛手、新鲜芹菜、柠檬、欧芹和欧防风等中分离出来的一种香豆素类的化合物,具有抗炎、抗肿瘤和免疫调节等药理学作用。Ham等[9]报道佛手苷内酯(折算后剂量约为20 mg/kg)喂养能增加小鼠股骨和胫骨的骨密度(bone mineral density,BMD)和骨体积分数(bone volume density,BV/TV),抑制破骨细胞的分化及形成,减少高脂饮食或四氧嘧啶诱导的糖尿病小鼠骨质疏松症的发生。最近Chen[10]等研究认为腹腔注射佛手苷内酯(10 mg/kg、20 mg/kg)可显著抑制卵巢切除引起的骨质疏松小鼠胫骨的骨小梁结构的变化而发挥抗骨质疏松症作用。本研究结果显示佛手苷内酯(5 mg/kg、10 mg/kg、20 mg/kg)明显阻止假体周围破骨细胞生成及骨溶解,并呈一定的剂量依赖性。其中佛手苷内酯(20 mg/kg)对破骨细胞生成和骨溶解的抑制作用与Ham 等和Chen 等所报道的同剂量佛手苷内酯对卵巢切除或糖尿病所造成的骨质疏松症小鼠骨溶解的影响相似[9,10]。
有证据表明破骨细胞膜上高表达的核因子受体κB激活蛋白(receptor activator of nuclear factor-κB,RANK)和RANKL可诱导破骨细胞的分化[11],同时分泌TRAP、cathepsin K 和基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)等蛋白酶降解或溶解骨基质[12],最终形成骨吸收窝陷。因此,RANKL水平及破骨细胞特征蛋白TRAP和cathepsin K 活性的改变常用来反映破骨细胞分化程度及功能状态。本研究发现TCP磨损颗粒可明显增加血清中RANKL 水平,并显著上调TRAP 和capthesin K 的活性,促进破骨细胞的生成及骨溶解。而佛手苷内酯干预可剂量依赖性地抑制TCP磨损颗粒诱导的RANKL水平的上调及TRAP和cathepsin K活性的增加,阻止假体周围骨溶解和破骨细胞的生成。
以往研究和我们前期实验结果显示TCP磨损颗粒可刺激假体周围巨噬细胞、成纤维细胞、成骨细胞和骨细胞释放TNF-α、IL-1β、IL-6和IL-18等多种因子,这些破骨细胞活化因子可诱导破骨细胞活化并促进骨吸收,提示炎症因子在TCP 磨损颗粒诱导的假体周围骨溶解中发挥重要作用,可作为假体周围骨溶解和关节晚期松动的治疗靶点。本研究通过ELISA 法检测到TCP 磨损颗粒可诱导炎症因子的释放,增加血清中TNF-α、IL-1β和IL-18的含量;而佛手苷内酯干预可显著抑制上述炎症因子的释放,减轻炎症反应[4,13,14]及假体周围炎症性骨溶解。结合以往研究数据及本实验研究结果表明,佛手苷内酯具有较好的抗炎作用,它可通过减少炎症因子的释放而实现对TCP磨损颗粒诱导假体周围炎症性骨溶解的保护作用,但是其调控机制尚不明确。
炎症小体及细胞焦亡的激活可引起强烈的炎症小体反应,并诱导破骨细胞的分化、存活和骨吸收[15-17],表明炎症小体能调控炎症性骨吸收疾病。炎症小体是存在于细胞质中的一种蛋白复合物,由NLRP3、ASC 和caspase-1等3部分构成。NLRP3炎症小体被激活后通过接头蛋白ASC,募集半胱天冬氨酸蛋白酶1前体,进而自我催化加工形成切割型caspase-1;活化的caspase-1 能切割IL-1β和IL-18 前体使其形成成熟的IL-1β和IL-18 并分泌至胞外,促进细胞焦亡[18,19]。而抑制NLRP3 炎症小体的活化及细胞焦亡,将缓解上述NLRP3 的异常活化及相关炎症性疾病的症状[20]。Caiced等[21]证实敲除NALP3或ASC基因可阻止Co-Cr-Mo颗粒诱导的巨噬细胞THP1释放IL-1β;Pierre[22]则认为Ti 颗粒诱导巨噬细胞释放IL-1β与NALP3、ASC 和caspase-1的高表达密切相关。同样PMMA颗粒介导的炎症性骨溶解也与NLRP3的活化有关[23]。本研究结果显示TCP磨损颗粒可诱导NLRP3炎症小体的活化和细胞焦亡,表现为:与Sham组比较,TCP 组小鼠假体周围骨组织中NLRP3、ASC、cleaved caspase-1 和IL-1β表达均明显上调,血清中IL-1β、IL-18 水平和LDH 释放显著增加。综上,我们推测炎症小体参与调控磨损颗粒介导的炎症反应及破骨细胞生成和骨溶解。
佛手苷内酯干预可显著减弱TCP磨损颗粒诱导假体周围骨组织中NLRP3 炎症小体的活化与细胞焦亡,从而抑制caspase-1 的活化和成熟IL-1β和IL-18 等炎症因子及LDH 的释放,其趋势与佛手苷内酯对破骨细胞生成和骨溶解面积等指标的影响基本一致,这表明佛手苷内酯可通过减轻NLRP3 炎症小体的活化,抑制炎症因子的释放而阻止TCP磨损颗粒诱导的假体周围炎症性骨溶解。但是,关于佛手苷内酯是否影响炎症小体NLRP3活化之后的下游产物水平以及佛手苷内酯是通过何种信号转导途径抑制炎症小体NLRP3表达等问题还有待于后续进一步深入研究。
4 结论
佛手苷内酯可通过减弱炎症小体的活化和细胞焦亡,抑制炎症小体的释放而阻止TCP 磨损颗粒诱导的假体周围骨溶解及关节松动。
