人舌癌耐药细胞株OSC-19/CDDP 的多药耐药性检测及差异性表达microRNAs 的筛选
2020-04-28杨晓红胡小华钟雯怡张立刚
杨晓红, 胡小华, 钟雯怡, 杨 琨, 易 杰, 姚 礼, 张立刚
(遵义医科大学附属口腔医学院,贵州 遵义 563000)
舌癌是最常见的口腔恶性肿瘤,占全部恶性肿瘤的1.19%。 舌癌的治疗方法主要为手术、放疗、化疗或中西医综合治疗[1]。 含CDDP 的化疗方案一直是首选且高效的治疗方案,然而3~5 个疗程的化疗往往收效甚微,这是由于耐药性的产生使化疗药物起不到其应有的作用。 因此,如何解决耐药问题是抗肿瘤研究的当务之急。
肿瘤耐药可分为原发性耐药和获得性耐药,而获得性耐药可分为原药耐药 (primary drug resistance,PDR)和多药耐药(multidrug resistance,MDR)。 MDR 是临床化疗效果不佳的主要原因[2],也是困扰肿瘤治疗的一大难题。 目前,国内口腔癌研究领域的舌鳞癌多药耐药细胞株较为稀有,严重制约了口腔癌多药耐药机制研究。 在前期研究中,我们以舌鳞癌细胞株OSC-19 为亲本,采用递增CDDP 浓度的方法,诱导制备了耐CDDP 的细胞株OSC-19/CDDP[3],但其是否具有多药耐药性,尚需实验证实。
近年来的研究发现,miRNA 在肿瘤的发生、发展及耐药等过程中发挥重要的调控作用,仅在人舌癌细胞中就先后发现有miRNA-23a (miR-23a)[4]、miR-21[5]及miR-485[6]等近10 个miRNA 可靶向各自的靶基因调控耐药。 但与人肺癌、乳腺癌细胞等中均有近10 个可调控耐药的miRNA 相比,未被发现的miRNA 及其靶基因还有很多。 本研究通过对比OSC-19/CDDP 细胞株与其亲本OSC-19 中差异表达的miRNA, 期望找到更多调控舌癌多药耐药的miRNA, 并为探讨这些miRNA 调控舌癌多药耐药机制奠定基础。
1 材料和方法
1.1 材料
OSC-19 细胞株: 购买于中国科学院上海细胞库,来源于61 岁亚洲男性人舌鳞癌组织,呈上皮样贴壁生长。 OSC-19/CDDP 细胞株:由本课题组采用浓度逐步递增CDDP 不间断方法诱导制备[3]。 试剂:胎牛血清(Gibco 公司,美国),青霉素和链霉素(华北制药公司, 中国),DMEM 高糖培养基 (Gibco 公司,美国),胰蛋白酶(Gibco 公司,美国),CCK-8 试剂盒( 武汉博士德生物工程有限公司),细胞裂解液(北京索莱宝科技有限公司),RT-PCR 试剂盒(Takara 公司,日本),细胞总RNA 提取试剂盒(宝生物工程有限公司,日本),反转录试剂盒(Thermo 公司,美国)。药品:CDDP (武汉大华伟业医药化工有限公司,批号: 20160113),PTX(海南卓泰制药有限公司,批号:20161206),5-Fu (上海旭东海普药业有限公司,批号: 20161107),注射用PYM(吉林敖东集团延吉股份有限公司,批号:20160512)。 仪器:倒置相差显微镜(奥林巴斯公司,日本),CO2细胞培养箱(Thermo公司,德国),RT-PCR 荧光检测仪(Applied Biosystem 公司,美国)。 其他:Agilent miRNA 微流体芯片(上海康成生物工程有限公司)。
1.2 CCK-8 法检测OSC-19/CDDP 细胞耐药性
将处于对数生长期的OSC-19 和OSC-19/CDDP细胞以6×103个/孔的数量接种到96 孔板中, 每孔含100 μL DMEM,混合均匀后,常规条件下培养24 h,使细胞贴壁。 弃去每孔上清液,设置空白对照组: 不加细胞仅含培养液; 阴性对照组: 不加药物仅加细胞; 实验组: 加入药物CDDP、PTX、5-FU、PYM。按照质量浓度梯度给予100 μL 药物培养液, 每一质量浓度平行5 个复孔作为实验组。 另设置5 孔仅加入细胞和培养液的阴性对照组及5 孔没有加入细胞的空白对照组。 培养48 h 后,每孔加入10 μL CCK-8 及90 μL 不含胎牛血清的培养液,37℃下孵育1 h, 酶标仪测450 nm 处的吸光度值。 按公式1计算细胞存活率,并用GraphPad Prism 5 软件拟合量效关系,求半数抑制浓度值(IC50)后按公式2 计算耐药指数(resistance index,RI)。

1.3 RT-PCR 检测OSC-19 及OSC-19/CDDP 细胞的多药耐药基因1(MDR1)的表达
对数生长期收集2 组细胞, 分别提取总RNA,测定RNA 浓度,cDNA 试剂盒合成扩增细胞cDNA。以GAPDH作为内参,按照Takara 试剂盒说明书设计各组细胞反应体系及反应条件。 实验重复3 次以上,引物由Takara 公司合成。各基因引物序列见表1。

表1 基因引物序列Table 1 Primer sequences used for RT-PCR
1.4 miRNA 微阵列芯片筛选
待OSC-19 及OSC-19/CDDP 细胞融合达到85%时, 使用细胞裂解液提取RNA 行miRNA 微阵列芯片检测。
1.5 RT-PCR 验证miRNA 微阵列芯片的结果
按照Takara RT-PCR 试剂盒产品使用说明书,对由OSC-19 及OSC-19/CDDP 细胞所提取的RNA进行反转录反应,并用RT-PCR 仪进行检测。 miRNAs RT-PCR 引物在广州市锐博生物科技有限公司定制。
1.6 统计学分析
实验数据采用SPSS 17.0 软件进行统计学分析,实验结果以±s表示,组间比较采用两独立样本t检验分析,检验水平为α=0.05。
2 结果
2.1 OSC-19/CDDP 细胞耐药性检测
OSC-19 及OSC-19/CDDP 细胞在半数致死量浓度的CDDP、PTX、5-FU、PYM 作用后, 细胞形态见图1。 经CCK-8 法检测及GraphPad Prism 5 软件拟合量效关系,得出OSC-19 及OSC-19/CDDP 细胞对CDDP 的半数抑制浓度(IC50) 分别为4.55 μg/mL 及79.06 μg/mL,耐药指数(RI)为16.70(表2)。 OSC-19/CDDP 细胞对PTX、5-Fu 和PYM 产生明显耐药性,耐药指数分别为7.93、5.31 和3.01。 说明经低浓度持续增量方式诱导形成的人舌鳞癌耐药细胞株OSC-19/CDDP 能产生显著的耐药性,并对其他化疗药物产生交叉耐药性。
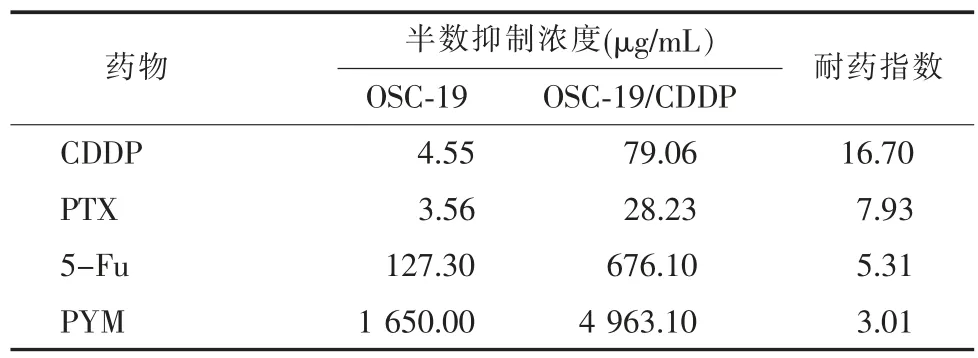
表2 抗肿瘤药物对于OSC-19 及OSC-19/CDDP 细胞的半数抑制浓度及耐药指数Tabel 2 The resistance index and median inhibitory concentration of antitumor drug to OSC-19 and OSC-19/CDDP
2.2 OSC-19 及OSC-19/CDDP 细胞MDR1 基因表达情况
由图2 可以观察到,OSC-19 和OSC-19/CDDP中MDR1基因信使RNA(mRNA)的表达变化。 RTPCR 结 果 采 用2-ΔΔCT方 法 分 析,OSC-19/CDDP 细 胞中MDR1mRNA 的相对表达量是OSC-19 细胞的(15.23±1.37)倍(P<0.05)。

图1 半数抑制浓度CDDP、PTX、5-FU、PYM 作用下的OSC-19 及OSC-19/CDDP 细胞形态(×40)Figure 1 Morphology of the OSC-19 and OSC-19/CDDP cells under the LD50 concentration of CDDP,PTX,5-FU,PYM respectively(×40)
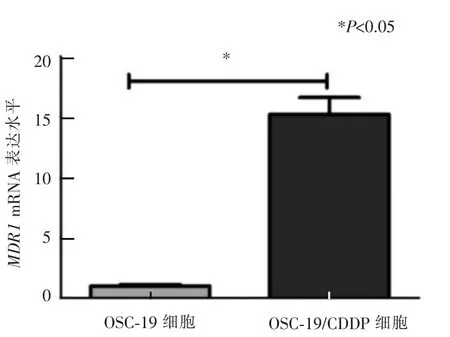
图2 OSC-19 与OSC-19/CDDP 细胞MDR1 的mRNA 表达情况Figure 2 The MDR1 gene expression level of OSC-19 and OSC-19/CDDP
2.3 微阵列芯片结果
通过对体外培养的OSC-19/CDDP 细胞及其亲本(OSC-19 细胞) 进行miRNA 芯片筛查, 发现了OSC-19/CDDP 细胞与其亲本有264 个miRNAs 表达存在差异,其中29 个miRNAs 的差异≥10 倍(17 个miRNAs 表达量增加超过10 倍,12 个miRNAs 表达量降低超过10 倍)。 我们选择了5 个miRNAs 进行RT-PCR 检测(表3),并对芯片结果进行验证,RTPCR 结果与芯片结果基本一致,证明了芯片筛查结果的可靠性及可重复性(图3)。
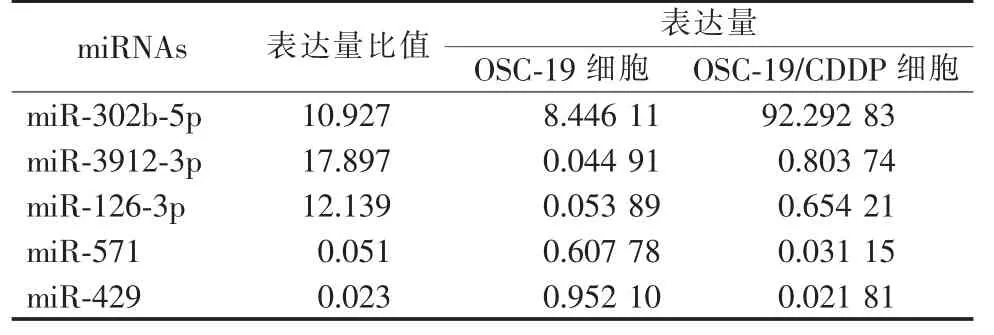
表3 微阵列芯片筛查差异表达的miRNAsTable 3 The miRNAs differentially expressed in micro-arraychip
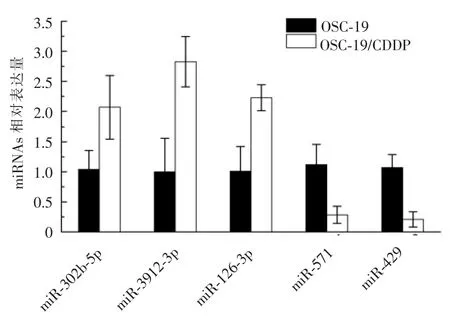
图3 OSC-19/CDDP 及OSC-19 细胞中miRNAs 的表达水平Figure 3 The results of miRNAs expression level of cell of OSC-19/CDDP and OSC-19
3 讨论
肿瘤多药耐药(MDR)是指肿瘤细胞对某一抗肿瘤药物产生耐药性的同时,对其他结构和作用机制不同的抗肿瘤药物也产生交叉耐药性。 转运蛋白介导药物摄取能力减弱或药物外排增加是MDR 产生机制之一。 物质从细胞内排出主要依赖于细胞膜上的一组腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)依赖的药物泵,即ABC(ATP-binding cassette)转运子家族。 作为ABC 超家族成员之一的糖蛋白(P-gP) 及其编码基因MDR1是测细胞耐药性形成的标志性蛋白[7]。在本研究中,通过RT-PCR 检测发现OSC-19/CDDP 多药耐药株中MDR1表达显著高于其亲代细胞。 同时,3 种不同种类、作用机制各异的药物(PTX、5-Fu 和PYM)对OSC-19/CDDP 细胞的耐药指数, 也证明了该细胞株具有多药耐药的特性。
大量研究证实,miRNAs 不仅可调控肿瘤的发生、发展,还可调控耐药性的发生和发展,但miRNA介导的耐药具有多样性和复杂性:1 个miRNA 可以同时调控2 个或2 个以上的靶基因, 而1 个靶基因又可能受多个miRNA 的调控。 例如,同样是通过转录后负调控ABC 转运蛋白使肿瘤细胞产生CDDP耐 药, miR-200c[8]、miR-451[9]和miR-186[10]等 分 别 在乳腺癌、结肠癌和卵巢癌中显示了类似的功能。 又如,miR-27a 可以在乳腺癌中调控CDDP 耐药[11],在卵巢癌中调控PTX 耐药[12],在肝癌中调控多药耐药[13]。这些研究说明miRNA 在调控不同药物诱导的不同组织来源细胞耐药时,既有组织特异性,也有一定的共性。 而在人舌癌细胞的研究中,已证实参与耐药调控的miRNAs 仅仅不足10 个,仍有大量的miRNAs 尚待挖掘。 本研究中,通过miRNA 微阵列芯片检测发现,在OSC-19/CDDP 细胞与其亲本中有264 个miRNAs 的表达存在差异,其中有17 个miRNAs 表达量增加超过10 倍,12 个miRNAs 表达量降低超过10 倍。 靶基因预测软件的结果显示,这些差异显著的miRNAs 的靶基因包括MDR1、 核苷酸切除修复交叉互补基因1 (ERCC1)、Bcl-2基因等,均可调控相应的蛋白表达,通过降低细胞内药物浓度、增强DNA 的修复能力、调控细胞凋亡等途径导致耐药现象的产生。 但可调控舌癌多药耐药的miRNAs 数目众多,其靶基因的功能较复杂,要在众多miRNAs 及其靶基因中找到导致舌癌细胞多药耐药的关键机制,尚需进一步研究。
综上所述,人舌鳞癌耐药细胞株OSC-19/CDDP具有多药耐药的生物学特性,可作为舌鳞癌的CDDP 耐药机制及多药耐药机制研究的理想细胞模型, 细胞中显著差异表达的miRNAs 可能在舌鳞癌耐药的发生、发展中发挥重要作用。
