体温保护对口腔癌患者术后加速康复的影响
2020-04-28赵保建邵博明董迎春
张 雪, 赵保建, 邵博明, 董迎春
(南京大学医学院附属口腔医院,南京市口腔医院麻醉科,江苏 南京 210008)
临床上把核心体温<36 ℃定义为低体温[1]。 口腔癌患者由于手术时间长、体表面积暴露大、术中出血量大及液体出入量多等原因, 术中低体温的发生率高达25%~90%[2-3]。 低体温是患者围术期严重的并发症之一, 不仅会引起寒战、 麻醉苏醒延迟,而且影响凝血和免疫功能,增加心血管事件发生率和感染风险,从而影响患者康复[4]。 因此,体温监测目前已成为围术期患者生命体征监测的重要组成部分, 术中进行体温保护对保障患者围术期的安全、促进术后加速康复具有重要意义。 本研究拟回顾性研究体温保护技术对口腔癌患者术中体温的保护作用及术后康复的影响, 为加速患者康复提供临床依据。
1 资料和方法
1.1 一般资料
本研究已获南京市口腔医院伦理委员会批准,患者均签署知情同意书。 选择我院2018-01—2019-06 行“口腔癌根治+加游离皮瓣转移修复术”的患者共98 例,其中男性51 例,女性47 例,年龄40~75岁。 美国麻醉医师协会 (American society of anesthesiologists, ASA)分级I~Ⅲ级。 将患者分为保温组和对照组,每组各49 例。 纳入标准:行“根治术+游离皮瓣转移修复术”的口腔癌患者,术前无凝血功能障碍,身体质量指数(body mass index,BMI)为18~30 kg/m2。 排除标准:术前体温异常,存在感染,严重的心血管、呼吸或内分泌系统疾病。
1.2 方法
手术室温度设置在22~24 ℃。 患者入室后监测心率(HR)、血压(BP)、血氧饱和度(SaO2)和心电图(ECG),建立外周和中心静脉通道。 所有患者给予常规静脉诱导,咪达唑仑0.02~0.05 mg/kg,丙泊酚1.5~2.0 mg/kg,顺式阿曲库胺0.3 mg/kg,舒芬太尼0.3~0.5 μg/kg。 术中脑电双频指数(bispectral index,BIS)维持在40~60。 对照组在非手术区时以铺巾和棉被覆盖, 术中的静脉输入液和冲洗液均为常温。保温组身下铺电阻式加温垫(Warm6100,北京英泰诺医疗科技有限公司,中国),温度设为37 ℃,术前10 min 打开,术中患者体温到达37 ℃时,关闭电阻式加温垫以维持体温恒定。 提前2 h 将术中的输入液和冲洗液置入37 ℃保温箱。麻醉维持:静脉输注丙泊酚4~6 mg·kg-1·h-1、瑞芬太尼5~10 μg·kg-1·h-1、顺苯磺阿曲库铵0.1 mg·kg-1·h-1,吸入七氟醚l%~3%。术后患者均在全麻状态下进入PACU 复苏,待意识清醒、呼吸正常和肢体张力恢复后(Steward 苏醒评分为6 分),保留气管导管送回监护病房。
1.3 观察指标
观察并记录手术室温度;使用红外线鼓膜耳温计测量患者核心温度,记录2 组患者麻醉前(T1)、麻醉后1 h(T2)、麻醉后2 h(T3)、麻醉后4 h(T4)、麻醉后6 h(T5)、转入PACU(T6)和转出PACU(T7)时的核心温度;记录麻醉时间、麻醉用药、手术时间和复苏时间(患者进入复苏室至Steward 苏醒评分为6分的时间);记录术中出血量、输血量、输液量、冲洗液量和尿量;记录术后寒战发生率,切口、气道或泌尿道感染率,非计划性二次手术发生率及住院时间。
1.4 统计学分析
采用SPSS 16.0 软件进行统计学分析。 正态分布的计量资料以(±s)表示,组内不同时间点比较采用重复测量的方差分析, 组间比较采用独立样本t检验,计数资料用率n(%)表示,组间比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 2 组患者一般临床资料比较
患者年龄、性别、BMI、ASA 分级比较,差异均无统计学意义(P>0.05,表1)。
2.2 2 组患者不同时间点核心温度的比较
如表2 所示, 保温组在T1、T2节点时的核心温度为(37.03±0.14)℃(36.8~37.3 ℃)和(36.91±0.20)℃(36.4~37.3 ℃),相比对照组的(37.01±0.17) ℃(36.6~37.3 ℃)和(36.88±0.28) ℃(36.1~37.3 ℃),差异无统计学意义(P>0.05);2 组患者在T3~T7节点时,体温较T1节点时下降显著(P<0.05);保温组在T3~T7节点时的核心温度分别为 (36.89±0.25) ℃(36.1~37.3 ℃)、(36.86±0.27) ℃(36.0 ~37.3 ℃)、(36.84±0.34) ℃(36.0~37.3 ℃)、(36.80±0.33) ℃(36.0~37.3 ℃)和(36.78±0.37) ℃(36.0~37.3 ℃), 明显高于对照组的(36.64±0.35) ℃(36.0 ~37.2 ℃)、(36.22±0.44) ℃(35.4 ~37.0 ℃)、(35.80±0.42) ℃(35.0 ~36.5 ℃)、(35.57±0.40) ℃(34.8~36.1 ℃) 和 (35.44±0.42) ℃(34.7~36.1 ℃),差异有统计学意义(P<0.05)。

表1 2 组患者临床资料比较(n/%)Table 1 Comparison of clinical data between the two groups(n/%)

表2 2 组患者不同时间点核心温度的比较(℃)Table 2 Comparison of core temperature at different time points between the two groups (℃)
2.3 两组患者术中和术后情况比较
保温组麻醉时间为(453.32±40.61) min (380~522 min),手 术 时 间 为(421.36±42.46) min(350~480 min),相比对照组的(458.89±38.75) min(392~515 min)和(428.42±36.65) min(361~479 min),差异无统计学意义(P>0.05);2 组患者手术室温度,麻醉用药,术中输液量、冲洗液量和尿量差异无统计学意义 (P>0.05); 保温组患者出血量为 (548.68±178.01) mL (100~1 250 mL), 输血量为 (207.50±334.28) mL (0~1 000 mL), 明 显 少 于 对 照 组 的(623.68±267.81) mL (100~1 200 mL) 和(289.50±416.53) mL(0~1 300 mL)(P<0.05);保温组复苏时间为(37.60±14.92) min(10~75 min),住院时间为(20.52±2.77) d (16~25 d), 明显短于对照 组的(53.46±25.65) min(20~165 min)和(25.64±5.31) d(17~39 d),差异有统计学意义(P<0.05)。 详见表3。
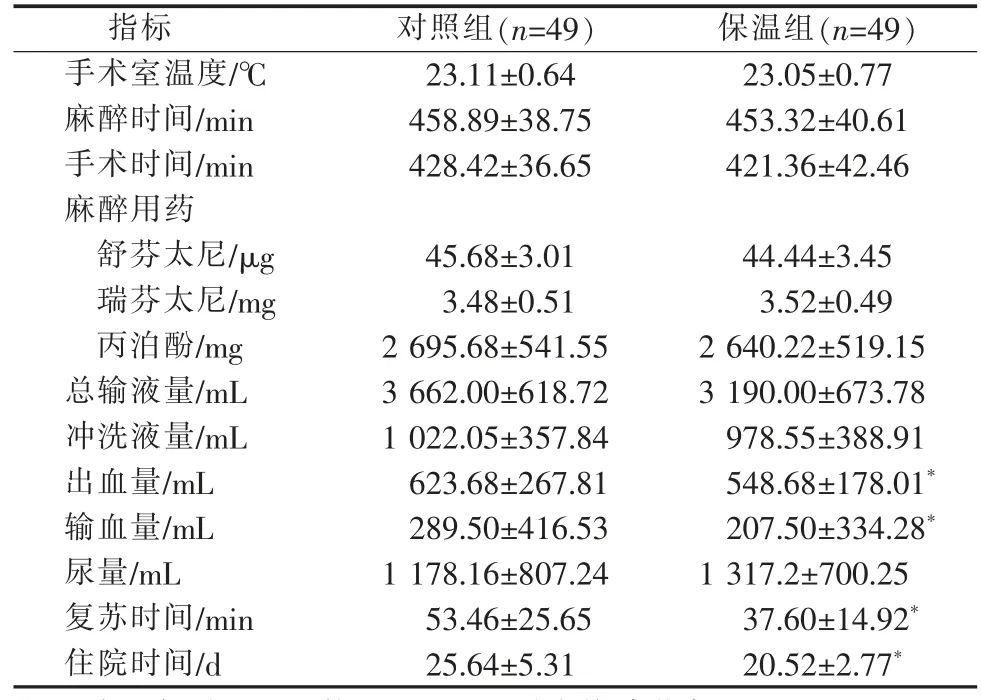
表3 2 组患者术中和术后情况的比较Table 3 Comparison of intraoperative and postoperative conditions between the two groups
2.4 2 组患者术后并发症发生率比较
保温组术后寒战发生率为4.08%, 显著低于对照组的34.69%,差异有统计学意义(P<0.05);保温组术后感染发生率为2.04%, 显著低于对照组的16.32%,差异有统计学意义(P<0.05);保温组术后非计划性二次手术发生率为6.12%, 对照组为8.16%,2 组差异无统计学意义。 详见表4。

表4 2 组患者术后并发症发生情况比较(n/%)Table 4 Comparison of postoperative complications between the two groups (n/%)
3 讨论
近年来加速康复外科 (enhanced recovery after surgery,ERAS)理念在我国迅速普及,该路径的实施大大降低了术后并发症,缩短了住院时间,并且提高了某些肿瘤患者的远期生存率[5]。 体温保护是ERAS 的重要组成部分[6]。研究表明体温保护能显著降低胃癌根治术患者术中的出血量和输血量,降低感染发生率,缩短住院时间[7]。 Jones 等[8]认为,术中维持正常的体温不仅能够降低不良反应,如恶心呕吐的发生率, 并且能降低近期并发症的发生率,如持续性胆漏或短暂性肝功能不全等。 目前,关于术中体温保护对口腔癌患者术后康复影响的文献报道较少,本研究对此进行了回顾性分析。 研究结果发现,对照组患者随着手术时间的延长,体温逐渐降低,在麻醉后2 h 出现了低体温,并一直持续到复苏结束,而保温组采用电阻式加温垫及液体保温的方式将患者体温一直维持在36 ℃以上, 避免了术中低体温的发生。
此外,保温组患者术中出血量和输血量均较对照组小,排除了手术者和术式的影响,也许与低体温引起的凝血机制改变相关。 有学者发现,围术期患者发生低体温时, 凝血酶活性和血小板功能减低,术中出血量增加,从而增加了术中输血和术后血肿形成的可能性[9]。 本研究未发现2 组患者术后血肿发生率的差异,考虑与其发病率低、样本量少有关。
寒战是机体处于低体温的保护性反应,10%~66%的患者在麻醉恢复期会发生寒战反应[10]。 寒战时骨骼肌收缩会导致患者血压升高、 低氧血症,增加心脑血管意外的发生率。 本研究中,体温保护患者术后寒战的发生率仅为4.08%, 而对照组高达34.69%。 另外,在2 组患者手术时间和麻醉用药没有显著差别条件下, 保温组患者复苏时间显著短于对照组,苏醒质量高。 由于适当的体温增高可使麻醉药物代谢变快,体温每升高1 ℃,药物代谢率增加6%[11],这应该是产生上述结果的主要原因。
Eng 等[12]回顾性研究发现,手术切口部位感染的结肠癌患者较非感染患者术中低体温发生率更高、低体温的时间更长。 本研究中保温组手术切口、气道和泌尿道感染总发生率显著低于对照组。 围术期低体温抑制先天性髋关节脱位手术患者的免疫功能,引起术中血液中转化生长因子β(transforming growth factor-β,TGF-β),白细胞介素10(interleukin-10,IL-10) 含量显著降低; 肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α),白细胞介素1β(interleukin-1β,IL-1β)含量显著升高[13]。 有关本研究中低体温引起感染率增高的原因还需要进一步分析。
口腔癌患者术中经常需要游离皮瓣如前臂瓣、股外侧皮瓣或腓骨肌皮瓣来修复巨大的面部缺损,游离皮瓣需要进行显微外科的血管吻合[14-15]。 低体温影响最大的是心血管系统,儿茶酚胺的释放不仅诱发心肌缺血、急性心肌梗死和心律失常,而且引起外周血管收缩、血流速度变慢[16]。一方面提高了吻合血管时的难度,另一方面可能增加吻合后血管栓塞的概率和下肢深静脉血栓的发生率,以及非计划二次手术的发生率,延长住院时间。
本研究发现,2 组患者麻醉后2 h 体温开始明显下降。 因此建议每个口腔癌手术患者进行常规术中连续体温监测,对于体温比术前低0.4 ℃或体温<36.6 ℃的患者要采取保温措施, 如术中静脉37 ℃保温输液等方法, 特别应避免发生体温<36 ℃的情况,影响到患者康复。 除此之外术中进行体温保护时应注意以下问题:①体温维持在>36 ℃水平,同时避免体温过高; ②体温保护装置一般为用电装置,应注意有无破损,以免漏电;③注意体温探头位置准确,能够如实反映准确的体温。
本研究的局限性在于该回顾性研究中的记录指标不够全面,对术中出现的心律失常如房性期前收缩、心房颤动和室性期前收缩等未做记录。 另外,因无血栓弹力图仪,未进行各项凝血成分的功能监测,亦未进行针对性的成分输血。
综上所述,体温保护能够有效预防口腔癌患者围术期低体温的发生, 提高复苏质量, 降低术后感染率和非计划二次手术的发生率, 缩短住院时间,从而加速患者术后康复。
