沉默信息调节因子3 对舌癌细胞凋亡的影响
2020-04-28周骥驰杨金锁殷博雅
袁 玮, 周骥驰, 李 曼, 程 龙, 杨金锁, 殷博雅, 黄 欣
(首都医科大学附属北京口腔医院口腔颌面头颈肿瘤外科,北京 100050)
舌癌是口腔癌中最常见的上皮源性鳞状细胞癌,其发病率及死亡率呈逐年上升趋势[1],具有侵袭性较强、病情发展快、预后较差等特点[2]。 据统计,舌癌的5 年生存率为63%左右[3]。 舌癌的发生机制尚未完全阐明,因此,探索口腔癌的分子机制,对制订有效治疗方法,延长患者生存时间和改善生存质量等方面发挥着重要作用。 沉默信息调节因子3(SIRT3)是线粒体内主要的去乙酰化酶,广泛分布于成人和胚胎组织中。 目前已有的研究发现SIRT3在卵巢癌、肾癌、结直肠癌中异常表达,提示SIRT3可能与肿瘤形成相关[4]。 在分子水平上,SIRT3 低表达与线粒体氧化应激和腺嘌呤核苷三磷酸消耗有关[5]。 此外,有研究发现SIRT3 减少可以诱导线粒体功能障碍和细胞凋亡,SIRT3 可通过修饰Src/Fak 信号通路抑制癌症迁移[6]。 目前,有关SIRT3 在舌癌发生、 发展过程中作用的研究较少, 因此明确SIRT3在舌癌细胞凋亡中的作用,对进一步研究SIRT3 对舌癌进展的影响,分析其分子机制,寻找舌癌治疗的分子靶向药物等具有重要意义。
1 材料和方法
1.1 细胞培养
本研究使用的舌癌细胞系SCC-15 和SCC-9 购于美国模式菌种收集中心 (American type culture collection, ATCC), 均培养于含有10%胎牛血清的LDMEM 培养基中,在5%CO2、37 ℃孵箱中常规培养。
1.2 实验试剂与仪器
10%胎牛血清(HyClone 公司, 美国),LDMEM培养基(Thermo Fisher Scientific 公司,美国),Lipofectamine 2000 试剂盒(Invitrogen 公司,美国),siRNA1-SIRT3 和siRNA2-SIRT3(扬州瑞博生物科技有限公司,中国),MTT 反应液(Beyotime 公司,中国),酶标仪(490 nm,BioTek Instruments Inc.,美国),TUNEL凋亡试剂盒(Beyotime 公司,中国),ATP 酶联免疫分析试剂盒 (Beyotime 公司, 中国),RIPA 裂解液(Beyotime 公司,中国)。
1.3 siRNA 转染抑制SIRT3 的表达
收集对数生长期的SCC-15 与SCC-9 舌癌细胞,以每孔5×105个的细胞数量接种于6 孔板中,于含5%CO2、37 ℃的培养箱中培养24 h, 使用Lipofectamine 2000 试剂盒分别转染siRNA1-SIRT3 和siRNA2-SIRT3,以阴性siRNA 转染为对照组。 细胞转染48 h 后,Western blot 检测SIRT3 的沉默效率。
1.4 MTT 法和TUNEL 染色检测siRNA 转染后细胞增殖活性和凋亡指数
MTT 法检测舌癌细胞增殖活力。收集对数生长期的SCC-15 与SCC-9 舌癌细胞,以每孔1×104个的细胞数量接种于96 孔板中,在含5%CO2、37 ℃孵箱中常规培养2 h 后分别转染siRNA1-SIRT3 和siRNA2-SIRT3,以阴性siRNA 转染为对照组。转染后继续培养24 h,倒掉培养液,每孔加入MTT 反应液,常规培养2 h 后,使用酶标仪记录MTT 反应液的光学密度(optical density,OD)。
TUNEL 染色检测舌癌细胞凋亡。细胞转染方法以及对照组设定同“1.3”。转染24 h 后,制备细胞爬片,固定,按照TUNEL 凋亡试剂盒(cat. no.: C1086)说明书步骤操作。 显微镜下计数凋亡细胞数及总细胞数,计算凋亡指数。
1.5 凋亡蛋白Caspase-3 的检测
细胞转染方法同“1.3”,以阴性siRNA 转染为对照组。 细胞转染48 h 后, 取培养液, 使用小鼠ATP 酶联免疫分析试剂盒检测Caspase-3 活性。 同时,用RIPA 裂解液(cat. no.: P0013C)裂解细胞,应用BCA 试剂盒(cat. no.: P0009)测蛋白浓度,SDSPAGE 技 术 检 测Pro-Caspase-3、Cle-Caspase-3 以 及Cle-Caspase-3 的 底 物(PARP)的 表 达,以GAPDH为内参。
1.6 统计学分析
本研究中呈现的所有结果均来自至少3 次独立实验。使用SPSS 16.0 进行统计学分析。通过单因素方差分析对本研究中的所有结果进行分析,然后进行Tukey 检验, 以P<0.05 认为差异具有统计学意义。
2 结果
2.1 Western blot 检测舌癌细胞的沉默效率
首先在SCC-15 细胞和SCC-9 细胞中转染了靶向沉默SIRT3 的siRNA1-SIRT3 和siRNA2-SIRT3,Western blot 证实转染有效(图1)。
2.2 MTT 法检测舌癌细胞的增殖活力下降
在上述基础上进行MTT 法, 结果显示SIRT3沉默对SCC-15 细胞增殖的抑制率分别为 (55±0.99)%和(58±2.83)%(图2A);SIRT3 沉默对SCC-9细胞增殖的抑制率分别为 (58±3.14)%和 (59±2.91)%(图2B)。 揭示SIRT3 沉默明显抑制了舌癌细胞增殖。
2.3 SIRT3 沉默促进舌癌细胞凋亡
为了研究SIRT3 在舌癌细胞凋亡中的作用,了解SCC-15 和SCC-9 细胞增殖活力的降低是否归因于细胞凋亡的增加,我们又进行了TUNEL 染色。 结果显示,与对照组相比,转染siRNA-SIRT3 使SCC-15 细胞TUNEL 阳性细胞比例分别增加至 (55±4.08)%、(53±3.04)%(图3A、3B); 转染siRNA-SIRT3使SCC-9 细胞TUNEL 阳性细胞比例分别增加至(54±2.71)%、(55±2.65)%(图3C、3D),表明SIRT3 沉默促进了SCC-15 细胞和SCC-9 细胞的凋亡。
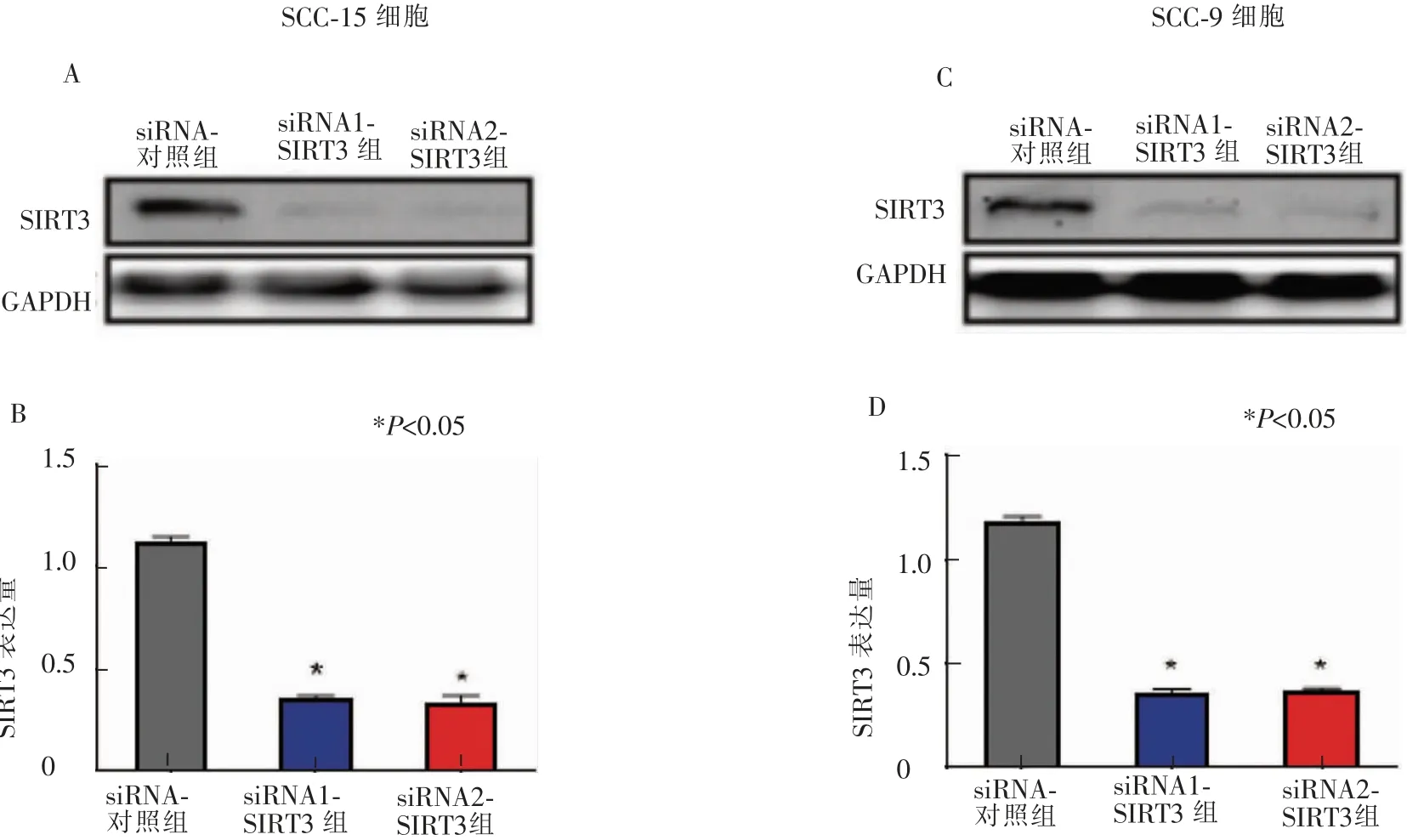
图1 Western blot 显示SIRT3 siRNA 转染到SCC-15 和SCC-9 舌癌细胞后的沉默效率Figure 1 Expression levels of SIRT3 protein in SCC-15 and SCC-9 cell lines detected by western blot

图2 MTT 法分析SIRT3 沉默后的舌癌细胞增殖活力Figure 2 MTT assay showing the changes in proliferation of SCC-15 and SCC-9 cells following the transfection
同时, 通过ELISA 检测也发现Caspase-3 活性增加(图4A、4B)。 不仅仅是Caspase-3 激活,通过Western blot 实验发现切割的Caspase-3 和PARP(Caspase-3 激活的底物) 也响应SIRT3 siRNA 而表达增加(图4C~4H),揭示着SIRT3 沉默明显促进了SCC-15 和SCC-9 细胞中的Caspase-3 活性以及Caspase-3 和PARP 的表达。 综上所述,证实SIRT3沉默可以明显促进舌癌细胞凋亡。
3 讨论
近年来,SIRT3 的作用逐渐受到人们的关注,SIRT3 是新发现的一种抑癌基因, 主要存在于线粒体内,其作用是对线粒体的结构及功能进行调节,包括线粒体氧化还原平衡、线粒体Ca2+管理、线粒体自噬、线粒体能量代谢[7]。 近年来有研究显示,线粒体裂变通过多种机制与细胞凋亡相关[8]。 此外,SIRT3 能调节肿瘤发生的不同进程,且在肿瘤细胞中具有致癌剂与抑癌剂的双重成分, 其机制也与它可通过调节氧化应激引起癌细胞凋亡有关[9]。 因此,SIRT3 在不同的肿瘤组织中有着不同的功能,这种功能具有细胞和肿瘤特异性。 但SIRT3 与舌癌的相关性研究目前不多, 不能充分证明SIRT3与舌癌有确切关系。

图3 TUNEL 染色分析SIRT3 沉默后舌癌细胞的凋亡Figure 3 Effect of SIRT3 knockdown on apoptosis of SCC-15 and SCC-9 cells tested by TUNEL staining
本研究主要探讨抑制SIRT3 的表达对舌癌细胞的影响,初步结果显示SIRT3 对舌癌细胞生长具有促进作用。 实验使用2 种类型的舌癌细胞系,在SIRT3 沉默后,MTT 法观察到舌癌细胞的增殖活力受到了明显抑制。TUNEL 染色显示SIRT3 沉默使得舌癌细胞的细胞凋亡显著增加, 进一步提示了SIRT3 沉默可促进舌癌细胞的凋亡。此外,ELISA 显示SIRT3 沉默可显著增加舌癌细胞的Caspase-3 活性。 最后,我们通过Western blot 实验进一步证实了该结果, 沉默SIRT3 后舌癌细胞的Caspase-3 和PARP 表达都显著增强。综上所述, SIRT3 沉默能促进舌癌细胞凋亡。

图4 抑制SIRT3 表达后的舌癌细胞中的Caspase-3 活性及Caspase-3 和PARP 的表达Figure 4 Caspase-3 activity and expression of Caspase-3 and PARP in tongue squamous cell carcinoma cells after SIRT3 silencing
大量研究发现,SIRT3 在细胞凋亡过程中的作用是有争议的。 有文献报道,SIRT3 能促进细胞凋亡[10-11]。 SIRT3 可通过抑制线粒体活性氧(reactive oxygen species,ROS)等方式诱导线粒体功能障碍和细胞凋亡,抑制肿瘤的发生和发展[10]。SIRT3 在乳腺癌、前列腺癌、结直肠癌、肾透明细胞癌、胶质母细胞瘤和肝细胞癌中表达明显降低, 提示SIRT3 可能是线粒体内的肿瘤抑制剂[11]。 而另一些研究表明, SIRT3 能抑制细胞凋亡[4]。 SIRT3 可以增加人间充质干细胞对氧化应激反应的抵抗, 降低细胞凋亡[12]。在心肌细胞中, SIRT3 表达可以保护心肌细胞免受氧化应激和基因毒性反应诱导的细胞死亡[13]。我们敲低SIRT3 后发现舌癌细胞的凋亡增加,说明了SIRT3 可促进舌癌细胞生长。 Wang 等[14]报道,沉默SIRT3 诱导肿瘤细胞凋亡的机制可能是SIRT3 减少引发ROS 过量产生,从而启动细胞凋亡程序。 Turner 等[15]发现在结肠直肠癌中,SIRT3 的沉默激活线粒体分裂, 以依赖于Caspase-9 的方式启动线粒体凋亡。 另有文献表明SIRT3 沉默可导致cjun-氨基末端激酶 (c-jun-N-teminal kinase,JNK)途径激活和ROS 过量产生[16],损伤线粒体,引起细胞凋亡。
综上所述, 因为SIRT3 是线粒体内主要的去乙酰化酶, 所以我们考虑沉默SIRT3 诱导舌癌细胞凋亡的作用机制可能是通过内源性线粒体途径, 激活线粒体分裂,进而激活凋亡相关蛋白Caspase-3,促进舌癌细胞凋亡。 但这一假设仍然需要更多的实验验证。 下一步我们也将从氧化应激、线粒体分裂、能量代谢等方面研究SIRT3 影响舌癌细胞凋亡的分子机制,以完善对SIRT3 与舌癌发生、发展作用的认识。
