肝硬化肌肉减少症的发病机制及诊治现状
2020-04-21刘嘉,黄华
刘 嘉, 黄 华
昆明医科大学第二附属医院 消化内科, 昆明 650101
肌肉减少症是一组多种病因导致的以进行性、广泛性骨骼肌质量和力量下降,并由此导致体能及生活质量下降,病死率增加为特征的临床综合征[1],1989年由美国学者Irwin Rosenberg首先提出,早期主要以老年人群为研究对象,随着研究的不断进展,一些慢性疾病(如肝硬化、恶性肿瘤、糖尿病等)导致的肌肉减少症也逐渐受到关注。目前,越来越多的研究证实,肌肉减少症(以下简称肌少症)是营养不良的重要表现形式,且相比于营养评估存在的较多主观因素,肌肉质量是可以客观定量的,因此肌少症已成为评估营养不良的重要指标,甚至有时已经将其视为营养不良的同义词。有研究[2]发现,健康人群从50岁开始肌肉质量每年以1%的速率丢失,到70岁后增加至1.5%,然而,在肝硬化患者中观察到两倍以上的肌肉丢失率,且丢失率大于3%时病死率显著增加。最近一项Meta分析[3]指出,肌少症的存在与肝硬化预后不良和并发症的发生有关,且相比于欧洲患者,亚洲肝硬化患者合并肌少症的病死率更高,早期评估肝硬化患者的肌肉质量,尽早采取合理的治疗方案可改善患者预后。
1 肌肉减少症的流行病学概述
由于目前对于肌少症的诊断标准尚未达成共识,且存在地区、种族、生活方式等差异,肌少症的流行病学调查结果存在较大差异。有文献[4-5]报道,肝硬化肌少症的发生率为20%~70%,其中非酒精性脂肪性肝病(NAFLD)发生率最低(22%),而酒精性肝硬化患者高达80%。有学者[6]对104例肝硬化患者进行研究,发现32%的代偿期患者和54%的失代偿期患者存在肌少症。美国一项多中心研究[7]纳入396例肝硬化患者,发现50%的男性和33%的女性出现肌肉减少。加拿大一项回顾性研究[8]纳入142例等待肝移植患者,观察到肌少症的发生率为51%,其中男性高于女性 (54% vs 21%),且发生率与Child-Pugh分级相关(A、B和C级分别为10%、34%和54%),该研究还发现,男性患者肌少症的发生率随着肝病的进展而增加。在亚洲,关于肝硬化肌少症发生率的数据有限,日本学者[9]对807例慢性肝病患者进行调查研究,发现慢性肝炎、肝硬化Child-Pugh A级和Child-Pugh B/C级患者中肌少症的发生率为4%、5%和17%。
2 肌肉减少症对肝硬化及其预后的影响
肌少症增加肝硬化感染及肝性脑病的发生风险[10],对患者预后产生不利影响,且有研究[11]发现,传统的预后评分系统如终末期肝病模型(MELD)及Child-Pugh分级不能有效预测合并严重肌少症患者的预后,因此,已有学者[12]将肌少症纳入MELD评分,即MELD-肌少症模型,对病死率的预测价值显著提升。在一项回顾性研究中,Jeong等[13]发现肌少症的存在及肌肉消耗速率与肝硬化患者的长期病死率有关;一项Meta分析[14]结果显示,肌少症与NAFLD患者脂肪性肝炎及进展性肝纤维化有关;此外,在肝硬化合并肝细胞癌的患者中,肌少症组治疗后复发率升高。对于接受肝移植的患者,合并肌少症导致移植术后并发症发生率增加,生存率下降,移植后住院时间、ICU停留时间、感染风险均增加[15]。
3 肝硬化肌少症的发生机制
3.1 营养物质缺乏及代谢异常 骨骼肌是储存蛋白质的主要场所,肌肉组织蛋白质的合成是一个复杂的过程,需要多种营养物质参与,肝硬化时,肝脏合成功能下降,消化道症状如恶心、呕吐、腹胀、食欲减退及相关并发症如门静脉高压、胃肠道淤血、肠道菌群紊乱等导致蛋白质合成、吸收障碍。Johnson等[16]研究发现,肝硬化患者在饥饿早期就表现为氨基酸分解代谢,此外糖异生作用增强、静息能量消耗增加等代谢紊乱导致大量支链氨基酸(branched-chain amino acid,BCAA)被消耗,而BCAA是骨骼肌组织的优先能量来源,其减少会加重肌肉破坏。Morrison等[17]利用标记的亮氨酸测定肝硬化患者全身蛋白质周转,发现肝硬化患者蛋白质合成能力下降,并推测肌肉消耗的主要原因是肌肉蛋白质合成减少。Wang等[18]研究发现,肝硬化大鼠表现出肌肉特异性结构蛋白的水解增加。Notch信号通路在骨骼肌生长和发育过程中起关键作用,目前动物实验[19]已证实维生素D缺乏可下调 Notch 通路导致大鼠骨骼肌萎缩,而大部分肝硬化患者存在维生素D的吸收及合成障碍。
3.2 激素水平异常 骨骼肌生长发育受多种激素调节,其中最重要的是胰岛素样生长因子(insulin like growth factor,IGF)-1、肌生长抑制素(以下简称肌抑素)及睾酮。IGF-1可通过PI3K/Akt途径编码雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1,mTORC1)介导骨骼肌蛋白质合成增加和肌卫星细胞增殖[20]。肌抑素是多效性转化生长因子b家族的一员,可抑制肌卫星细胞增殖分化为新的肌纤维,是骨骼肌生长的负性调节因子。Khoshnood等[21]研究发现,肝硬化患者IGF-1生成减少,其水平与肝病严重程度相关。一项随机对照试验[22]发现,IGF-1在体内外均可显著抑制肌抑素mRNA表达,促进肌肉生长。有学者[23]对肝硬化患者进行肌肉活检,发现其骨骼肌肌抑素受体表达增加,且血浆肌抑素水平较健康对照组增加4倍。Morine等[24]研究表明,阻断肌抑素信号传导可明显增强营养不良小鼠骨骼肌质量和强度。
睾酮水平降低与肌少症发生有关,体外研究[25]已经观察到睾酮可以刺激成肌细胞培养皿中卫星细胞的有丝分裂,增加肌肉卫星细胞的数量,提高骨骼肌细胞内氨基酸的利用率,增加蛋白质合成。此外,睾酮通过增加骨骼肌细胞内Ca2+浓度促进G蛋白相关受体的激活,有利于骨骼肌细胞生长[26]。也有研究[27]报道,睾酮可通过增加IGF-1表达促进骨骼肌生长,但其具体机制目前尚不清楚。Sinclair等[28]的随机对照试验证实了对肝硬化合并低血清睾酮患者补充睾酮可以增加肌肉质量。
3.3 高氨血症 氨的产生主要来自氨基酸、嘌呤及肠道微生物代谢,尽管氨对神经细胞毒性效应已得到了较为全面的认识,但其骨骼肌毒性直到最近才被报道。在肝脏代谢功能中,通过尿素生成来处理氨至关重要,肝硬化时肝细胞功能障碍和门体分流导致血氨升高,高氨血症导致骨骼肌细胞线粒体功能受损,骨骼肌细胞ATP生成减少,导致细胞能量传感器磷酸腺苷激活蛋白激酶的激活和mTORC1信号传导受损,影响骨骼肌蛋白质合成[29]。动物实验[23]证实,高氨血症介导p65核因子κB(NF-κB)激活使肌抑素表达增加,从而激活泛素-蛋白酶体系统(ubiquitin-proteasome pathway,UPP)和自噬介导的蛋白水解。
3.4 肠道菌群 肠道菌群参与氨基酸及多种维生素的的合成,这些产物在肌肉蛋白质合成及骨骼肌细胞代谢中起重要作用[30]。肝硬化时,肠道菌群失调导致肠道通透性增加,细菌代谢产物如内毒素及脂多糖通过Toll样受体(TLR)4识别,介导炎性细胞释放TNFα和IL-6,使机体处于慢性炎症状态,并使UPP活性增加,导致肌肉蛋白水解[31]。动物实验[32]表明,慢性炎症小鼠骨骼肌细胞线粒体严重损伤及自噬增加,但目前慢性炎症导致线粒体损伤的机制尚不清除,可能与炎性细胞在循环中释放的细胞因子、趋化因子、一氧化氮等炎性物质相关。此外,肠道菌群的一个重要作用是代谢产生短链脂肪酸(short-chain fatty acids,SCFA)。目前研究[33]已表明,SCFA能够促进骨骼肌细胞ATP生成,增加骨骼肌蛋白质合成、葡萄糖摄取及肌肉脂质周转,降低胰岛素抵抗。Yan等[34]研究发现,无菌小鼠血清IGF-1减少及骨骼肌质量下降,补充SCFA可使IGF-1和骨骼肌质量恢复到正常水平,表明肠道菌群代谢产物SCFA可能是血清IGF-1调节的一种重要机制。
3.5 UPP和自噬的激活 UPP是肌肉蛋白质水解的主要途径,主要通过泛素标记蛋白质,再由26S蛋白酶体降解标记过的蛋白质。目前研究[35]表明,炎症因子(特别是TNFα和IL-6)及高氨血症能激活UPP,增加蛋白分解,与肌少症的发生密切相关。自噬是一种程序性细胞死亡途径,通过细胞应激和介导错误折叠蛋白及受损细胞器的降解,从而维持细胞稳态。乙醇、炎症因子及高氨血症均可导致骨骼肌线粒体功能受损,线粒体内膜电子传递链复合物Ⅲ的电子泄漏,产生的活性氧进一步引起细胞损伤并诱导自噬[36],因此,UPP与自噬的过度激活可能与肝硬化患者肌少症的发生有关。
4 诊断方法
尽管目前仍缺乏统一的检测方法及诊断标准,但国外主要的营养及肝病学会均将评估肌肉质量作为诊断肝硬化营养不良的核心,2011年国际肌肉减少症共识[1]指出,肌少症的诊断应包括骨骼肌质量及功能的评估。
4.1 骨骼肌质量测定 主要包括上臂肌围(arm muscle circumference,AMC)、生物电阻抗分析法(bioelectrical impedance analysis,BIA)、双能X射线吸收测定法(dual energy X-ray absorption measurement,DEXA)、CT及MRI等(表1)。BIA通过将微弱的交流电信号导入人体,测定电流阻抗来分析人体构成成分,可测定人体肌肉质量。DEXA通过低剂量X射线可将人体非骨组织区分为肌肉组织和脂肪组织,可用于测定全身肌肉质量,尤其在测定四肢骨骼肌质量时准确度高。通过BIA及DEXA测定肌肉质量,并计算骨骼肌指数(skeletal muscle index,SMI)作为诊断肌少症的标准,2013年亚洲肌少症工作组(Asian Working Group for Sarcopenia,AWGS)对SMI进行了标化:男性<7.0 kg/m2,女性<5.4 kg/m2可诊断为肌少症。CT/MRI可清晰显示人体肌肉组织,是评估肌肉质量最常用的方法,目前普遍采用第三腰椎(L3)SMI作为诊断肌少症的标准。2010年欧洲老年人肌少症工作组(European Working Group on Sarcopenia in Older People,EWGSOP)在肌少症定义和诊断的欧洲共识[37]中将CT确定为诊断肌少症的金标准。我国2019年中华医学会肝病学和消化病学分会发布的《终末期肝病临床营养指南》[38]中建议:应用握力等方法评定骨骼肌功能,有条件时可应用CT/MRI及BIA,计算SMI来评定肌肉质量。
4.2 骨骼肌功能测定 主要包括非惯用手握力测定(handgrip strength,HG)、日常步速评估法及简易机体功能评估(short physical performance battery,SPPB)。AWGS在肌少症的亚洲共识[39]中指出:男性HG<26 kg,女性HG<18 kg为肌肉力量下降;日常步速评估法即受测者以日常步速步行6 m并计算所用时间,步速<0.8 m/s判定为肌肉功能下降;SPPB是EWGSOP推荐可用于肌少症患者评估肌肉功能的方法,包括串联站立测试、2.44 m行走测试、5次坐立测试,每项评定记分0~4分,低于1分提示肌肉功能下降[34]。
5 治疗进展
肌少症是肝硬化患者病死率增加的独立危险因素,改善肌肉质量可提高肝硬化患者的生存率[40],因此,针对肌少症进行合理的干预治疗是肝硬化综合治疗中的重要内容,目前主要的治疗方法包括补充营养、合理运动、激素治疗、靶向治疗等。
5.1 补充营养 目前,已有大量临床研究[41]证实补充BCAA可以明显改善肝硬化患者肌肉质量,BCAA可以直接激活mTORC1通路,刺激蛋白质合成并减少自噬,改善肌肉质量。最近一项研究[29]发现,富含亮氨酸的BCAA混合物能够逆转肝硬化患者骨骼肌中肌抑素下游的分子紊乱。尽管有研究[5]表明,每日的高能量高蛋白膳食(30~35 kcal·kg-1·d-1,植物蛋白1.0~1.5 g·kg-1·d-1)不能明显改善肝硬化患者肌肉质量,但可以改善氮平衡,因此欧洲及国内的最新指南均建议肝硬化患者每日最佳能量摄入量为30~35 kcal·kg-1·d-1,蛋白摄入量为1.2~1.5 g·kg-1·d-1[38,42]。此外,夜间加餐被证明可以改善氮平衡,预防肌肉减少,提高生活质量[43]。因此,我国指南中推荐夜间加餐、少食多餐,避免过度饥饿,以促进蛋白质和能量吸收,防止肌肉减少[38]。最近的一项回顾性研究[44]发现,左卡尼丁可以有效的抑制肝硬化患者肌肉损失,但其具体机制尚不清楚,未来需要大规模前瞻性临床对照研究进一步探索。
5.2 合理运动 抗阻力运动可以通过诱导肌肉损伤-再生及蛋白质合成来增加骨骼肌质量,耐力运动可以提高肌肉功能,抗阻力运动联合耐力运动可以改善骨骼肌质量和功能,但此类研究尚未在肝硬化患者中进行,且目前没有证据表明缺乏运动与肝硬化肌少症发生有关。Locklear等[45]纳入七项运动干预研究进行系统评价发现,中等强度的有氧运动或抗阻力训练(20 min/d,4 d/周,至少8周)可改善肝硬化患者的肌肉力量,且未产生不良影响。
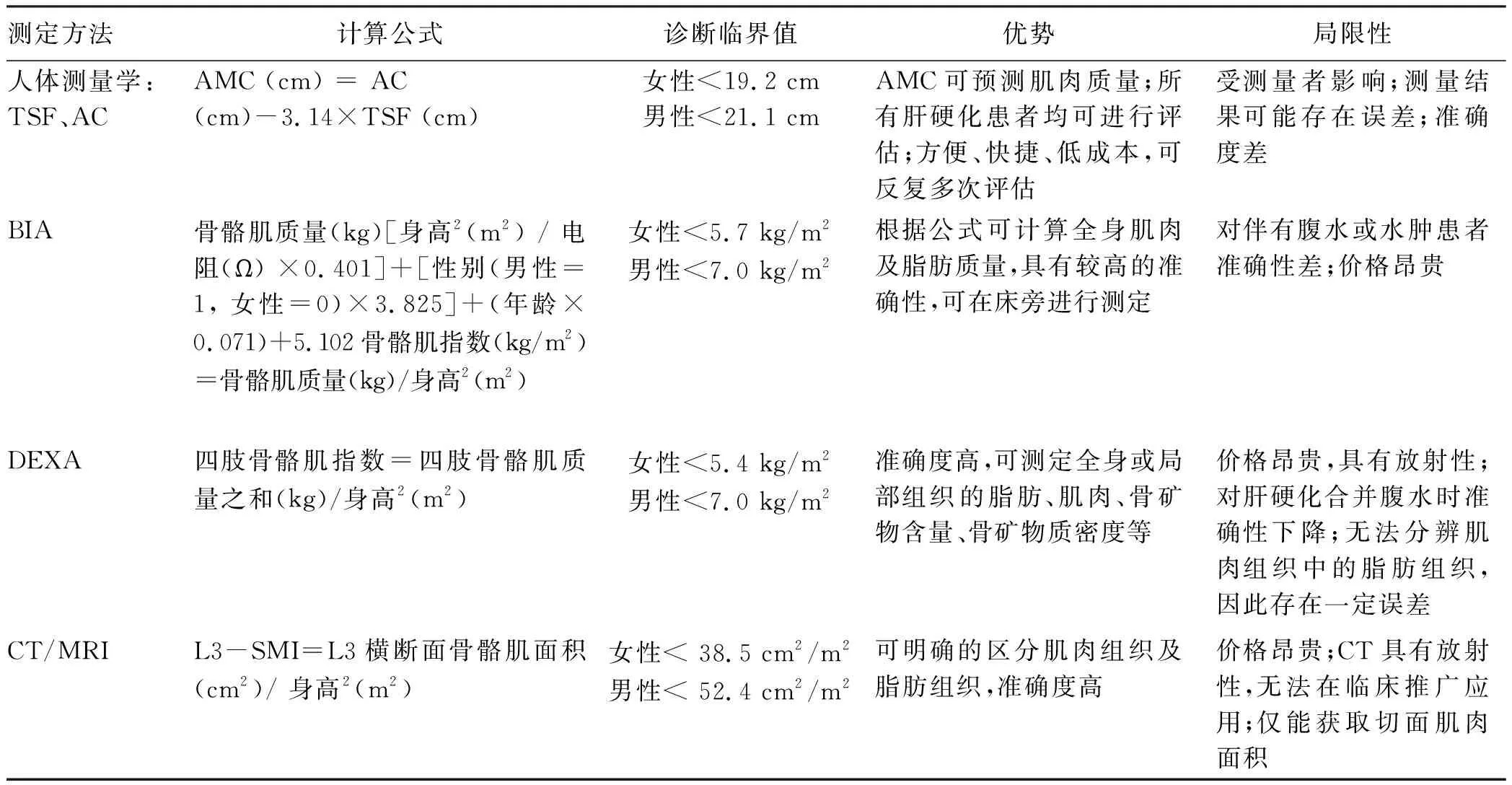
表1 肝硬化肌少症评估方法
注:TSF,肱三头肌皮褶厚度;AC,上臂围。
5.3 激素治疗 尽管目前已有研究[28]表明,补充睾酮可以增加肝硬化患者肌肉质量,但生存率无明显改善,且睾酮的心血管事件、肿瘤等相关不良反应也限制了其在肝硬化患者中的应用。IGF-1是促进肌肉生长的重要激素,动物研究[46]证实了补充IGF-1可以增加肝硬化小鼠肌肉质量,但尚无相关临床研究证明其对肝硬化患者的作用。
5.4 降氨治疗 骨骼肌代谢是一个缓慢的过程,暂时降低血氨含量并不一定能迅速逆转正在进行的肌肉代谢紊乱,需要制订长期的降氨方案,目前常用的降氨治疗有:灌肠、导泻、口服抗生素及乳果糖等。最近有研究[47]发现,高氨血症大鼠的长期降氨治疗可逆转肌抑素表达增加及mTORC1信号传导受损,恢复蛋白质稳态并增加肌肉质量。但目前缺乏相关的临床研究,因此,长期降氨能否改善肝硬化患者的肌肉质量将是未来研究的重点。
5.5 分子靶向治疗 肌抑素拮抗剂是一种用于治疗肌少症的新型药物[48],但目前尚未针对肝硬化患者进行临床试验,此外,mTORC1激活剂,抗氧化剂、自噬调节剂、线粒体保护剂均有益于骨骼肌蛋白质周转,但仍缺乏足够的临床证据。
5.6 肝移植 目前肝移植能否改善肝硬化患者肌肉质量仍存在争议。有研究[49]表明,肝移植通过恢复正常的肝细胞功能及门静脉压力,去除了许多导致肌少症发生的因素,但移植后免疫抑制剂的使用对肌肉质量有不良影响。未来需要更多研究证实这一问题。
6 小结
综上所述,肌少症已成为肝硬化不可忽视的并发症,对患者的生活质量及预后产生不良影响,目前对于肝硬化肌少症的研究已经取得了一定的进展,但对其发生机制与治疗方法认识有限,未来随着对骨骼肌分子信号调控研究的不断深入,各种新型靶向药物的出现,将使肝硬化肌少症患者从中获益。
