三维动脉自旋标记成像量化脑转移瘤放疗前后灌注变化的研究*
2020-04-20侯传珂巩贯忠王俪臻苏亚卢洁尹勇
侯传珂 巩贯忠 王俪臻 苏亚 卢洁 尹勇
脑转移瘤(brain metastasis,BMs)是一种常见的恶性肿瘤,20%~40%的恶性肿瘤患者最终出现脑转移,未经治疗的患者中位生存期仅1 个月左右[1-2]。放射治疗(放疗)已经成为BMs一种不可替代的治疗方式,部分患者经过放疗控制肿瘤靶区后可获得长期生存。然而因缺乏对BMs 放疗反应和放射性脑损伤准确的评估方法,对靶区剂量制定和放射性脑损伤的预测有较大的盲目性,导致BMs 放疗失败时有发生。
磁共振检查(magnetic resonance,MR)是BMs 诊断和放疗反应监测的重要手段,而MR新技术可为放疗反应的监测提供更客观的方法,如动态磁敏感对比增强已经被广泛用于肿瘤治疗效果评估与放射性脑损伤的诊断,但由于其成像时间长、有一定创伤性,临床应用受限[3]。三维动脉自旋标记(three-dimensional arterial spin labeling,3D-ASL)作为无需造影剂的主流灌注成像技术,以自体血作为内源性对比剂,可以定量分析脑组织及脑内病变的血流(cerebral blood flow,CBF)参数,监测放疗过程中脑区域灌注,追踪放疗中正常脑组织及肿瘤靶区放疗反应的动态变化[4-5]。本研究基于3D-ASL 量化BMs 肿瘤靶区、正常脑区域及瘤周水肿区放疗前后的灌注变化情况,分析了三者与放疗剂量梯度的关系,为BMs放疗提供参考。
1 材料与方法
1.1 一般资料
回顾性分析2018年7月至2019年6月山东省肿瘤防治研究院收治BMs的患者。纳入标准:1)BMs的放射学诊断;2)无放疗禁忌证;3)在同一CT、MR上进行定位和图像采集;4)仅接受放疗;5)CT 及MR 图像无伪影。共收集患者26 例,其中男性11 例,年龄45~65 岁,平均年龄57.27 岁;女性15 例,年龄41~68岁,平均年龄55.40岁。原发肿瘤类型包括乳腺癌6 例,肺癌17 例,食管癌3 例。所有研究对象均已签订知情同意书。
1.2 方法
1.2.1 患者CT 模拟定位 采用热塑膜固定头部,飞利浦大孔径CT定位机对患者进行定位。模拟定位在模拟机上进行,患者仰卧位,等中心方法,将激光射野模拟定位系统设定于原点,利用激光灯在患者固定热塑膜上十字投影标记参考点,以3 mm层厚、3 mm间距进行CT增强扫描。
1.2.2 患者放疗前磁共振模拟定位(MR-simulation,MR-sim)图像获取 CT 模拟定位后,采用热塑膜固定头部于CT 模拟定位的同一位置,使用GE 3.0 T 超导型MR 扫描仪(Discovery 750w,GE Healthcare,美国),6通道头颅线圈,颅脑常规采用快速自旋回波序列,于放疗前分别行3D-ASL扫描和增强扫描。
3D-ASL扫描参数:采用三维容积扫描,TR=5 160 ms,TE=11.5 ms,矩阵=256×256,FOV=256 mm×256 mm,层厚=3 mm,激发次数1次,标记后延迟=2 025 ms。
增强扫描参数:TR=8.5 ms,TE=3.2 ms,矩阵=256×256,FOV=256 mm×256 mm,层厚=1 mm,激发次数1 次。造影剂采用顺磁性对比剂Gd-DTPA,剂量为0.2 mL/kg,注射速率为2 mL/s,注射结束后3~5 min内完成扫描。
1.2.3 放疗计划设计扫描后的影像数据 传输至治疗计划系统(treatment planning system,TPS),由医师勾画放疗靶区、物理师设计放疗计划,后经放疗计划评估优化、计划验证等程序,按照2 Gy/25 f对患者进行放疗。
1.2.4 患者二次MR-sim图像获取 患者放疗后(进行15~20 次放疗)再进行一次MR 扫描,设备、仪器、体位、参数均同放疗前MR-sim 图像采集,获取3DASL和强化T1WI图像。
1.2.5 图像融合配准 在MIM Maestro 软件(6.8.8,美国)中将放疗前强化T1WI图像与放疗计划的剂量分布图融合并予以刚性辅助配准,设置剂量梯度间隔为10 Gy。剂量梯度组分别为0~10、10~20、20~30、30~40、40~50 Gy和>50 Gy,见图1。

图1 图像融合配准
1.2.6 感兴趣区域(regions of interest,ROIs)勾画 在GE 图像处理工作站(GE,ADW4.7,美国)中将强化T1WI图像及3D-ASL图像进行融合配准。将BMs肿瘤靶区信号最强的部分、正常脑区域及瘤周水肿区定义为ROIs(正常脑区域和瘤周水肿区ROIs 的面积控制在5~7 mm2)。获取BMs 肿瘤靶区放疗前后的平均最大截面积和平均最大CBF 值,并测量不同剂量梯度下BMs 肿瘤靶区,正常脑区域和瘤周水肿区放疗前后的平均最大CBF值。实验工作流程图见图2。
1.3 统计学分析
用SPSS 22.0统计学软件对BMs肿瘤靶区放疗前后的面积值进行非参数检验,BMs肿瘤靶区放疗前后的CBF 值进行配对样本t检验,BMs 肿瘤靶区放疗前后的面积差值和CBF 差值行线性回归分析;对不同剂量梯度内ROIs放疗前后的CBF数值进行配对样本t检验,不同剂量梯度间ROIs放疗前后的CBF差值进行配对样本t检验。所有数据用表示,P<0.05 为差异具有统计学意义。
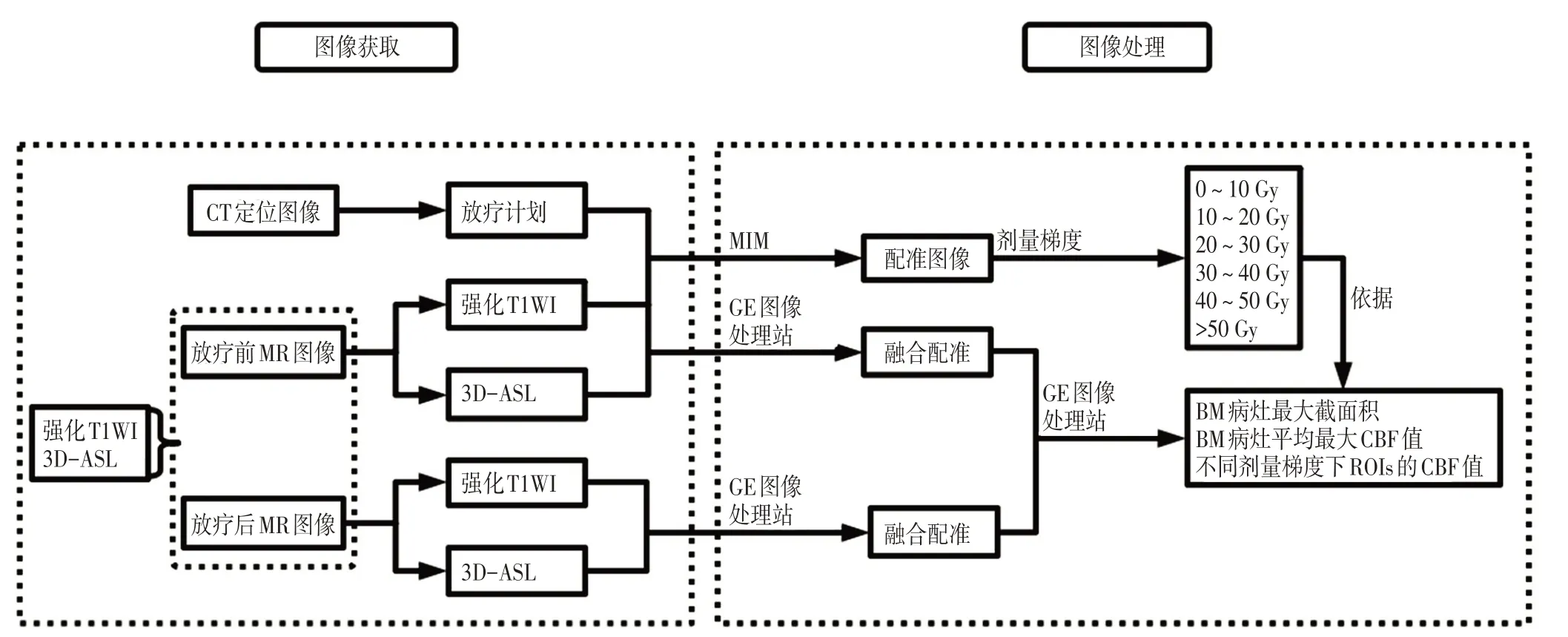
图2 实验工作流程图
2 结果
2.1 BMs肿瘤靶区放疗前后的变化
2.1.1 BMs 肿瘤靶区放疗前后平均最大截面积的变化 26 例BMs 患者共测量54 个肿瘤靶区,BMs 肿瘤靶区放疗前的平均最大截面积较放疗后平均减小26.46%,差异具有统计学意义(P<0.05),见表1。
2.1.2 BMs 肿瘤靶区放疗前后CBF 值的变化 BMs肿瘤靶区放疗后的CBF 值较放疗前平均下降约29.64%,差异具有统计学意义(P<0.05),见表1。BMs肿瘤靶区放疗前后面积差值和CBF 差值的变化趋势基本一致,但CBF的变化较面积的变化更为显著,且两者无相关性(P>0.05),见表1。

表1 54个BMs病灶放疗前后最大截面积和CBF的变化
BMs 肿瘤靶区在30~40、40~50、>50 Gy 3 组剂量梯度下CBF 的下降率分别为33.75%、24.61%和27.55%。当剂量梯度为30~40 Gy 时CBF 的下降率达到最大,为33.75%。见图3,4。

图3 41岁乳腺癌脑转移女性患者进行40 Gy剂量放疗前后的对比图像
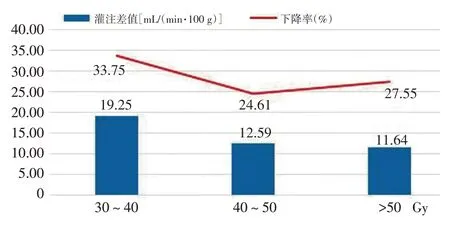
图4 不同剂量梯度下BMs肿瘤靶区放疗前后的灌注变化
2.2 不同剂量梯度下正常脑区域放疗前后的灌注变化
0~10、10 ~20、20~30、30~40、40~50 Gy 和>50 Gy 剂量梯度内正常脑区域放疗前后CBF 的下降率分别为7.65%、11.12%、18.42%、20.23%、19.79%和17.89%,6组剂量梯度放疗前后CBF的差异均具有统计学意义(P<0.05)。当放疗剂量>10 Gy时,正常脑区域放疗前后CBF 的下降率均>10%;且当剂量梯度为30~40 Gy 时,正常脑区域放疗前后CBF 的下降率达到最大,为20.23%,与BMs肿瘤靶区放疗前后CBF的变化具有相似性。见表2,图5。

表2 不同剂量梯度下正常脑区域放疗前后的灌注变化

图5 不同剂量梯度下正常脑区域放疗前后的灌注变化
2.3 不同剂量梯度下BMs瘤周水肿区放疗前后的灌注变化
BMs瘤周水肿区在30~40、40~50 Gy和>50 Gy剂量梯度下,CBF下降率分别为16.05%、17.97%和18.95%,瘤周水肿区在3组剂量梯度下CBF放疗前后的差异均具有统计学意义(P<0.05)。BMs瘤周水肿区放疗前后灌注的降低程度随着放疗剂量的增高呈递增趋势,有别于BMs肿瘤靶区和正常脑区域。见图6。
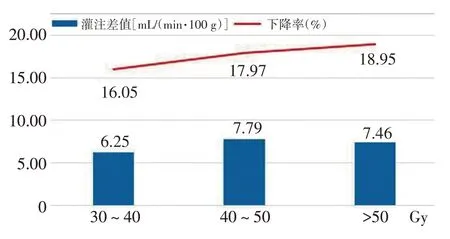
图6 不同剂量梯度下瘤周水肿区放疗前后的灌注变化
3 讨论
BMs是颅内常见的恶性肿瘤,其原发肿瘤多为肺癌、乳腺癌、胃肠道癌、透明细胞癌、黑色素瘤等[6]。目前针对BMs的治疗方法有手术、放疗、化疗及综合治疗等。而BMs 对大多数化疗药物产生耐药性,手术多适用于单发的BMs,因此放疗仍是BMs常用的治疗方法[7-8]。但BMs 放疗失败时有发生,已成为严重影响患者长期生存的主要因素,约50%的患者死于颅内肿瘤未控制或复发,而且由放疗引起的正常脑组织的损伤或坏死较难逆转[9-11]。因此通过监测追踪BMs 放疗过程中正常脑组织和肿瘤靶区放疗反应的动态变化,及早评估疗效及预测放射性脑损伤发生对改进治疗策略、改善疗效至关重要。
Law等[12]认为,BMs播散至中枢神经系统后其新生成的毛细血管不存在血-脑屏障结构。常规MR强化T1WI图像基于血-脑脊液屏障的损害会引起血管通透性增加,此现象反映为肿瘤造影剂的瞬时残留[13-14],但该现象仅反映了肿瘤瘤体的解剖变化,缺乏动态量化指标,在评估BMs 的疗效和预测放射性脑损伤的发生方面仍存在不足。据研究[15],脑区域的功能损害常伴随CBF的降低,CBF的降低程度可以用于评价阿尔兹海默症的严重程度。而进展性脑卒中患者患侧及健侧后外分水岭区的侧支循环代偿CBF值对脑卒中的早期诊断起到重要作用[16]。
3D-ASL利用自身血液中的氢质子作为内源性对比剂,可通过测量CBF值以反映脑组织的局部血流量,且其结果与传统灌注成像有较好的一致性,因此临床上常将该技术与常规MR图像联合应用于颅脑疾病的诊断和鉴别[17-19]。苗娜等[20]发现3D-ASL对不同级别脑胶质瘤的鉴别诊断符合率(86.31%)相较于常规MR(70.12%)在准确性上有一定程度提高。诸一吕等[21]对21例脑胶质瘤术后放疗后患者研究发现,复发患者的平均相对CBF值为(2.23±0.35)mL/(min·100 g),放射性脑损伤患者平均相对CBF值为(0.91±0.21)mL/(min·100g),两者的CBF值差异明显。目前针对脑胶质瘤的研究表明3D-ASL可以用于评价肿瘤微循环的灌注情况,为监测和追踪放疗过程中正常脑组织和肿瘤靶区内局部血流灌注及放疗反应的动态变化提供了一种可行方法。
本研究发现,BMs肿瘤靶区放疗前后的平均最大截面积和CBF 值均明显下降,但两者的下降存在不同步性,证实了肿瘤的解剖变化较灌注变化有一定的滞后性。由此解释为何部分患者在多次复查中瘤体的体积变化不明显,但肿瘤处于低灌注的无活性状态。本研究还发现,当剂量梯度为30~40 Gy 时,BMs肿瘤靶区CBF值的下降率较40~50 Gy和>50 Gy时更大,达33.75%。这说明放疗前期BMs 肿瘤靶区的放疗反应明显,但>40 Gy 后随着放疗剂量的进一步提高,BMs 可能存在肿瘤细胞的坏死、修复与再生等现象,导致灌注有所提升,此时可能需要更高的放疗剂量。
放射性损伤模型中早期即可出现细胞内水肿、内皮细胞肿胀、血管闭塞等改变,这些病理改变会造成脑组织血流灌注的异常[22]。本研究发现当放疗剂量>10 Gy 时,正常脑区域放疗后CBF 的下降率均>10%,这表明脑组织接受低剂量放疗也会出现灌注下降;且当剂量梯度为30~40 Gy 时,放疗前后的灌注变化率达到最大,为20.23%,这与BMs 肿瘤靶区的CBF 变化类似。而正常脑组织在接受一定剂量放疗后的CBF 下降程度明显低于BMs 肿瘤靶区的下降程度,这主要与脑组织及肿瘤内部毛细血管的结构、功能等差异有关。从肿瘤病理学分析,BMs发生及进展过程中诱导生成的毛细血管一般存在发育不成熟、结构不完整、功能不完全的特点,相对于正常脑组织发育成熟的毛细血管来说,这样的毛细血管(内皮细胞及间质细胞)更容易发生损伤和功能改变[23]。
有研究[24]表明,瘤周水肿引起脑实质的损害可继发引起脑灌注改变,测量瘤周水肿区的灌注情况可较准确地估计瘤周水肿区脑组织损伤的程度。因此本研究还分析了BMs 瘤周水肿区放疗前后的灌注变化。研究发现BMs 瘤周水肿区放疗前后CBF的下降率随着剂量梯度的提高呈上升趋势。可能是BMs的水肿属于血管压迫性水肿[25],随着放疗的进行,瘤周水肿暂时性加重,瘤周水肿区的血流量和血容积进一步减少。
本研究仍然存在一些不足之处,如样本量小、未建立预测模型等。今后的研究中,我们将扩大入组患者量,建立BMs肿瘤靶区、正常脑区域及BMs瘤周水肿区放疗反应及放射性脑损伤的预测模型,为BMs患者的个体化放疗提供更多的参考依据。
综上所述,正常脑区域结构、功能的改变一般均伴有CBF 的改变。根据本研究建立的正常脑区域、BMs 肿瘤靶区及瘤周水肿区CBF 随剂量梯度的变化关系,BMs 放疗时,应尽量将正常脑区域的剂量控制在30 Gy以下,避免正常脑组织CBF的显著减低而影响功能;而对于BMs 肿瘤靶区中呈高灌注区域和瘤周水肿区,建议可以通过局部加量照射或者改变分割的方法将放疗剂量提升至40 Gy 以上,有望改变BMs放疗反应平台区,提高BMs局部控制率。
