免疫检查点抑制剂治疗EGFR-TKI耐药晚期非小细胞肺癌的疗效及不良反应*
2020-04-20张智博李晔袁方张素洁智晓玉葛祥伟胡毅汪进良
张智博 李晔 袁方 张素洁 智晓玉 葛祥伟 胡毅 汪进良
肺癌是全球发病率和死亡率最高的恶性肿瘤[1],其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占比最高。由于早期症状不典型,多数患者确诊时已处于疾病晚期,无法进行手术治疗,患者生存时间较短[2]。尽管表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase,EGFRTKI)能显著提高EGFR突变晚期NSCLC患者的治疗疗效,延长患者的生存时间[3],但大部分患者最终将出现EGFR-TKI耐药。近年来,免疫检查点抑制剂(immune checkpoint inhibitor,ICI)在晚期NSCLC中广泛应用,但治疗主要局限于EGFR未突变者,对治疗EGFR突变者尚缺乏足够认识。因此,本研究将探讨EGFR-TKI耐药后晚期NSCLC患者ICI治疗的疗效及不良反应。
1 材料与方法
1.1 一般资料
收集2015年1月至2019年3月解放军总医院收治的57例EGFR突变晚期NSCLC患者病例资料。纳入标准:1)经病理学或细胞学诊断为NSCLC;2)按国际肺癌研究协会(IASLC)第7 版肺癌分期为ⅢB~Ⅳ期;3)至少接受2次ICI治疗。排除标准:1)一线治疗未使用EGFR-TKI;2)ICI 治疗后无疗效评价。按上述标准,共49例患者纳入研究。
1.2 方法
1.2.1 资料收集 收集患者的临床资料,包括性别、年龄、病理类型、肿瘤分化程度、临床分期、吸烟史、基因检测结果、美国东部肿瘤协助组(ECOG)评分,免疫治疗前肿瘤转移情况(脑/肝转移),免疫治疗方式(单药/联合),免疫治疗线数(2线/≥3线)。
1.2.2 疗效、预后评价和不良反应分级 采用实体瘤疗效评价标准1.1(RECIST 1.1)对所有患者进行疗效评价,包括完全缓解(complete response,CR),部分缓解(partial response,PR),疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。客观缓解率(objective response rate,ORR)为疗效评价为CR 或PR 者占总体人数的比率。无进展生存期(progression free survival,PFS)定义为首次免疫治疗至肿瘤进展或死亡的时间(以先发生的时间计算)。总生存期(overall survival,OS)定义为首次免疫治疗至患者出现死亡的时间。采用美国国立卫生研究院癌症研究所指定的《常见不良反应术语评定标准(CTCAE 4.03)》对不良反应严重程度进行分级。
1.2.3 随访 采用查阅门诊记录、住院病历以及电话询问的方式对所有患者进行随访。随访内容包括患者一般情况、肿瘤的治疗情况、疾病进展情况以及预后生存情况。每3个月随访1次,随访时间截止至2019年9月7日,中位随访时间为19.3个月。随访过程中若出现失访,则记录末次随访时间。共3例患者失访,失访率为6.1%。
1.3 统计学分析
采用SPSS 23.0 软件对数据进行统计学分析,GraphPad 8.0.1软件绘制生存曲线。非正态分布计量资料的描述使用中位值m(p25,p75),计数资料采用例和率表示,分类资料的组间比较采用χ2检验。采用Kaplan-Meier法进行生存分析,Log-rank检验对生存曲线进行比较。采用Cox 回归法进行单因素和多因素分析。P<0.05为差异具有统计学意义。
2 结果
2.1 患者基线特征
49例患者中位年龄59(33~82)岁,均为Ⅳ期、腺癌患者。男性22例(44.9%),肿瘤分化差32例(65.3%),无吸烟史38例(77.6%),脑转移15例(30.6%),肝转移6例(12.2%),单药治疗14例(28.6%),EGFR-TKI耐药后2线接受ICI治疗11例(22.4%)。EGFR突变类型包括Ex19del 20例(40.8%),L858R 15例(30.6%)和其他类型14例(28.6%)。EGFR-TKI耐药后出现T790M突变8例(16.3%)(表1)。
2.2 EGFR-TKI耐药后免疫治疗生存情况
49例患者中,14例为免疫单药治疗,35例为联合治疗(联合化疗±抗血管生成治疗/联合抗血管生成治疗/联合放疗)。疗效分析显示:EGFR-TKI 耐药后免疫单药治疗的疗效较差,联合治疗能显著提高疗效(ORR:28.6%vs. 7.1%,P<0.01)。2 线联合治疗者ORR高于≥3线联合治疗者(44.4%vs.23.1%),但差异无统计学意义(P=0.22)。
肿瘤患者性别、吸烟状况、ECOG 评分、EGFR 突变类型、脑转移及肝转移与PFS无相关(P>0.05)。然而,肿瘤分化差、联合治疗及年龄>60 岁者分别较肿瘤分化好(5.1 个月vs. 2.8 个月,P=0.030)、单药治疗(6.8 个月vs. 2.3 个月,P<0.001)及年龄>60 岁者(7.1个月vs.4.7 个月,P=0.020)的PFS 延长(图1)。肿瘤患者性别、吸烟状况、ECOG评分、治疗线数、EGFR突变类型、脑转移及肝转移与OS 无关(P>0.05)。但联合治疗、肿瘤治疗后缓解者分别较单药治疗(26.9 个月vs.7.1个月)、肿瘤稳定和进展者(30.8个月vs.18.7个月vs.12.8个月)的OS延长(P<0.001)(图2)。

表1 49例EGFR-TKI耐药晚期NSCLC患者基线临床特征
单因素分析显示,肿瘤分化好(HR:2.04,P=0.030)是PFS的危险因素,而年龄>60岁(HR:0.47,P=0.020)、联合治疗(HR:0.27,P<0.001)是PFS的保护因素。多因素分析显示,年龄>60岁(HR:0.30,P=0.001)和联合治疗(HR:0.20,P<0.001)是PFS的独立保护因素(表2)。
2.3 联合治疗方式与疗效及预后的关系
联合治疗的35 例患者中,联合抗血管生成治疗20 例,未联合抗血管生成治疗15 例。两者疗效相似(ORR:20%vs.40%,P=0.27),PFS(6.8 个月vs.5.1 个月,P=0.60)及OS(29.0 个月vs.23.8 个月,P=0.42)差异无统计学意义。
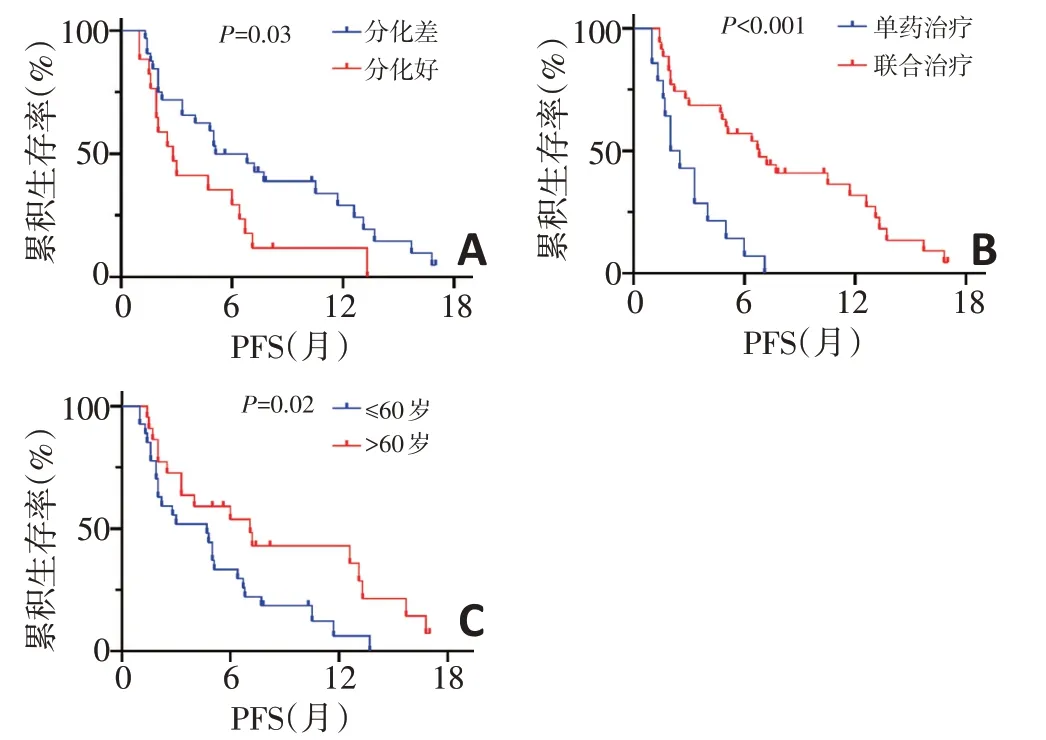
图1 临床特征与PFS的关系
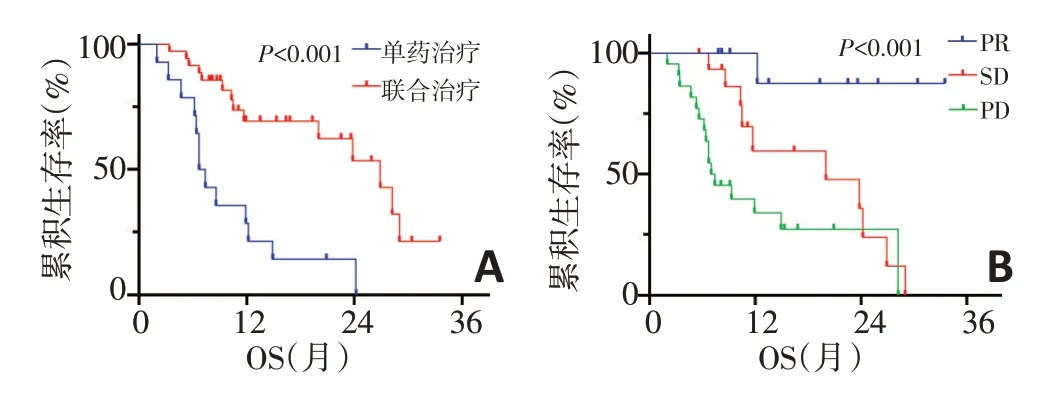
图2 临床特征与OS的关系

表2 临床特征与PFS的单因素及多因素分析

表2 临床特征与PFS的单因素及多因素分析(续表2)
2.4 EGFR突变类型与疗效及预后的关系
分析结果显示:EGFR突变不同类型间(Ex19del/L858R/其它类型)疗效相似(ORR:25.0%vs.13.3%vs.28.6%,P=0.89),PFS(6.7个月vs.5.6个月vs.7.3个月,P=0.85)和OS(20.2 个月vs.15.7 个月vs.16.8 个月,P=0.54)差异无统计学意义。共8 例患者EGFRTKI 耐药后出现T790M 突变,其中6 例应用联合治疗,2例应用单药治疗,8例患者免疫治疗均无效。
2.5 不良事件发生情况
联合治疗较单药治疗总体不良反应发生率提高(48.5%vs.14.2%,P=0.001)。联合治疗组1~2 级不良反应发生率显著高于单药治疗组(42.9%vs.14.2%,P<0.01),但≥3级不良反应发生率两组间差异无统计学意义(5.7%vs.0,P=0.28)。免疫单药治疗的不良反应主要为乏力和转氨酶升高,而联合治疗的不良反应主要为骨髓抑制、皮疹、转氨酶升高、胃肠道反应和间质性肺炎。
3 讨论
EGFR是肺癌常见的驱动基因,研究报道亚洲国家和地区肺腺癌患者EGFR 突变率为40%~50%[4]。EGFR-TKI 是针对EGFR 突变的靶向治疗药物,因其有效率高,不良反应少,显著延长患者的生存时间,成为EGFR 突变晚期NSCLC 一线治疗的首选药物[3]。然而,大部分患者最终会出现EGFR-TKI 耐药。以往化疗是EGFR-TKI耐药后的主要治疗手段,但有效率低,不良反应多,患者的生存质量较差。
程序性死亡受体-1(programmed death-1,PD-1)及其配体(programmed death-ligand 1,PD-L1)激活的信号通路是免疫抑制性信号通路,该通路能抑制过度激活的免疫反应,保护机体免受自身免疫性伤害。然而肿瘤能利用PD-1/PD-L1 信号通路抑制免疫系统对肿瘤的杀伤。ICI 能阻断PD-1 与PD-L1 的结合,解除抑制性免疫状态,从而发挥免疫系统的抗肿瘤作用[5-7]。与化疗相比,ICI能显著提高NSCLC患者的疗效,改善患者的预后[8-9],但多数研究主要针对EGFR未突变的患者。对于EGFR突变者,ICI治疗疗效较差。Checkmate057[10]和Keynote010[11]研究分析了ICI 对比化疗二线治疗NSCLC 的疗效,结果显示EGFR 突变者免疫治疗无获益,而EGFR 未突变者免疫治疗获益显著。另一项回顾性研究显示,EGFR突变NSCLC患者ICI单药治疗有效率低于EGFR未突变者[12]。然而,另有研究发现,EGFR 突变且PD-L1 表达阳性的NSCLC患者能从免疫治疗中获益[13]。
肿瘤细胞表面PD-L1 表达率和肿瘤突变负荷(tumor mutation burden,TMB)是肺癌免疫治疗常用的疗效预测标志物。PD-L1高表达和高TMB预示着免疫治疗的疗效更为显著[14-15]。然而,EGFR 突变晚期NSCLC 患者免疫治疗的疗效差,可能与以下因素有关:1)EGFR 突变负向调控PD-L1 表达,导致PD-L1表达水平较低[12,16];2)EGFR突变者TMB较低[17-18];3)EGFR 突变影响肿瘤免疫微环境,如抑制CD8+T 细胞浸润[17,19],上调具有免疫负向调控的T 淋巴细胞生成[20],从而抑制免疫系统发挥抗肿瘤作用。然而以上研究结论尚存争议[21-22],需进一步研究证实。
本研究认为,免疫单药治疗EGFR-TKI耐药晚期NSCLC的疗效较差,而联合治疗能显著提高疗效,延长患者的生存时间。联合治疗总体不良反应发生率虽高于单药治疗,但严重不良反应发生率无显著性差异。目前,年龄与免疫治疗疗效及预后的关系尚存争议[23-24]。本研究结果显示,年龄>60 岁者PFS 显著延长,年龄>60岁是PFS的独立影响因素。肿瘤分化好及T790M 突变的出现,预示免疫治疗效果较差。免疫治疗疗效与患者的生存时间相关,疗效越好预示患者的生存时间越长。
本研究存在以下不足之处:首先,本研究为回顾性研究,可能存在患者的选择性偏倚;其次,本研究纳入的样本量较少,需进一步扩大样本量;最后,本研究中免疫治疗的方案不统一,可能对结果造成影响。因此,对于EGFR-TKI 耐药晚期NSCLC 患者,如何应用免疫治疗,筛选出治疗的优势人群,以期让更多患者从免疫治疗中获益,仍需进一步探索研究。
