弓形虫Chinese 1基因型Wh6弱毒株感染小鼠抗强毒株致死性感染的免疫保护作用
2020-04-13陈守斌何佳丽计永胜罗庆礼胡晓东沈继龙
陈守斌,何佳丽,崔 雯,王 聪,陶 晴,计永胜,罗庆礼,胡晓东,沈继龙,王 维
弓形虫(Toxoplasmagondii)是一种机会致病性寄生原虫,引起人兽共患弓形虫病[1]。弓形虫三种基因分型I型、II型和III型,II型虫株PRU株在欧洲、北美和非洲流行区占主导地位[2]。Chinese 1基因型包括I型Wh3型和II型Wh6型,是中国流行区的优势基因型[3-6],我们自猫体内分离出了该基因型的两个虫株Wh3和Wh6,WH3株和WH6株是毒力截然不同的二个虫株,前者感染后小鼠在第8 d全部死亡,故为强毒株,而Wh6虫株感染后30d内未见小鼠死亡,存活小鼠的脑组织内仅见少量包囊,属于弱毒株[7-8]。
弓形虫病是食源性寄生虫病,多数动物因食入被包囊,卵囊污染的食物而感染。在自然界,人和各种动物可能发生不同虫株或亚型的弓形虫重复感染,使宿主产生带虫免疫,可诱导免疫保护性[9],从而部分抑制或完全抵抗另一虫株的入侵。中国优势基因型的2个不同毒力虫株交叉感染的保护性免疫作用的研究未见报道。为了探讨Wh6弱毒虫株感染后是否可诱导有效的抗再感染的免疫保护力,从而为经射线或化学致弱的活虫疫苗的研究奠定基础,本课题首先利用Chinese 1基因型Wh6株初次感染BALB/c小鼠,35d后建立慢性感染模型。其后用致死剂量的Wh3株速殖子攻击感染,攻击感染后,观察各组小鼠存活率、腹腔虫荷、脾细胞分泌Th1和Th2细胞因子水平,旨在探讨相同基因型不同毒力虫株诱导的免疫保护力,并为致弱的活虫疫苗研发提供理论依据。
1 材料和方法
1.1 材 料
1.1.1试剂 青霉素,链霉素,离子霉素(Sigma,USA),Dulbecco改良的Eagle培养基,胎牛血清(FBS)和Roswell Park Memorial Institute 1640培养基(RPMI 1640)(Montreal, QC, Canada)。 Brefeldin A,佛波醇12-肉豆蔻酸酯13-乙酸酯,FITC标记的抗小鼠CD3+抗体,FITC标记的抗小鼠CD4+抗体,PE标记的抗小鼠CD8+抗体,APC标记的抗小鼠IL-4抗体,Percp-cy5.5 标记的抗小鼠IFN-γ抗体,APC标记的抗小鼠CD25+抗体,(纽约,BD,USA)。IL-10和IL-12ELISA试剂盒购自R&D Systems(Minneapolis,MN,USA)。
1.1.2弓形虫虫株 Chinese1基因型的Wh6和Wh3两个虫株分离自流浪猫,成囊型的Wh6弱(无)毒株和Wh3强毒株均分别经小鼠接种传代保种和低温冻存[3]。将冻存的Wh3速殖子37 ℃水浴复苏,计数后注射到昆明小鼠腹腔内,稳定传代3代以上获得的速殖子分别用于实验鼠的慢性感染和攻击感染。无痛取Wh6株弓形虫保种3个月以上的昆明小鼠脑组织,生理盐水中无菌轻轻碾磨,制备混悬液,显微镜下计数包囊,用于实验鼠的灌胃感染。Wh3株虫体的制备同上,接种小鼠3 d后无痛处死,自腹腔液中分离速殖子,计数备用。
1.1.3实验动物 雌性BALB/c小鼠级别为SPF级,49~56 d龄,体重范围是20~25 g,购于济南朋悦实验动物繁育有限公司;雌性的昆明小鼠级别为洁净级,6~8周龄,体重范围为20~25 g,购自安徽省实验动物中心。
1.2 方 法
1.2.1小鼠模型的建立 6周龄雌性昆明小鼠和6~8周龄的雌性BALB/c获自安徽医科大学实验动物中心。在标准条件下给小鼠自由饮水和进食。严格按照安徽医科大学动物中心生物医学研究所的机构审查委员会制定的伦理标准(许可证号:AMU26-081108)遵循所有程序。在昆明鼠体内进行弓形虫包囊传代及保种,小鼠适应新环境1周后,将BALB/c鼠随机分成3组,每组10只动物。选取一组BALB/c鼠口服灌胃25~35个Wh6包囊(I组),包囊来自感染3个月以上的昆明小鼠脑组织匀浆。另外两组,一组使用等量PBS灌胃处理(II组),另一组不做任何处理(III组)作为正常对照。在感染后35 d,第I、II组用3 000个Wh3速殖子腹腔攻击感染。在Wh3速殖子感染后1周处死,收集3组小鼠的组织标本。
1.2.2制备单细胞悬液 分别将3组试验小鼠的脾脏无菌取出,置于200目铁滤网,加入适量的PBS,并用注射器针蕊轻轻研磨。将细胞悬液移到15 mL离心管中,并加满PBS。经2 500 r/min 4 ℃离心5 min,弃去上层PBS液;加入3 mL红细胞裂解液混匀,并置于4 ℃的冰箱中裂解10 min,在离心管加满PBS溶液,以2 000 r/min 4 ℃离心5 min。弃去上层PBS液,加入1 mL PBS溶液重悬定容。
1.2.3流式细胞术分析 将1 mL 10%FBS的RPMI 1640培养基加入24孔细胞培养板中,将计数后的脾细胞悬浮液加入板中(细胞数为1×106/ mL)。用于细胞内细胞因子染色,加入布雷菲德菌素A(1 mg/mL)、离子霉素(1 mg/mL)和PMA(20 ng/mL)刺激细胞5 h。一组细胞用FITC标记的抗小鼠CD4+抗体在4 ℃孵育30 min,另一组用FITC标记的抗小鼠CD3+和PE标记的抗小鼠CD8+抗体在4 ℃避光孵育30 min,并洗涤2次,根据厂家说明用Cytofix/Cytoperm试剂盒固定;加入Percp-cy5.5标记的抗小鼠IFN-γ和APC标记的抗小鼠IL-4抗体 4 ℃避光孵育30 min。洗涤后,加入细胞固定剂并在流式细胞仪上机检测。
1.2.4RNA提取和q-PCR 小鼠脾组织用TRIzol(Invitrogen Life Technologies,Carlsbad,CA,USA)裂解,并按照制造商说明使用Takara Kit(Takara,Japan)转录成cDNA。使用SYBR Premix Ex Taq试剂盒(Takara,Japan)通过Light Cycler 480进行定量分析,以检测IFN-γ、IL-12和IL-10的表达。使用甘油醛-3-磷酸脱氢酶(GAPDH)作为标准对照。用公式2-ΔΔCt比较ΔCt方法计算相对mRNA表达水平。所有引物见表1。实验重复3次。

表1 细胞因子引物序列Tab.1 Primer squences of cytokines detected by q-PCR
1.2.5酶联免疫吸附试验 将含有10%FBS的1 mL RPMI 1640培养基加入24孔板中培养脾细胞,每孔2×106个细胞,用离子霉素(1 mg/mL)和PMA(20 ng/mL)刺激脾细胞5 h。通过离心收获细胞上清液,ELISA检测IL-10和IL-12含量。每组设置3个重复孔。使用酶标仪(Biotek,Winooski,VT,USA)在450 nm下测量吸光度。

2 结 果
2.1强毒株Wh3攻击感染后小鼠的生存状况 初次攻击感染(Wh6株包囊)后35 d,所有小鼠存活。无痛剖杀小鼠取脑组织压片,镜检查见具有完整囊壁的圆形包囊,内含缓殖子(图1),表明慢性感染BALB/c鼠模型建立成功。在Wh3株速殖子攻击感染后第3~4 d时,I组小鼠出现一过性急性感染症状,表现为弓背、毛发竖立,随后症状逐渐减轻。1周后所有攻击感染鼠恢复正常,继续存活直至实验结束。同期PBS实验对照的II组小鼠在Wh3感染后第3~4 d时,出现弓背竖毛的症状,随天数增加症状逐渐加重,在第7 d内死亡5只小鼠,剩余小鼠在第8 d凌晨全部死亡(图2)。
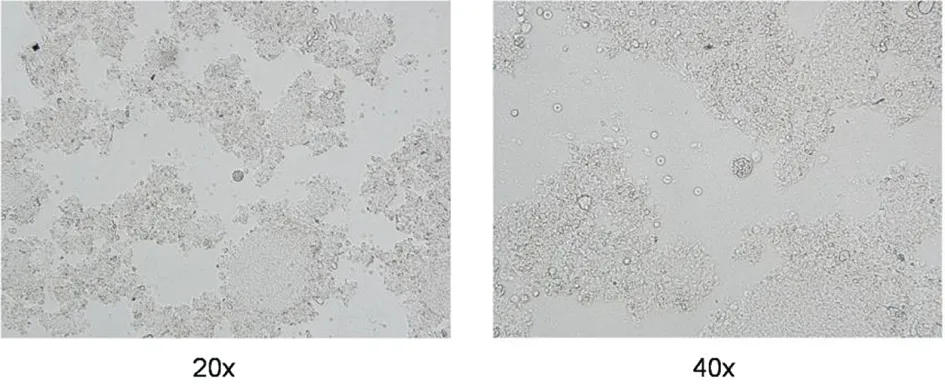
图1 普通光学显微镜下观察,Wh6株感染后35 d,BALB/c鼠脑组织压片中典型弓形虫包囊Fig.1 Optical microscopy appearance of brain tissue cysts in infected BALB/c mice with Wh6 stain of Toxoplasma gondii on day 35 post infection

图2 25-35个Wh6株包囊感染后42 d后,I组(蓝色)、II组(绿色)和III组(红色)BALB/c鼠存活状况Fig.2 At42 days postinfection, percent survival of Group I (Blue), Group II (Green) and Group III (Red) mice orally attacked with 25-35 T.gondii Wh6 strain cysts.The combined results of two experiments are shown (n=10)
2.2小鼠腹腔内速殖子计数 使用2 mL无菌生理盐水灌洗小鼠腹腔,镜下进行腹腔灌洗液速殖子计数。Wh3株攻击感染后第7 d,随机取3只II组小鼠进行腹腔虫荷计数,腹腔速殖子计数为1.28±0.0351×106/mL,而I组感染免疫小鼠Wh3株攻击感染后,腹腔灌洗液未查见速殖子。
2.3小鼠脾细胞上清液和脾组织中IFN-γ、IL-10和IL-12水平 为进一步探讨慢性弓形虫感染小鼠对强毒Wh3株攻击感染的免疫应答,在二次攻击感染后第8 d,剖杀各组全部的小鼠,取脾脏制成脾细胞悬液,培养收集上清,q-PCR和ELISA分别检测脾细胞上清液和脾组织IFN-γ、IL-10和IL-12水平。q-PCR结果显示,II组小鼠脾细胞中IFN-γ、IL-10和IL-12水平较I组、III组升高(F=719.1,P<0.001);I组动物的IFN-γ、IL-10和IL-12细胞因子水平低于II组(F=432.2,P<0.001),但高于正常组(F=67.47,P<0.001)(图3)。
与q-PCR结果一致,ELISA结果显示,II组鼠IL-10和IL-12水平较I组、III组升高(F=38.79,P<0.05)。I组小鼠的IL-10、IL-12水平仍高于正常组(F=87.34,P<0.01)(图4)。
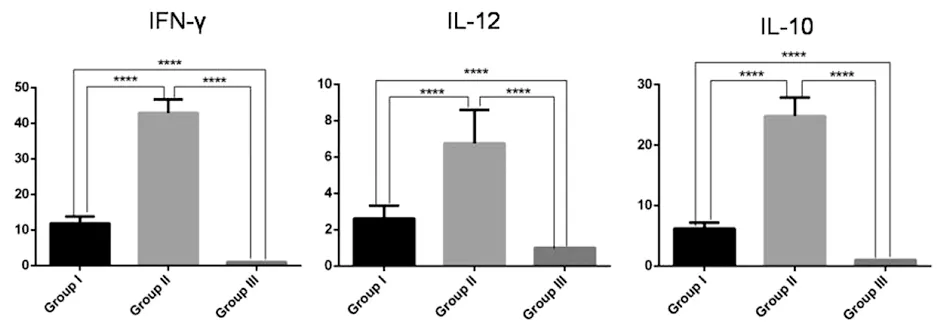
* P<0.05,** P<0.01,*** P<0.001图3 q-PCR分别检测I组、II组和III组鼠脾组织IFN-γ、IL-12和IL-10水平Fig.3 Levels of IFN-γ, IL-12 and IL-10 in the spleen tissues of Group I, Group II and Group III were detected by q-PCR

* P<0.05,** P<0.01,*** P<0.001图4 ELISA检测I组、II组III组鼠脾细胞上清IL-10和IL-12的水平(pg/mL)Fig.4 Levels of IL-10 and IL-12 (pg/mL) in the cultured splenocyte suspensions of Group I, Group II and Group III were determined by ELISA
2.4小鼠脾CD4+T细胞IFN-γ和IL-4表达 分离和培养原代脾细胞,流式细胞术检测IFN-γ和IL-4的水平,分析结果显示II组鼠IFN-γ和IL-4增高。I组小鼠IFN-γ和IL-4相比于II组表达降低,且低于正常组的水平(F=10.96,7.86;P<0.05)。见图5。
3 讨 论
弓形虫病最常见的感染方式是通过摄入含有包囊的食物和水[20]。在小肠中,从包囊中释放的缓殖子,转化为速殖子并在组织中繁殖。在免疫功能正常的机体,感染的宿主可以抑制虫体的增殖,虫体在脑组织和肌肉组织内形成包囊,宿主呈隐性或慢性感染状态。在艾滋病,肿瘤和器官移植等免疫功能低下的患者[10-11],隐性感染的包囊可被激活,包囊破裂,虫体释出,引起弓形虫脑炎或全身播散性弓形虫病等严重后果。研究表明,穿孔素(profilin)介导的CD8+T细胞活化可在此阶段从脑中除去繁殖阶段寄生虫[12]。已知宿主固有免疫和适应性免疫应答中经典途径活化的巨噬细胞(M1)分泌的IL-12以及NK、Th1等分泌的IFN-γ在宿主抗弓形虫免疫应答中发挥关键作用。Wh6株携带致密颗粒蛋白GRA15II,在急性感染阶段可直接激活NF-κB,诱导M1的活化[13]。M1的极化可有效启动Th1型适应性免疫应答。感染诱导的免疫力可以通过上调小鼠细胞免疫相关GTP酶(immunity-related GTPaseIRGs),IRG在PVM上累积,导致PVM破裂和弓形虫裂解[14]。细胞中的病原体也可通过触发呼吸爆发和释放一氧化氮(NO)而被杀灭。
弓形虫至今尚无有效的防治药物,安全有效的疫苗是防治弓形虫病的策略之一,弓形虫疫苗的研发经历了活疫苗、减毒活疫苗、灭毒疫苗、蛋白疫苗、核酸疫苗等几个阶段。灭活疫苗、蛋白疫苗和核酸疫苗都有一定的干预作用,但存在返毒现象和缺乏有效保护力等问题[15-17]。减毒活疫苗是将病原体经过人工处理,虽然大大降低其致病性,但仍可能存在一定致病性和免疫原性等问题。利用弓形虫速殖子制成的弱毒活疫苗可以诱发机体产生与天然主动免疫相似的免疫应答,其免疫效果强于灭活疫苗[18]。
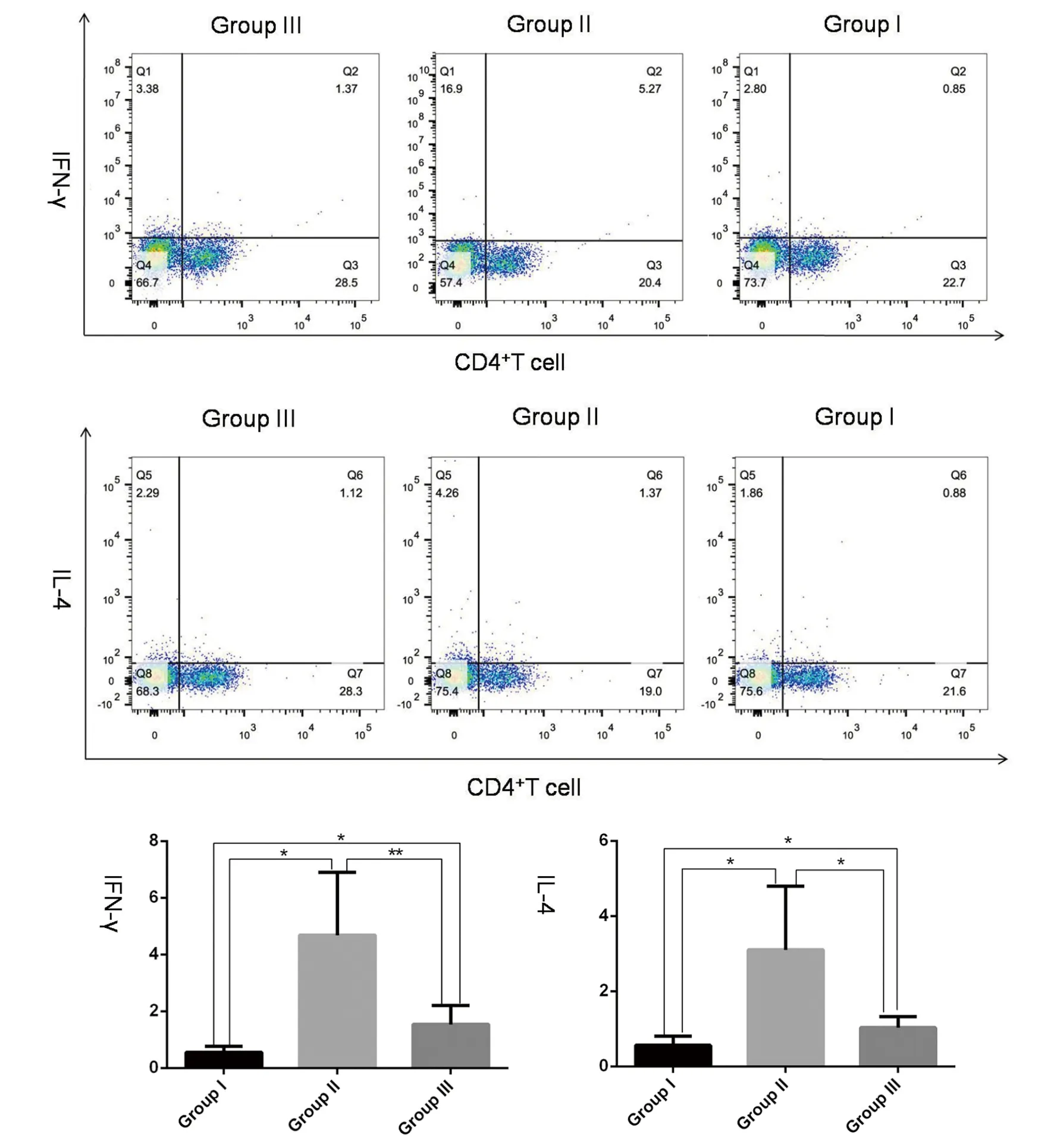
* P<0.05,** P<0.01,*** P<0.001图5 流式细胞术检测I组、II组和III鼠原代脾细胞中CD4+T细胞INF-γ和IL-4水平(%)Fig.5 At 42 days postinfection,level of INF-γ and IL-4 in primary splenocyte CD4+ Tcells from mice in Group I, Group II and Group III detected by Flow cytometry, respectively
S48株是从流产的羊体内分离出来,速殖子在小鼠体内经过多次传代,失去了形成包囊的能力[19-20]。用减毒活疫苗S48免疫羊后可以明显减少其体内的弓形虫数量,现已在动物体内推广使用[21]。理想活虫疫苗不仅能够刺激机体产生有效保护性,而且不具备在体内增殖和播散能力。近年Fox等研发出一株尿嘧啶营养缺陷型非复制型II型虫株的减毒活疫苗,接种小鼠后既无毒力,在体内也不成囊,因此无引起慢性感染的安全性问题。此外,该疫苗可诱导小鼠产生抗强毒I型或弱毒II型虫株急性感染的完全的保护力,有望成为基因改造的活虫疫苗[22]。Wh6虫株是从我国流浪猫体内分离而获得,属于Chinese 1型的弱(无)毒株,对感染动物仅有轻微的致病作用。实验动物常呈一过性自愈的慢性感染,并且成囊数量较少。而且Chinese 1型虫株具有ROP16I/ III和GRA15II多态性。在感染孕鼠模型中,虽然Wh3虫株和Wh6虫株都能够诱导孕鼠滋养层细胞凋亡,但是其母胎界面免疫极化机制不同,Wh3虫株诱导巨噬细胞M2/Th2方向极化。而Wh6虫株诱导巨噬细胞向M1/Th1方向极化[4,23-25]。鉴于Wh6虫株这些特性,因而具有成为候选活虫减毒疫苗虫株的潜在应用价值。
本研究结果显示,弱毒株Wh6感染的机体可抵抗强毒株Wh3致死性入侵,推测与下列因素有关:1)虫株Wh6毒力弱,Wh6虫株诱导巨噬细胞向M1/Th1方向极化[4,23-25],致密颗粒蛋白GRA15II 和Profilin是重要的免疫诱导因子,可在急慢性感染阶段有效驱动M1-Th1型应答[13,26];2)相比较正常小鼠体内IFN-γ水平,活虫感染能够刺激机体较长时间持续产生相对较高的IFN-γ水平。有文献报道弓形虫慢性感染的小鼠能使小鼠体抵抗李斯特菌等细菌的致死性感染[27];3)Wh6与强毒株Wh3同属于Chinese 1基因型,具有良好的交叉免疫保护性。
弓形虫感染小鼠体内免疫应答,细胞因子表达水平是动态变化的,与不同感染时间有关,IFN-γ的表达水平在感染1月后呈下降趋势[28]。本研究结果显示,在攻击感染后期,I组小鼠Th1细胞因子IFN-γ明显低于II感染组小鼠但高于正常对照组。推测其原因,第一,Wh6株慢性感染的小鼠体内CD4+CD25+的细胞群的比例上升[29],流式检测结果中,I组小鼠攻击感染后,CD4+T表达IFN-γ不仅低于II感染组小鼠也低于正常对照组,但是I组小鼠体内IFN-γ总水平是高于正常对照小鼠的,可能是IFN-γ的分泌不只是来源于CD4+T细胞。第二,BALB/c鼠在慢性感染过程中,可能产生对Th1细胞因子的免疫抑制作用[29],因为Wh6具有ROP16I/ III和GRA15II多态性,Wh6虫株虽然结局上诱导巨噬细胞向M1/Th1方向极化,但ROP16I/ III可能依然起作用,会抑制Th1细胞因子的分泌[30-31]。过高水平的Th1炎性因子也可能对小鼠造成病理损伤,甚至导致小鼠死亡,本研究中Wh3攻击感染,抑制了过高水平的IFN-γ的产生,间接发挥了免疫保护作用,使得小鼠不会死于过高水平的Th1炎性因子[32-33]。综上所述,Wh6株感染小鼠,可能获得了对Th1细胞因子的免疫抑制性,在Wh3株急性攻击感染小鼠时,避免产生急剧的Th1细胞因子水平的上升,超过小鼠自身耐受,达到致死性水平。但是Th1细胞因子总体水平与正常小鼠相比是上升的,使得小鼠可以清除体内的速殖子,控制了速殖子的繁殖,让小鼠成功的存活下来。
利益冲突:无
引用本文格式:陈守斌,何佳丽,崔雯,等.弓形虫Chinese 1基因型Wh6弱毒株感染小鼠抗强毒株致死性感染的免疫保护作用[J].中国人兽共患病学报,2020,36(2):87-93. DOI:10.3969/j.issn.1002-2694.2020.00.013
