CD38在不同组织和自然杀伤细胞/T细胞淋巴瘤中的表达
2020-04-06付晓瑞孙振昌张明智
李 静,付晓瑞,孙振昌,张明智
(郑州大学第一附属医院肿瘤科,河南 郑州 450052)
自然杀伤细胞/T细胞淋巴瘤(natural killer/T cell lymphoma, NKTCL)是一种高度侵袭性淋巴瘤,约占非霍奇金淋巴瘤的5%~18%[1-3],以结外病变为主,好侵及鼻或面中线部,并伴有组织坏死和血管侵袭,为进行性、破坏性病变[4]。肿瘤细胞具有细胞毒性,表达CD56、CD2、CD3ε和CD30等。流行病学调查示,NKTCL的发病具有明显的地域分布,亚洲及拉丁美洲较欧、美国家明显多发,中位发病年龄为44~55岁,其发病机制尚不明确,可能与EB病毒感染具有高度相关性。对于NKTCL,国际上尚未出现统一标准的化疗方案,其化疗敏感性低,预后差,生存期短,早期治疗常以单独放疗或联合化疗为主,进展期以化疗为主,部分患者可获短暂缓解却极易复发,造血干细胞移植并不能改善NKTCL患者预后。
局限期(Ann Arbor分期Ⅰ、Ⅱ期)NKTCL对放疗较为敏感,但缓解期短,约一半患者短期内复发,纵然接受放化疗联合治疗,5 a生存率也只有约50%;而对于晚期或进展期(Ann Arbor分期Ⅲ、Ⅳ期)患者,常规予以蒽环类药物为基础的治疗方案,但疗效不佳,肿瘤细胞高表达P-糖蛋白导致其对蒽环类药物耐药[5]。无论是美国NCCN指南还是欧洲ESMO指南均推荐以门冬酰胺酶为基础的方案,其显著改善了临床疗效。即便如此,每年仍有相当一部分患者出现耐药或复发,5 a生存率低于30%。对此类人群迫切需要新的治疗方法[6-8]。
血液恶性肿瘤具有高侵袭性和预后不良等特征,长期以来治疗效果并不令人满意[9-10],随着对疾病认识的深入,越来越多靶向药物和免疫治疗手段的应用为这些疾病的治疗带来一线曙光,尤其是嵌合抗原受体T(CAR-T)细胞治疗近年来取得了令人瞩目的效果。然而单克隆抗体药物和CAR-T细胞治疗取得非凡的临床疗效的同时,也增加了对药物安全性评估的要求。本研究利用标准免疫组化技术检测CD38与非靶器官的结合,可为临床药物监测毒性提供参考。此外,检测NKTCL中CD38的表达探讨其作为免疫治疗靶标的可能性。
1 材料与方法
1.1 材料来源本研究收集郑州大学第一附属医院病理科存档的209例标本,包括169例不同部位正常组织、20例NKTCL组织、20例淋巴结增生组织。所有组织均经40 g/L甲醛固定并包埋在石蜡中。
1.2 标准免疫组化技术检测CD38方法所有切片均为连续切片,经梯度乙醇脱蜡、水化,根据说明书使用S-P试剂盒(北京天根生化科技有限公司)进行了免疫组化染色,检测CD38蛋白在不同组织中的表达和定位。结果由2位经验丰富的病理科医生进行评估。对阳性细胞的百分比评分如下:0分为阴性表达,阳性细胞数<5%;1分为弱阳性,阳性细胞数5%~<25%;2分为中度阳性,阳性细胞数25%~<50%;3分为强阳性,阳性细胞数≥50%。
1.3 流式细胞术检测CD38方法使用含体积分数10%胎牛血清和青霉素(1 000 u/mL)/链霉素(10 μg/mL)的RPMI-1640培养基(美国Gbico公司)培养NKTCL细胞系。以1 000 r/min速度离心细胞5 min,加入100 μL磷酸盐缓冲液(PBS),然后在4 ℃下用CD38抗体(美国BD公司)或同型对照抗体对表面染色15 min;之后用PBS洗3遍样品并用FACS缓冲液重悬于流式管中,然后使用FACS Canto流式细胞仪(美国BD公司)进行上机收集数据。使用FlowJo V10(美国FlowJo公司)进行数据分析。NKTCL细胞系中CD38表达评分标准为:阳性细胞数超过阴性对照百分比≥80%为阳性,10%~<80%为部分表达,<10%为阴性。
1.4 统计学处理采用SPSS 21.0进行数据分析,CD38在NKTCL组织和增生淋巴结组织中的表达比较用秩和检验,检验水准α=0.05。
2 结果
2.1 CD38在不同组织中的表达169例不同解剖部位的正常组织中,CD38在脾、精囊腺、扁桃体、输卵管和乳腺组织中呈现广泛的强阳性表达,在前列腺、肺、膀胱、肾和直肠组织中显示不同程度的阳性表达,其余组织中CD38阴性表达。在人类蛋白质谱数据库(https://www.proteinatlas.org/)中搜索发现,CD38仅在前列腺、精囊腺、淋巴结和扁桃体中强阳性表达,而在阑尾、脾和骨髓中弱阳性表达。这与我们结果中CD38在脾、精囊腺和扁桃体中的强阳性表达基本相吻合。输卵管和乳腺作为女性生殖系统也呈强阳性表达,表明CD38可能在生殖系统中高表达。肺、膀胱、肾和直肠的阳性表达可能是由于炎症细胞浸润引起CD38的高表达,该结果也可能与人种差异有关。总之,我们对CD38表达的免疫组化研究结果与数据库研究结果高度吻合。见表1、图1。
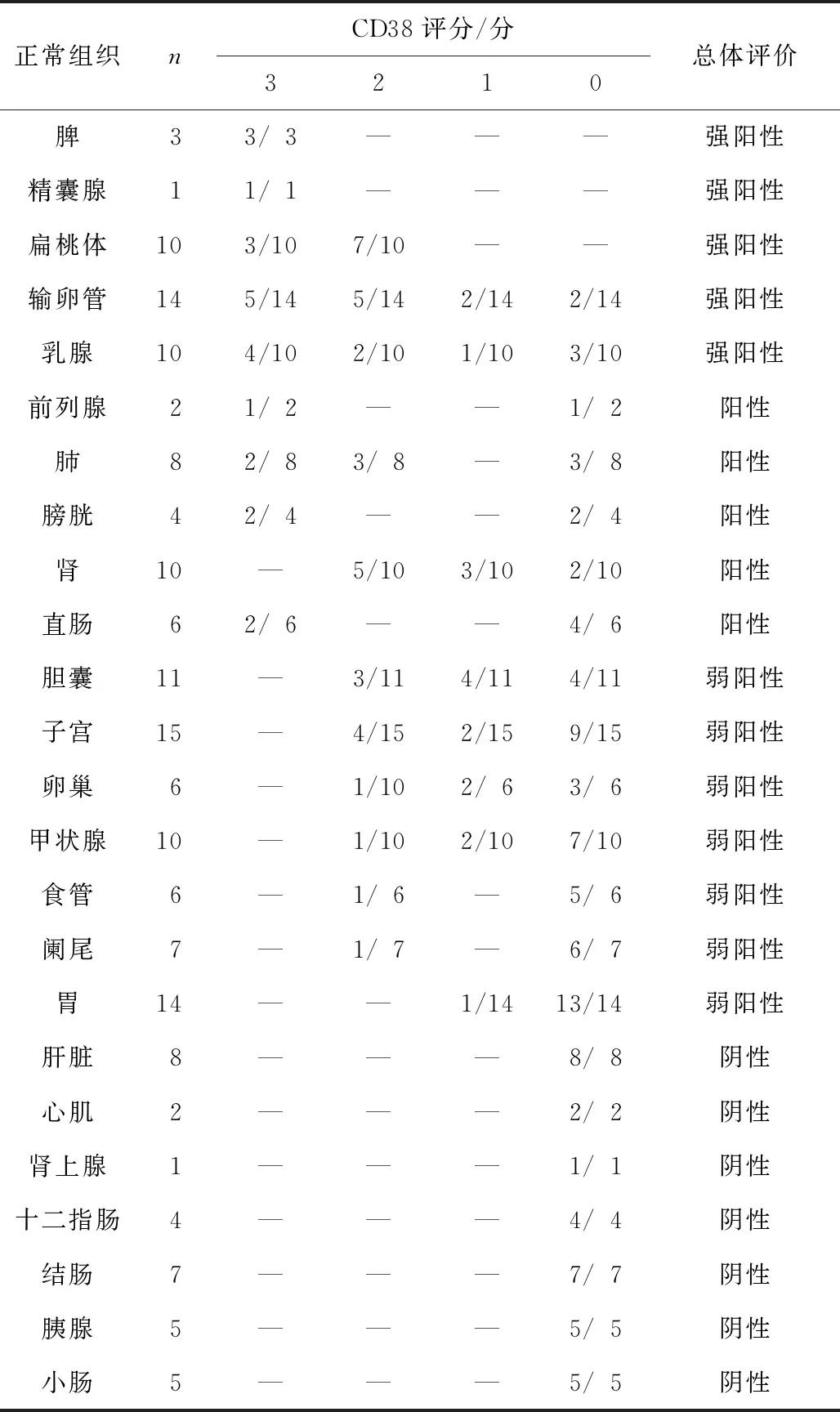
表1 不同组织中CD38蛋白表达
2.2 CD38在NKTCL和增生淋巴结组织中的表达NKTCL组织(强阳性8例,中度阳性6例,弱阳性2例,阴性4例)中CD38表达高于增生淋巴结组织(强阳性0例,中度阳性10例,弱阳性2例,阴性8例),差异有统计学意义(Z=2.394,P=0.017)。NKTCL细胞系中CD38也显示高表达,其中NKL和YT细胞系中阳性表达,NKYS细胞系中部分表达,而KHYG-1细胞系中阴性表达。提示CD38可能是NKTCL的免疫治疗靶标。见图1、2。
图1 不同组织中CD38的表达
3 讨论
CD38是Ⅱ型跨膜糖蛋白,具有酶活性,可催化环腺苷二磷酸核糖的合成与降解,在细胞钙离子平衡调控中起重要作用。此外,CD38与配体CD31相互作用,在调节细胞迁移、受体介导的黏附以及信号传导中也扮演着重要角色。在许多造血系统的恶性肿瘤(如非霍奇金淋巴瘤、多发性骨髓瘤[11]、Waldenström巨球蛋白血症[12]、急性粒细胞白血病[13]和慢性淋巴细胞白血病)中,CD38的表达均有上调。此外,CD38还可以在几种造血细胞中表达,包括自NK细胞、单核细胞以及部分T细胞和B细胞[14]。在某些免疫抑制细胞(如髓源性抑制细胞、调节性T细胞、调节性B细胞和某些NK细胞亚型)中也出现CD38蛋白表达。CD38-烟酰胺腺嘌呤二核苷酸信号通路可以促进这些免疫抑制细胞的活性,并与抑制性肿瘤微环境的形成有关,间接促进肿瘤的免疫逃逸[15-19]。
CD38的表达使其成为治疗性抗体药物的开发靶点。目前,现已有daratumumab和isatuximab等2种CD38单抗获批上市,适应证均为多发性骨髓瘤。CD38单抗主要通过补体依赖性细胞毒性反应和抗体依赖性细胞毒性反应等抗体Fc片段介导的免疫机制杀伤肿瘤细胞,并可诱发抗体依赖性吞噬和肿瘤细胞凋亡。此外,CD38抗体还可以拮抗调节性T细胞和调节性B细胞介导的免疫抑制,从而整体激活机体的免疫反应。
CD38在NKTCL组织中的高表达使得其可能作为治疗靶点被作用。本文结果也证实,NKTCL组织中CD38表达高于增生淋巴结组织。一项回顾性研究[20]表明,在94例NKTCL患者中,只有5%的患者CD38阴性表达,超过50%的患者强阳性表达,且CD38的高表达与预后不良相关。而daratumumab单药治疗复发、难治性NKTCL的临床试验研究(NCT02927925)结果显示,在32例患者中50%的患者CD38表达≥50%,客观缓解率为25.0%,中位随访时间为16.7个月,一些患者实现了肿瘤缩小和EB病毒负荷降低,但没有患者达到完全缓解。在血液学毒性中,最常见的是血小板减少、贫血、白细胞减少和中性粒细胞减少[21]。基础研究同样发现,daratumumab能有效裂解高表达CD38的NKTCL,此外还发现L-天冬酰胺酶与daratumumab联合使用对CD38高表达NKTCL细胞具有协同的细胞毒性作用[22]。总体而言,作为NKTCL的新治疗靶标,CD38单抗仍处于探索性研究阶段,与其他药物联合治疗可能带来更好的疗效。
肿瘤组织高表达、正常组织低表达也使CD38可能成为CAR-T细胞治疗的靶标。Mihara等[23]通过体外和体内研究发现,CD38 CAR-T细胞可以有效裂解耐药的非霍奇金淋巴瘤细胞。他们随后证实,CD38 CAR-T细胞可以靶向具有多重耐药性的多发性骨髓瘤患者的肿瘤细胞和多发性骨髓瘤细胞系,并且在动物模型中观察到同样的现象[24]。CD38 CAR-T细胞治疗复发、难治性多发性骨髓瘤的临床试验也在开展,但CAR-T细胞重要的不良反应之一脱靶效应值得人们重视。因此在CD38 CAR-T细胞的设计中,研究人员应考虑双靶联合或使用可控开关以避免对非靶标器官的损伤。在临床应用中,还应考虑检测非靶器官的特异指标,以便早期发现损伤。
尽管daratumumab在复发、难治性多发性骨髓瘤中显示出较好的疗效,但仍存在一些不容忽视的不良反应。无论是daratumumab单药治疗还是联合治疗多发性骨髓瘤的临床试验中,最常见的不良事件是与输液相关的反应。此外,超过Ⅲ度的严重不良反应包括贫血、中性粒细胞减少、血小板减少、肺炎、上呼吸道感染和高血压[25-28]。在临床试验GEN501、CASTOR 和POLLUX研究中观察到肺炎的发生率分别为7%、8%和8%,可能与本研究发现的肺组织存在CD38阳性表达密切相关。这提示临床医生使用CD38单抗治疗血液系统肿瘤时,应关注CD38高表达组织可能产生的损伤反应。
综上所述,CD38在各组织中表达有限,在NKTCL组织中高表达,可以作为免疫治疗靶标。靶向CD38治疗时,临床医生应考虑到对高表达CD38的非靶器官造成的可能损害。该研究可为临床药物安全性提供参考,并帮助临床医生警惕高表达组织的损伤或不良反应,进行针对性的提前预防。此外,该研究结论可能为使用CD38作为免疫治疗靶标提供背景支持。
