微循环障碍对高龄脓毒性休克患者组织灌注和死亡率的影响
2020-04-01尚宝朋叶观宇殷旭升李志波陈国祥
尚宝朋 叶观宇 殷旭升 李志波 陈国祥
微循环障碍是血液理化性质发生改变,使血流减慢、血栓形成,导致局部组织缺血缺氧,进而导致组织坏死,从而引发一系列临床症状的病变[1]。脓毒性休克是指由于脓毒症引起的休克,高龄脓毒性休克患者往往合并不同程度的微循环障碍[2],对患者的心血管临床指标和预后可能存在不同程度的影响。本研究选取我院收治的高龄脓毒性休克患者进行临床对比,分析微循环障碍对高龄脓毒性休克患者的影响,现报道如下。
1 材料与方法
1.1 一般资料选取2018年5月~2019年8月在我院治疗的高龄脓毒性休克患者50 例,纳入标准[3]:①符合脓毒性休克诊断;②年龄>75 岁;③放置上腔静脉导管、股动脉导管并进行脉搏指示持续心排出量(PiCCO)监测;④经充分液体复苏使其达到中心静脉压(CVP)>8mmHg、MAP ≥65mmHg、心指数(CI)2.0~4.0L·min-1·m-2;⑤接受镇静治疗,Rass 评分-2~0 分;⑥存活时间>24h。排除标准[4]:①活动性出血、血红蛋白不稳定者;②经过扩容、血管收缩药物、正性肌力药物等治疗,循环状态仍不稳定者(定义为需要持续增加血管收缩药物或正性肌力药物的剂量);③经过气道管理、机械通气等治疗,动脉血氧饱和度(SaO2)<90%或动脉血中二氧化碳分压(PaCO2)>50mmHg 者;④入选后24h 内紧急手术者;⑤研究期间放弃治疗者。
入选患者均进行心排出量监测、接受充分液体复苏,使其达到中心静脉压≥8mmHg、平均动脉压≥65mmHg、心指数2.0~4.0L·min-1·m-2。根据PvaCO2/Ca-vO2和Pv-aCO2,将患者分为对照组(PvaCO2/Ca-vO2<1.4mmHg/ml,20 例)、低灌注组(PvaCO2/Ca-vO2>1.4mmHg/ml 且Pv-aCO2>6mmHg,18例)和正常灌注组(Pv-aCO2/Ca-vO2>1.4mmHg/ml且Pv-aCO2<6mmHg,12 例)。对照组:男8 例,女12例,年龄75~95 岁,平均(82.11±3.12)岁;低灌注组:男7 例,女11 例,年龄76~90 岁,平均(83.02±3.45)岁;正常灌注组:男4 例,女8 例,年龄76~91 岁,平均(83.17±3.40)岁。3 组患者性别、年龄等一般资料差异均无统计学意义(P>0.05),具有可比性。
1.2 研究方法监测3 组患者的体温、心率(HR)、CVP、MAP、CI、血红蛋白(Hb)、动脉血氧饱和度(SaO2)、中心静脉血氧饱和度(ScvO2)、急性生理与慢性健康(APACHE-Ⅱ)评分、动脉血乳酸(Lac),计算患者6h 和24h 乳酸清除率(Clac)、28 天死亡率。
血流动力学指标监测:所有患者放置颈内或锁骨下静脉导管、股动脉导管;CI 采用经肺热稀释法,由监护仪测量和计算,连续3 次,取平均值。HR、CVP、MAP 由监护仪读取。抽取股动脉血进行血气分析,记录 PaCO2、PaO2、SaO2、Lac、Hb。抽取中心静脉血进行血气分析,记录PvCO2、PvO2、ScvO2。
1.3 观察指标心指数:是以每平方米体表面积计算的心输出量。心指数=(心率×每搏输出量)/体表面积。血红蛋白:是红细胞内运输氧的特殊蛋白质,是使血液呈红色的蛋白,由珠蛋白和血红素组成,成人正常值为110~165g/L。血氧饱和度:是血液中被氧结合的氧合血红蛋白(HbO2)的容量占全部可结合的血红蛋白容量的百分比,即血液中血氧的浓度。急性生理与慢性健康(APACHE-Ⅱ)评分[5]:包括3 部分,即急性生理评分、年龄评分及慢性健康评分。通过对多项生理学参数异常程度进行量化,对患者生理健康情况进行评定。血乳酸:是体内糖代谢的中间产物,主要由红细胞、横纹肌和脑组织产生,血液中的乳酸浓度主要取决于肝脏及肾脏的合成速度和代谢率。
1.4 统计学方法采用SPSS 19.0 软件进行统计学分析,计量资料以±s表示,采用t检验,计数资料以%表示,采用卡方检验,两个有序分类变量间的关系采用Kendall's tau-b 相关性分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 临床指标对比3 组患者体温、CVP、MAP、ScvO2相比,差异无统计学意义(P>0.05),HR、CI、Hb、SaO2、APACHE-Ⅱ评分差异均有统计学意义(P<0.05)。低灌注组的CI、Hb、SaO2均明显低于正常灌注组和对照组,HR 与APACHE-Ⅱ评分明显高于正常灌注组和对照组,差异有统计学意义(P<0.05)。正常灌注组的CI、Hb、SaO2也明显低于对照组,HR 与APACHE-Ⅱ评分则明显高于对照组,差异均有统计学意义(P<0.05)。见表1。
2.2 血乳酸情况对比3 组患者动脉血乳酸值、6h乳酸清除率、24h 乳酸清除率差异均有统计学意义(P<0.05)。低灌注组的动脉血乳酸明显高于正常灌注组和对照组,6h 和24h 乳酸清除率明显低于正常灌注组和对照组,差异均有统计学意义(P<0.05)。正常灌注组的动脉血乳酸明显高于对照组,6h 和24h 乳酸清除率明显低于对照组,差异均有统计学意义(P<0.05)。见表2。
表1 3 组患者心血管临床指标对比(±s)

表1 3 组患者心血管临床指标对比(±s)
注:与对照组比较,aP<0.05;与正常灌注组比较,bP<0.05
APACHE-Ⅱ评分低灌注组(n=18) 36.56±0.38 70.27±5.21ab 7.21±1.88 66.74±8.25 1.60±0.38ab 8.40±2.72ab 90.28±1.47ab 73.13±5.50 25.12±2.72ab组别 体温(℃)HR(次/min)CVP(mmHg)MAP(mmHg)CI(L·min-1·m-2)Hb(g/L)SaO2(%)ScvO2(%)正常灌注组(n=12) 36.65±0.36 67.35±4.26a 7.13±2.01 64.80±7.38 2.04±0.43a 52.36±8.20a 94.56±1.52a 74.28±5.73 22.03±2.28a对照组(n=20) 36.62±0.31 62.68±5.74 7.18±1.92 65.34±7.52 2.62±0.32 101.24±12.46 98.26±0.45 73.67±5.26 19.36±2.78 t 0.269 10.157 0.006 0.264 36.311 504.19 214.837 0.161 22.399 P 0.765 <0.001 0.994 0.769 <0.001 <0.001 <0.001 0.852 <0.001
表2 3 组患者血乳酸情况对比(±s)
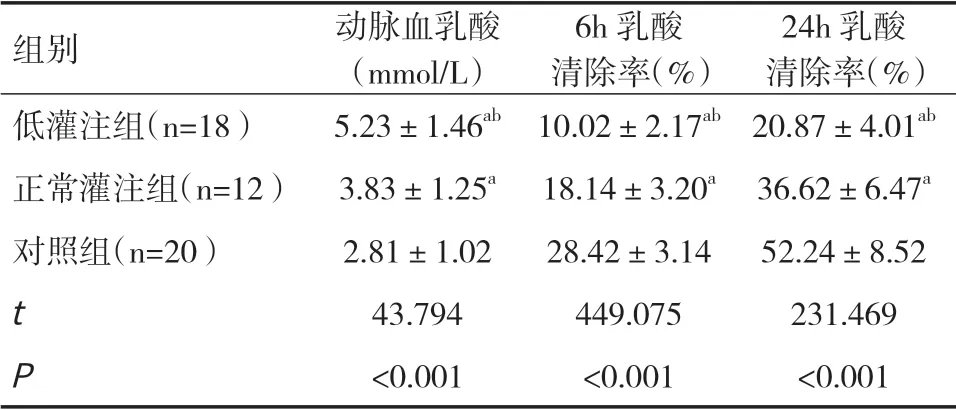
表2 3 组患者血乳酸情况对比(±s)
注:与对照组比较,aP<0.05;与正常灌注组比较,bP<0.05
24h 乳酸清除率(%)低灌注组(n=18) 5.23±1.46ab 10.02±2.17ab 20.87±4.01ab正常灌注组(n=12) 3.83±1.25a 18.14±3.20a 36.62±6.47a对照组(n=20) 2.81±1.02 28.42±3.14 52.24±8.52 t 43.794 449.075 231.469 P<0.001 <0.001 <0.001组别 动脉血乳酸(mmol/L)6h 乳酸清除率(%)
2.3 28 天死亡率对比3 组患者28 天死亡率差异有统计学意义(P<0.05)。低灌注组的28 天死亡率(66.67%,12/18)明显高于正常灌注组(41.67%,5/12)和对照组(15.00%,3/20),差异具有统计学意义(χ2=11.178,P=0.004)。正常灌注组的28 天死亡率明显高于对照组,差异具有统计学意义(P<0.05);Kendall's tau-b 相关性分析结果显示,死亡风险与灌注程度呈负相关(r=-0.434,P<0.05)。
3 讨论
微循环障碍和脓毒性休克密切相关,脓毒性休克又称感染性休克,其发病机理是人体感染的细菌产生细菌毒素,如内毒素、白三烯、脂氧合酶、组织胺等,导致血液进入微血管进行交换的功能受损,O2供应和CO2排出减少,组织灌注下降,进而使脑部和肾脏器官受到影响,引发多脏器衰竭,最后出现心排出量减少而出现典型的休克症状[6]。组织灌注的持续不足以及休克的持续发展,会使机体越来越多的脏器衰竭,最终导致死亡。
本研究结果显示,低灌注组的CI、Hb 与SaO2明显低于正常灌注组和对照组,HR 与APACHE-Ⅱ评分明显高于正常灌注组和对照组,而正常灌注组的CI、Hb 与SaO2均明显低于对照组,HR 与APACHE-Ⅱ评分则明显高于对照组。可能的机制是,当肺泡通气量和二氧化碳的产生速度保持稳定时,组织灌注不足将导致组织二氧化碳蓄积,表现为Pv-aCO2升高和Pv-aCO2/Ca-vO2比值升高[7,8]。PvaCO2和Pv-aCO2/Ca-vO2比值升高幅度越大,证明组织灌注不足越严重,心输出量下降越多,患者病情更严重,APACHE-Ⅱ评分升高。而心输出量=心指数×体表面积=心率×每搏输出量,由于体表面积不变,心输出量下降可印证心指数(CI)的下降,而心每搏输出量明显降低,可能导致HR 升高。低灌注组的动脉血氧饱和度明显更低,而中心静脉血氧饱和度3 组无明显差异,这也和Pv-aCO2值、Pv-aCO2/Ca-vO2比值的变化趋势相符合,而动脉血氧饱和度越低,血红蛋白含量越低。
本研究结果还显示,低灌注组的动脉血乳酸明显高于正常灌注组和对照组,6h 和24h 乳酸清除率明显低于正常灌注组和对照组;同时,正常灌注组的动脉血乳酸明显高于对照组,6h 和24h 乳酸清除率明显低于对照组。可能的机制是,组织灌注不足会导致细胞缺氧,无氧代谢增强[9],导致循环系统的乳酸清除产生障碍,于是乳酸清除率降低,产生持续的高乳酸血症。本研究结果显示,低灌注组的28天死亡率明显高于正常灌注组和对照组,正常灌注组的28 天死亡率明显高于对照组,死亡预后与以Pv-aCO2/Ca-vO2和Pv-aCO2值划分的灌注程度呈显著负相关。可能的机制是,微循环障碍和组织灌注不足,导致心输出量不足、脓毒性休克、高乳酸血症,这些病症继续发展,最终导致包括心力衰竭在内的人体多脏器衰竭[10],继而死亡。
综上所述,Pv-aCO2/Ca-vO2、Pv-aCO2值与高龄脓毒性休克患者的预后呈明显负相关,临床上可通过检测Pv-aCO2/Ca-vO2、Pv-aCO2值,及早做出合理诊断。
