基于密码子优化策略的牛妊娠相关糖蛋白9(bPAG9)的原核表达及纯化
2020-03-27卢春霞刘长彬石国庆杨华
卢春霞 刘长彬 石国庆 杨华

摘要:为了构建pET30a-bPAG9重组表达载体,并在BL21(DE3) 感受态细胞中转染高效表达牛妊娠相关糖蛋白9(bPAG9),通过生物信息学技术对bPAG9基因进行密码子优化,人工合成bPAG9全基因序列,经双酶切法将bPAG9基因插入到表达载体pET30a中。将构建的重组质粒pET30a-bPAG9转染至BL21(DE3) 感受态细胞中进行原核表达,经过超声波裂解和亲和层析方法获得重组蛋白bPAG9。用SDS-PAGE 和 Western Blot方法检测重组蛋白bPAG9的表达效果。结果显示,PCR扩增得到1 128 bp的优化bPAG9基因片段,构建的重组质粒pET30a-bPAG9经双酶切获得约5 244 bp和1 125 bp的2条片段,与预期值相符;对重组载体测序,测序结果与优化后的基因碱基序列完全一致,编码的氨基酸序列未发生突变;SDS-PAGE 和 Western Blot 鉴定结果显示,获得相对分子质量约为4.0×104的bPAG9重组蛋白,通过亲和层析纯化后,重组蛋白bPAG9纯度到达90%以上。
关键词:牛妊娠相关糖蛋白;密码子;重组蛋白;原核表达
中图分类号:S823.9+13+.5文献标识码:A文章编号:1000-4440(2020)01-0122-08
Abstract:To construct the recombinant expression vector pET30a-bPAG9 and express bovine pregnancy associated glycorprotein-9(bPAG9) in BL21(DE3) cells, the codons of original bPAG9 gene were redesigned and optimized by bioinformatics techniques. Furthermore, the codon-optimized gene bPAG9 was synthesized by PCR and connected with pET30a vector by double digestion. The pET30a-bPAG9 expression vector was constructed and transfected into BL21(DE3) cells. The recombinant protein bPAG9 was obtained by ultrasonic lysis and affinity chromatography. SDS-PAGE and Western blotting were performed to detect the expression of the recombinant protein bPAG9. The results showed that the optimized bPAG9 gene fragment of 1 128 bp was obtained by PCR. After amplification and enzymatic digestion, two fragments of 5 244 bp and 1 125 bp were obtained from pET30a-bPAG9 expression vector. These results were consistent with expectations. The sequencing results of recombinant vector showed that the base sequence of bPAG9 gene in expression vector was consistent with the optimized gene, and the amino acid was not mutated. The results Westernblotting and SDS-PAGE indicated that the recombinant protein bPAG9 with the relative molecular weight of about 4.0×104 was successfully expressed in BL21(DE3) cells. The purity of recombinant protein bPAG9 was over 90% after purification by affinity chromatography.
Key words:bovine pregnancy associated glycoprotein;codon;recombinant protein;prokaryotic expression
妊娠相關糖蛋白 ( Pregnancy-associated glycoproteins,PAG) 是偶蹄类动物胎儿胎盘滋养层细胞合成、分泌的一类糖蛋白。1991年Zoli 等[1]从奶牛胎盘中分离得到相对分子质量为6.7×104的糖蛋白,与Butler等[2]发现的妊娠特异性蛋白 B ( PSPB )有着高度的相似性,构成了一个庞大的胎盘糖蛋白家族,统称PAG。PAG属于天冬氨酸蛋白酶家族,与胃蛋白酶、组织蛋白酶D、组织蛋白酶E有50%以上的相同氨基酸序列,但大多数PAG由于催化位点氨基酸发生置换使得其没有酶活性。牛妊娠相关糖蛋白(bPAG)基因家族至少有 22 个转录本以及变异体,由胎盘滋养外胚层细胞和滋养外胚层的双核细胞表达产生,有些在胚胎附植后进入母体血液 [3-5],且整个孕期持续存在,常作为一种标志物用于家畜早期妊娠诊断[6-8]。
目前,基于免疫分析的商品化PAG检测试剂盒在国外已大规模推广应用,并取得较高的诊断准确率[9-10]。但国内关于PAG相关研究报道较少,无商品化的PAG蛋白和抗体销售,而进口试剂盒检测成本过高,限制了其在国内牧场的推广应用。因此,如何获取高纯度PAG蛋白,研发相应的快速检测方法及产品,是规模化养殖业急需解决的问题。
目前,已有研究者从多种哺乳动物胎盘子叶中分离出PAG 天然蛋白 [1, 11-12],但是纯化步骤繁琐复杂,需要多种纯化方法同时使用才能获得高纯度的PAG。也有人利用豌豆凝集素[13-14]及胃蛋白酶抑制剂[15-16]等特异性结合PAG,通过亲和层析法分离获得PAG,但该法成本较高,不利于PAG蛋白的大量纯化。而体外重组蛋白技术为PAG结构、功能和应用研究提供了新思路,目前已有人在真核系统中表达了bPAG1[17],但PAG1 在体内的半衰期较长,在母畜产后80~100 d内仍能检测到,在此时间段内检测易出现假阳性结果[6, 18]。有研究结果表明,bPAG9早在牛妊娠后25 d 就已经表达[3],且在前3个月内转录水平显著高于bPAG1 [19]。因此,bPAG9可作为理想的标志物用于家畜早期妊娠诊断。但迄今为止,尚未见到关于bPAG9重组蛋白的研究报道。
本研究根据bPAG9基因信息及宿主细胞对密码子的偏好性,在不改变氨基酸序列的前提下对bPAG9基因密码子进行优化,通过PCR方法扩增bPAG9全基因序列,然后构建proEM-bPAG9重组质粒,在BL21(DE3) 大肠杆菌中诱导表达bPAG9重组蛋白,为奶牛早期妊娠诊断产品的研发提供基础。
1材料与方法
1.1材料与试剂
BL21(DE3) 感受态细胞、pET30a载体、ECL化学发光试剂盒购自德泰生物科技(南京)有限公司,Taq DNA聚合酶、T4 DNA连接酶购自宝生物工程(大连)有限公司,SDS-PAGR变性丙烯酰胺凝胶制备试剂盒、Ni-IDA 蛋白纯化试剂盒、小鼠抗6× His单克隆抗体、蛋白质Mark、DNA mark、Nde I内切酶、Hind III 内切酶、异丙基-β-D-硫代半乳糖苷(IPTG)、二硫苏糖醇(DTT)、苯甲基磺酰氟、谷胱甘肽、三羟甲基氨基甲烷、十二烷基硫酸钠、乙二胺四乙酸(EDTA)、咪唑(Imidazole )、尿素(Urea )等购自生工生物工程(上海)股份有限公司。质粒抽提试剂盒、DNA 琼脂糖凝胶回收试剂盒购自天根生化科技有限公司,BCA蛋白检測试剂盒购自上海碧云天生物技术有限公司,丙烯酰胺、四甲基乙二胺(TEMED)、过硫酸铵、硫酸卡那霉素等购自Sigma公司。
1.2仪器与设备
VeritiTM 96梯度PCR仪,美国ABI公司产品;Gel Doc XR+凝胶成像系统,美国BIO-RAD公司产品;Essential V4凝胶成像系统,英国UVITEC公司产品;Powerpac 300电泳仪,美国BIO-RAD公司产品;DYCZ-24EN双垂直电泳槽,北京六一仪器厂产品;DYCP-31BN琼脂糖水平电泳,北京六一仪器厂产品;Thermo311 CO2 培养箱,美国热电公司产品;Thermo ScientificTM Varioskan Flash全波长扫描式多功能读数仪,美国赛默飞公司产品;AKTA Explorer 100 蛋白纯化层析系统,美国GE公司产品;MicroPulser电转仪,美国Bio-Rad公司产品;BSC -150 型恒温恒湿培养箱,上海博讯事业有限公司产品;优普超纯水制造系统,成都超纯科技有限公司产品。
1.3方法
1.3.1bPAGP基因优化与合成根据 GenBank公布的bPAG9(登录号:AF020511.1)基因序列,利用密码子优化软件MaxCodonTM[德泰生物科技(南京)有限公司]对bPAG9基因进行优化,在保证氨基酸序列不变的情况下,利用宿主细胞对密码子的偏好性,将低频密码子替换为使用频率高的密码子,提高密码子适用指数(CAI),同时降低序列中碱基重复结构,调整序列的G+C含量在理想区间(30%~70%)。并在优化基因5′端和3′端设计Nde I、Hind III酶切位点和His标签序列。根据优化的bPAG9基因,应用 Primer premier软件设计18条引物。引物1:5′-GTTTAACTTTAAGAAGGAGATATACATATGATCGTGAAAATCCCGCTGCGCCAAGTCAAAACCATGCGTAAAACCCTGTCCGGCAAAA -3′(下划线为Nde I酶切位点);引物18:5′-CTCAGTGGTGGTGGTGGTGGTGCTCGAGTGCGGCCGCAAGCTTTCATTAATGATGATGATGATGATGAACCGCGCGTGCCAGACCAATA-3′(下划线为Hind III酶切位点)(其余引物未列出)。然后通过全基因合成法扩增得到目的产物。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后,用 DNA 凝胶回收试剂盒回收目的片段。bPAG9基因优化及合成由德泰生物科技(南京)有限公司完成。
1.3.2pET30a-bPAG9重组载体的构建将pET30a载体用Nde I和Hind III进行双酶切,pET30a载体酶切体系:pET30a载体5.0 μl、10×FD Buffer 5.0 μl、Nde I 2.5 μl (10 U/μl)、Hind III 2.5 μl (10 U/μl)、ddH2O 加至50.0 μl,37 ℃酶切1 h。酶切产物经琼脂糖凝胶电泳检测后,用胶回收试剂盒回收,将回收的酶切产物和目的DNA片段用连接酶在50 ℃连接25 min,连接体系:PAG9 DNA 4.0 μl、线性pET30a载体3.5 μl、T4 DNA连接酶 2.5 μl (5 U/μl)。
1.3.3pET30a-bPAG9重组载体的转化、筛选与鉴定将连接产物使用42 ℃热激法转化到BL21(DE3)感受态细胞中,37 ℃培养1 h,取20 μl菌液涂到含有硫酸卡那霉素的LB 固体培养基平板上,37 ℃过夜培养。挑取单个菌落接种到新的LB培养基中,37 ℃、200 r/min震荡培养4 h,取 2 μl菌液为模板进行PCR鉴定。上游引物:5′-TAATACGACTCACTATAGGG-3′;下游引物:5′-TGCTAGTTATTGCTCAGCGG-3′。反应体系:菌液1.0 μl,上游引物 0.5 μl,下游引物0.5 μl,聚合酶0.5 μl,dNTP 0.5 μl (10 mmol/L),ddH2O加至50.0 μl;反应程序:95 ℃预变性3 min;95 ℃变性25 s,62 ℃退火20 s, 72 ℃延伸40 s,25个循环;72 ℃延伸1 min,4 ℃保存。将PCR 产物进行琼脂糖凝胶电泳检测。
将初步判断为阳性的转化子接种到新鲜的LB培养基中,培养12 h后,收集菌液。采用质粒抽提试剂盒提取质粒,并对质粒进行双酶切鉴定,酶切体系和条件:重组质粒5.0 μl、10×FD Buffer 5.0 μl、Nde I 2.5 μl (10 U/μl)、Hind III 2.5 μl (10 U/μl),ddH2O加至50.0 μl,37 ℃酶切1 h,将酶切产物进行琼脂糖凝胶电泳检测。将PCR鉴定与双酶切鉴定得到的阳性克隆送德泰生物科技(南京)有限公司测序。经测序验证插入序列正确无误后,进行质粒大量抽提,-20 ℃保存备用。
1.3.4表达菌株的制备将重组质粒采用42 ℃热激法转化到大肠杆菌BL21(DE3)表达菌株中,加入200 μl LB液体培养基,37 ℃、195 r/min培养1 h,取80 μl菌悬液涂布于含有50 μg/ml硫酸卡那霉素的LB平板中,37 ℃培养过夜。次日挑取单菌落接种到含有50 μg/ml硫酸卡那霉素的LB培养基中,37 ℃振荡培养3 h,取0.9 ml的菌液与0.1 ml 80%无菌甘油混合,-80 ℃保存。
1.3.5重组蛋白的诱导表达取表达菌株菌液20 μl接种到含有50 μg/ml的硫酸卡那霉素的LB培养基中,37 ℃、200 r/min培养过夜。次日接种到含50 μg/ml的硫酸卡那霉素的LB培养基中扩大培养,当OD600为0.5~0.8时,取少量样品作为未诱导对照,其余菌液加入终浓度0.25 mmol/L IPTG,分别在15 ℃或37 ℃条件下诱导培养4 h。收集600 μl培养液,4 ℃、12 000 r/min离心10 min,弃上清液,加入50 μl PBS重悬沉淀,加热变性,SDS-PAGE电泳分析。
1.3.6重组蛋白的纯化收集扩大培养获得的菌体,加入细胞裂解液Buffer A[50 mmol/L Tris (pH8.0)、300 mmol/L NaCl、20 mmol/L 咪唑、1 mmol/L DTT、1%TritionX-100、1 μg/ml Leupeptin],超声波裂解破碎菌体,4 ℃、12 500 r/min离心15 min,分别收集上清液和沉淀,上清液过0.45 μm滤膜。沉淀用Buffer B[50 mmol/L Tris (pH8.0)、150 mmol/L NaCl、2 mmol/L DTT、1% Triton X-100、2 mmol/L EDTA]重悬,超声波裂解破碎,12 500 r/min、4 ℃离心15 min,保留沉淀,加入Buffer C[50 mmol/L Tris (pH8.0)、150 mmol/L NaCl、8 mol/L 尿素、20 mmol/L咪唑],超声波破碎,12 500 r/min、4 ℃离心15 min,上清液用0.45 μm滤膜过滤。采用Ni-IDA柱对以上两种上清液分别进行亲和层析,首先用Buffer A或Buffer C平衡Ni-IDA柱,直至吸光度A280接近基线,将制备好的上清液分别上柱,4 ℃孵育60 min,用15倍柱体积的Buffer A或Buffer C冲洗Ni-IDA柱,除去杂蛋白,直至吸光度A280接近基线,然后分别采用含50 mmol/L、100 mmol/L、500 mmol/L咪唑的Buffer A或Buffer C洗脱目的蛋白,流速1.5 ml/min。分别收集上清液、流穿液、洗脱液进行SDS-PAGE电泳,考马斯亮蓝染色检测纯化效果,收集含目的蛋白质的洗脱液。纯化后的目的蛋白质采用BCA试剂盒测定浓度。
1.3.7重组蛋白的Western blot鉴定纯化后的重组蛋白bPAG9经SDS-PAGE电泳后,取下凝胶,采用半干式电转印法将重组蛋白bPAG9转至PVDF膜上。PVDF 膜使用之前在甲醇中浸泡 30 s,之后将 PVDF 膜、凝胶、滤纸置于转膜液浸泡,浸泡后将三者按照正确顺序放在转印仪上,转印 45 min。取下 PVDF 膜于 5%脱脂奶粉中,室温封闭2 h后,1×PBST漂洗3~4次,每次5 min。加入1∶2 000 稀释的抗 His 标签小鼠单克隆抗体,室温孵育1 h,1×PBST漂洗。最后用ECL发光底物拍照。
2结果与分析
2.1bPAG9基因優化结果
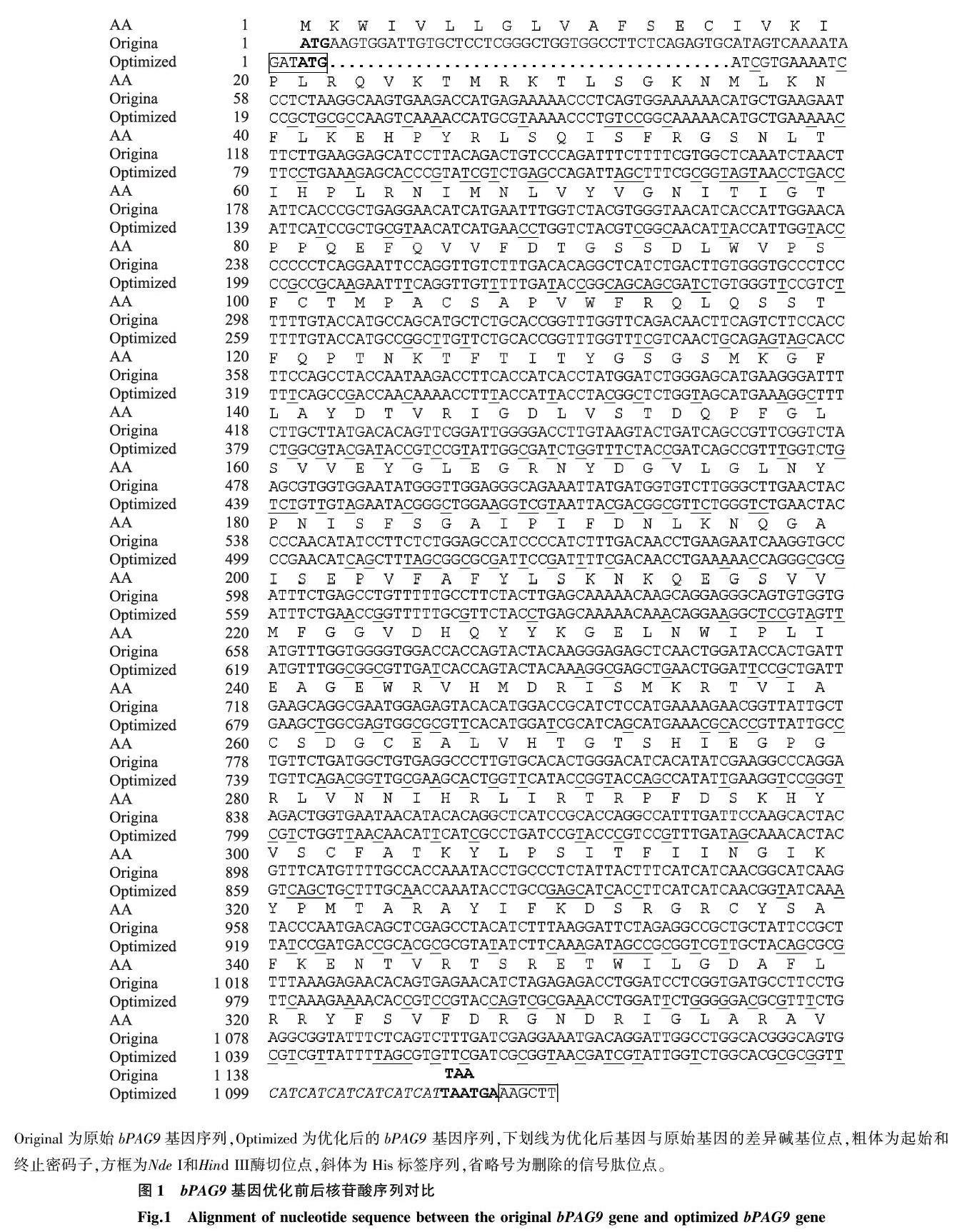
GenBank公布(登录号:AF020511.1)的bPAG9基因全长为1 311 bp,蛋白质编码区(Coding sequence, CDS)长度为1 140 bp。对该基因进行优化后,优化基因bPAG9的密码子适用指数(CAI)由0.73提高到0.89,G+C含量无明显变化,优化前后分别为48.82%和49.00%,优化前后两个基因的核苷酸同源性为63.4%,氨基酸序列完全一致。将优化的基因加入酶切位点、His标签等序列,切去信号肽编码序列,bPAG9优化基因序列全长1 128 bp,蛋白质编码区序列为1 113 bp(图1)。
2.2bPAG9优化基因 PCR扩增与鉴定
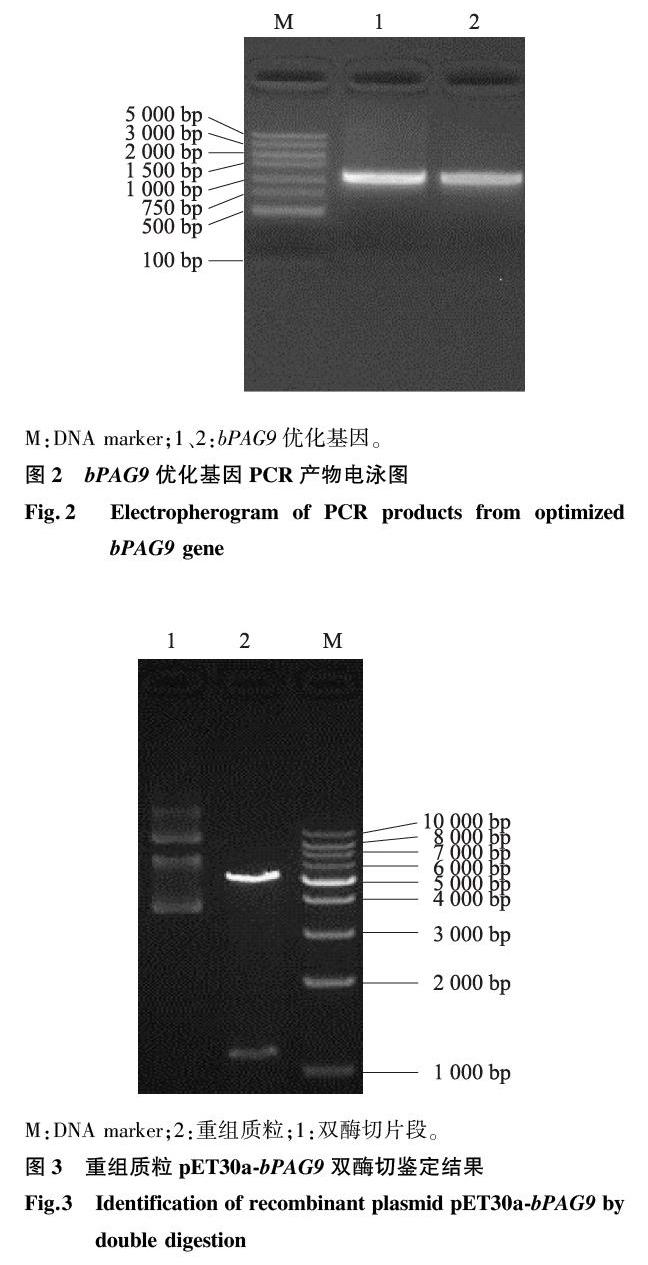
对bPAG9优化基因进行PCR扩增,1.0%琼脂糖凝胶电泳检测结果(图2)表明,PCR成功扩增出带有酶切位点的优化的目的基因bPAG9,片段大小约1 128 bp,与理论大小基本相符。
2.3重组质粒pET30a-bPAG9的构建及鉴定
将PCR扩增的优化的目的基因片段和线性化的pET30a载体进行连接,反应液转化大肠杆菌 BL21(DE3)感受态细胞,构建牛妊娠相关糖蛋白9的重组表达载体pET30a-bPAG9。将鉴定为阳性克隆的重组质粒进行双酶切,结果(图3)显示重组质粒电泳后呈现环状、线性和超螺旋3种基本形态,酶切后的pET30a线性载体和bPAG9基因片段大小与理论值(5 244 bp和1 125 bp)相符,且酶切条带单一,表明重组载体构建成功。将测序结果与优化后的bPAG9基因对比分析,碱基序列完全一致,符合率为100%,其编码的氨基酸序列与GenBank (protein ID:AAC04682.1) 公布的完全一致,表明bPAG9优化基因插入片段完全正确,未发生任何碱基突变。
2.4bPAG9重组蛋白的诱导表达
测序正确的重组质粒pET30a-bPAG9转入到BL21(DE3)大肠杆菌后,在相同的IPTG诱导浓度下,分别进行15 ℃和37 ℃诱导培养4 h,以未加入IPTG作为对照。SDS-PAGE检测结果(图4)显示,15 ℃和37 ℃诱导条件下,在相对分子质量4.0×104左右均有明显的蛋白质条带,未诱导的对照则无相应的目的条带。考虑低温诱导表达有利于蛋白质的正确折叠,因此选择诱导表达温度为15 ℃。以上结果说明,bPAG9基因在原核表达宿主BL21(DE3)中成功诱导表达。
2.5bPAG9重组蛋白的纯化
诱导表达后的菌株超声波破碎后,对上清液进行Ni-IDA柱亲和层析纯化,随后利用SDS-PAGE对纯化的蛋白质进行检测。结果(图5)显示,所有泳道均没有目的蛋白,表明表达菌株裂解后上清液中没有可溶性bPAG9重组蛋白。菌体破碎后收集的沉淀经2次超声波溶解后,再经过Ni-IDA纯化得到高浓度的融合蛋白,SDS-PAGE分析结果(图6)显示,菌体沉淀溶解后的上清液在相对分子质量约4.0×104处出现高浓度的目的条带,表明bPAG9重组蛋白分布在沉淀即包涵体中,所有洗脱组分中均含有目的蛋白,其中含500 mmol/L咪唑的洗脱溶液获得纯度较高的bPAG9重组蛋白。经DS-PAGE分析,纯化后的重组蛋白bPAG9纯度大于90%。BCA方法测定其浓度为0.34 mg/ml。
Original为原始bPAG9基因序列,Optimized为优化后的bPAG9 基因序列,下划线为优化后基因与原始基因的差异碱基位点,粗体为起始和终止密码子,方框为Nde I和Hind III酶切位点,斜体为His标签序列,省略号为删除的信号肽位点。
2.6重组蛋白bPAG9的Western blot鉴定
纯化的bPAG9重组蛋白C 端包含一个His 标签,根据这一特性,利用 His标签抗体对bPAG9重组蛋白进行Western blot检测。结果(图7)显示,在相对分子质量约 4.0×104处有特异杂交条带,与SDS-PAGE结果一致。bPAG9原始基因CDS长度为1 140 bp,包含9个外显子和8个内含子,编码379个氨基酸残基(Amino acid, AA),信号肽区域位于第1~15位氨基酸残基,蛋白质理论相对分子质量为 4.286×104,等电点8.82。优化的基因在去除信号肽和增加His标签序列后,CDS长度为1 113 bp,编码371个氨基酸,理论相对分子质量为 4.212×104。本研究原核表达的重组蛋白质相对分子质量约 4.0×104,与预期蛋白质大小基本一致,说明该重组蛋白质在原核表达系统中成功诱导表达。
3讨论
牛妊娠相关糖蛋白 (bPAG) 种类繁多,人们利用RT-PCR技术从牛胎盘组织中筛选出了至少22种 PAG的cDNA转录本,根据其出现的时间将其分为古代组与现代组,古代组PAG出现在8.000×107年前,经过进化在约5.000×107年前出现现代组PAG[4]。 大多数bPAG如bPAG1、bPAG3、bPAG4、bPAG5、bPAG6、bPAG7、bPAG9、bPAG14、bPAG15、bPAG16、bPAG17、bPAG18、bPAG19、bPAG20、bPAG21、bPAG22属于现代组,由胎盘滋养外胚层的双核细胞表达产生,由于催化中心碱基发生了突变而不具有酶活性;而bPAG2、bPAG8、bPAG10、bPAG11、bPAG12、bPAG13属于古代组,在整个滋养外胚层细胞中产生,保留了典型天冬氨酸肽酶的所有特征,具有酶活性[3,5,20]。由于bPAG家庭成员间的序列差异,bPAG基因在整个妊娠期的表达呈现时空特异性[3,5,19-21],如Green等运用核糖核酸酶保护实验检测胎盘中RNA的表达,发现bPAG2、bPAG4、bPAG5、bPAG8、bPAG9、bPAG10、bPAG11 早在妊娠后25 d就已经表达,而bPAG1、bPAG6、bPAG7在妊娠后 45 d开始表达,主要存在于妊娠中后期[3]。而且,bPAG9在妊娠后3個月内表达水平显著高于bPAG1 [19]。因此,bPAG9可作为一个更理想的标志物用于牛早期妊娠诊断。
由于bPAGs 蛋白种类繁多,增加了对其结构和功能研究的难度,体外重组蛋白质的出现为探究该类蛋白质的结构和功能提供了新思路。因此,前人对 bPAGs 在真核和原核系统中的表达进行了相关研究。Patel 等[17]构建真核表达载体PAG-pRcRSV,分别在HEK 293和CHO细胞中首次表达了PAG1重组蛋白,Western blot分析结果显示,HEK293细胞表达效果优于CHO细胞。Telugu 等[22]为验证古代组bPAG是否具有酶活性,利用昆虫细胞杆状病毒表达系统成功表达了bPAG2 和 bPAG12重组蛋白,并对这2种蛋白质的水解活性进行研究,结果显示2个重组蛋白质具有良好的蛋白质水解活性。但是真核表达系统操作复杂,且表达量低,成本较高。与真核表达系统相比,原核表达系统以其低成本、高表达等优点受到人们的青睐。国内对于PAG的研究极少,薄小辉[23]将bPAG4 基因插入到pET28a 原核表达载体后,转化大肠杆菌 BL21,采用 IPTG 诱导表达bPAG4 重组蛋白,但蛋白质表达效率没有报道。
本研究为提高bPAG9在BL21(DE3)的表达量,利用MaxCodonTM软件在不改变氨基酸序列的前提下,通过消除稀有密码子,利用偏好密码子以及平衡G+C含量等策略对bPAG9基因进行优化,优化的bPAG9基因G+C含量为49%,密码子适用指数(CAI)提高到0.89。然后通过全基因合成法合成了bPAG9优化基因,并将其成功插入到pET30a载体中,采用BL21(DE3) 感受态细胞经原核表达获得表达量和纯度均较高的bPAG9重组蛋白,为bPAG9抗体的制备和牛早期妊娠诊断产品的研发奠定了基础。
參考文献:
[1]ZOLI A P, BECKERS J F, WOUTERS-BALLMAN P, et al. Purification and characterization of a bovine pregnancy-associated glycoprotein[J]. Biology of Reproduction, 1991, 45(1): 1-10.
[2]BUTLER J E, HAMILTON W C, SASSER R G, et al. Detection and partial characterization of two bovine pregnancy-specific proteins[J]. Biology of Reproduction, 1982, 26: 925-933.
[3]GREEN J A, XIE S, QUAN X, et al. Pregnancy-associated bovine and ovine glycoproteins exhibit spatially and temporally distinct expression patterns during pregnancy[J]. Biology of Reproduction, 2000, 62: 1624-1631.
[4]HUGHES A L, GREEN J A, GARBAYO J M, et al. Adaptive diversification within a large family of recently duplicated, placentally expressed genes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97: 3319-3323.
[5]WOODING F B, ROBERTS R M, GREEN J A. Light and electron microscope immunocytochemical studies of the distribution of pregnancy associated glycoproteins (PAGs) throughout pregnancy in the cow: possible functional implications[J]. Placenta, 2005, 26: 807-827.
[6]ZOLI A P, GUILBAULT L A, DELAHAUT O W B, et al. Radioimmunoassay of a bovine pregnancy-associated glycoprotein in serum: its application for pregnancy diagnosis[J]. Biology of Reproduction, 1992, 46: 83-92.
[7]FRIEDRICH M, HOLTZ W. Establishment of an ELISA for measuring bovine pregnancy-associated glycoprotein in serum or milk and its application for early pregnancy detection[J]. Reproduction in Domestic Animals, 2010, 45: 142-146.
[8]DUFOUR S, DUROCHER J, DUBUC J, et al. Comparison of a commercial bovine pregnancy-associated glycoprotein ELISA test and a pregnancy-associated glycoprotein radiomimmunoassay test for early pregnancy diagnosis in dairy cattle[J]. Animal Reproduction Science, 2015, 159: 31-37.
[9]DUFOUR S, DUROCHER J, DUBUC J, et al. Bayesian estimation of sensitivity and specificity of a milk pregnancy-associated glycoprotein-based ELISA and of transrectal ultrasonographic exam for diagnosis of pregnancy at 28 to 45 days following breeding in dairy cows[J]. Preventive Veterinary Medicine, 2017, 140: 122-133.
[10]KAYA M S, KSE M, BOZKAYA F. Early pregnancy diagnosis using a commercial ELISA test based on pregnancy-associated glycoproteins in Holstein-Friesian heifers and lactating cows[J]. Turkish Journal of Veterinary & Animal Sciences, 2016, 40: 694-699.
[11]BELLA A, SOUSA NM, DEHIMI ML, et al. Western analyses of pregnancy-associated glycoprotein family (PAG) in placental extracts of various mammals[J]. Theriogenology, 2007, 68: 1055-1066.
[12]EI AMIRI B, REMY B, DE SOUSA N M, et al. Isolation and characterization of eight pregnancy-associated glycoproteins present at high levels in the ovine placenta between day 60 and day 100 of gestation[J]. Reproduction Nutrition Development, 2004, 44: 169-181.
[13]KLISCH K, DE SOUSA N M, BECKERS J F, et al. Pregnancy associated glycoprotein-1, -6, -7, and-17 are major products of bovine binucleate trophoblast giant cells at midpregnancy[J]. Molecular Reproduction and Development, 2005, 71(4): 453-460.
[14]BARBATO O, SOUSA N M, KLISCH K, et al. Isolation of new pregnancy-associated glycoproteins from water buffalo (Bubalus bubalis) placenta by Vicia villosa affinity chromatography[J]. Research in Veterinary Science, 2008, 85: 457-466.
[15]GREEN J A, PARKS T E, AVALLE M P, et al. The establishment of an ELISA for the detection of pregnancy-associated glycoproteins (PAGs) in the serum of pregnant cows and heifers[J]. Theriogenology, 2005, 63(5): 1481-1503.
[16]EGEN T E, EALY A D, LANDON L A, et al. Autoimmunization of ewes against pregnancy-associated glycoproteins does not interfere with the establishment and maintenance of pregnancy[J]. Animal An International Journal of Animal Bioscience, 2009, 3(6): 850-857.
[17]PATEL O V, TAKAHASHI T, IMAI K, et al. Generation and purification of recombinant bovine pregnancy associated glycoprotein[J]. The Veterinary Journal, 2004, 168: 328-335.
[18]MIALON M M, CAMOUS S, RENAND G, et al. Peripheral concentrations of a 60-kDa pregnancy serum protein during gestation and after calving and in relationship to embryonic mortality in cattle[J]. Reprod Nutr Dev, 1993,33:269-282.
[19]PAREL O A, YAMADA O, KIZAKI K, et al. Quantitative analysis throughout pregnancy of placentomal and interplacentomal expression of pregnancy-associated glycoproteins-1 and -9 in the cow [J]. Mol Reprod Dev, 2004, 67:257-263.
[20]TELUGU B P V, WALKER A M, GREEN J A. Characterization of the bovine pregnancy-associated glycoprotein gene family- analysis of gene sequences, regulatory regions within the promoter and expression of selected genes[J]. BMC Genomics, 2009, 10:185-201.
[21]XIE S, GREEN J, BIXBY J B, et al. The diversity and evolutionary relationships of the pregnancy-associated glycoproteins, an aspartic proteinase subfamily consisting of many trophoblast-expressed genes[J]. Proc Natl Acad Sci USA, 1997, 94: 12809-12816.
[22]TELUGU B P, PALMIER M O, VAN DOREN S R, et al. An examination of the proteolytic activity for bovine pregnancy-associated lycoproteins 2 and 12[J]. Biol Chem, 2010, 391(2/3): 259-270.
[23]薄小輝. 妊娠相关糖蛋白在奶牛早期妊娠诊断上的应用研究[D]. 北京:中国农业科学院, 2017.
(责任编辑:张震林)
