植物耐热机理研究进展
2020-03-27徐海宋波顾宗福毕研飞魏斌
徐海 宋波 顾宗福 毕研飞 魏斌

摘要:气候因素导致的热胁迫严重影响农作物的产量和质量,引起了广泛关注。植物通过积累不同的代谢产物,并激活一系列信号途径来应对热胁迫,这些变化凸显了植物热胁迫响应生理和分子机制的复杂性。本文详细综述了生物膜、活性氧解毒机制、热激蛋白和各类保护剂在植物耐热性形成中的作用,并对未来如何深入研究植物热胁迫响应及耐热性机制机理提出展望,以期为植物耐热性育种提供指导。
关键词:植物;耐热性;活性氧;热激蛋白
中图分类号:S184;Q945文献标识码:A文章编号:1000-4440(2020)01-0243-08
Abstract:Heat stress caused by climate factors seriously affects crop yield and quality, which has attracted wide attention. In response to heat stress, different metabolites were accumulated in plants and a series of signaling pathways were activated. These changes highlighted the complexity of physiological and molecular mechanisms of plant response to heat stress. In this paper, the role of biomembrane, active oxygen detoxification mechanism, heat shock protein and various protectants in the formation of plant heat tolerance was reviewed in detail, and the further study for the response of plant heat stress and the mechanism of heat tolerance was prospected in order to provide guidance for plant heat tolerance breeding.
Key words:plant;heat tolerance;reactive oxygen species;heat shock proteins
受人為因素和自然因素的共同影响,预计到21世纪末,地表气温将提高 2~4 ℃[1]。高温引起的热胁迫影响植物生长发育的各个生理过程,导致植株形态和生理变化,阻碍植物的发育过程,最终导致巨大的产量损失。在高温条件下,植物细胞膜脂双层结构的流动性明显增强,可引起电解质泄漏、活性氧生成和氧化损伤。植物则通过不同途径积累抗氧化剂、渗透保护剂和热激蛋白(Hsps)等代谢产物应对热胁迫损伤[2],叶绿体和线粒体中的保护酶及抗氧化剂对减少氧化损伤也非常重要[3]。热激蛋白在胁迫信号转导,保护并修复受损蛋白质,以及在调节细胞氧化还原状态中均发挥作用。其他一些主要的胁迫响应因子,包括离子转运体、渗透保护剂、自由基清除剂、各种胁迫响应蛋白质以及参与信号级联和转录控制的因子等,对抵消热胁迫的影响也至关重要[4]。
植物的耐热机制与光合系统的耐受性有关[5]。热胁迫引起光系统II(PSII)失效,降低了电子传输效率,增加了活性氧的产生。在热胁迫下,植物的叶绿体和线粒体都会积累更多的活性氧(ROS),从而严重破坏DNA,引起细胞膜脂质过氧化。有研究结果表明,活性氧解毒机制在保护植物免受高温胁迫方面发挥着重要作用[6-7]。因此,植物的耐热性与其自身对活性氧的清除和解毒能力密切相关。耐热性的诱导可归因于通过提高抗氧化能力来维持更好的膜热稳定性和较低的活性氧积累量[8-10]。但是,现阶段关于不同细胞器中活性氧如何生成和消耗的了解有限。植物耐热性的遗传差异与不同胁迫响应基因表达、Hsps合成以及抗氧化防御系统等因素有关[11-12]。本文拟通过总结生物膜、活性氧解毒机制、热激蛋白和各类保护剂在植物耐热性形成中的作用,以期为植物耐热性育种的深入研究奠定基础。
1生物膜在植物耐热性中的作用
脂质过氧化(LPO)对生物具有非常大的破坏性。热胁迫会导致植物细胞膜自由基损伤,从而导致LPO增强。人们已经认识到,LPO产物是由多元不饱和前体形成的,这些前体包括小的碳氢化合物碎片,如酮、丙二醛(MDA)以及与之相关的化合物[13]。MDA含量被广泛用作LPO的指标[14]。细胞膜和细胞器膜中的LPO都是在活性氧水平高于阈值时发生,从而影响正常的细胞功能[15]。产生的烷氧基和过氧基能够通过与其他脂质分子相互作用来诱导新的自由基链。由此产生的脂质过氧化氢很容易分解成多种活性物质,包括脂质烷氧基、醛类、烷烃、脂质环氧化物和醇类。因此,单个引发事件有可能通过链式反应生成多个过氧化物分子。LPO的总体作用是降低膜的流动性,这使得在双层膜结构的两部分之间交换磷脂更容易,并增加了膜对正常情况下不穿过它的物质的泄漏,从而损害膜蛋白、受体、酶和离子通道。
热胁迫会改变膜蛋白的三级和四级结构,所以生物膜的完整性和功能对高温非常敏感。细胞膜是由蛋白质和脂质组成的移动镶嵌结构,内、外两层由蛋白质分子组成,中间一层由双层脂类分子组成[5]。许多热胁迫响应都是通过蛋白质折叠的展开变性来实现的。蛋白质构象随温度变化,温度的降低和升高都会导致蛋白质变性[16]。膜脂中一些不饱和脂肪酸的不饱和键对温度比较敏感,容易断裂,膜脂中饱和脂肪酸含量越高,植物的耐热性越强。有研究结果表明,缺乏不饱和脂肪酸的大豆突变体对高温表现出很强的耐受性[16]。在高温处理下,2个缺乏不饱和脂肪酸的拟南芥突变体(fad5和fad6)类囊体膜的稳定性更强[17]。通过抑制ω-3脱氢酶基因,增加脂类饱和度,也能使烟草表现出更强的耐热性[18]。
膜热稳定性(MTS)是耐热性的一个重要指标,它是通过测量电导率来确定的。在植物生长后期,膜稳定性参数通常会降低。基因型间的MTS遗传变异可用于小麦耐热性育种。如果灌浆时遇到高温,MTS高的小麦品种产量往往高于MTS低的品种[19]。植物细胞暴露于高温下会引起细胞膜破裂,这与膜脂双层结构的温度特异性相变(凝胶到液体或反之)有关。热胁迫可导致线粒体膜功能受损并产生氧化损伤[6-7,20]。植物细胞的光合系统不耐热,在植株出现明显的热害症状之前就会受到破坏,热胁迫通过改变吸收光能的数量和利用率来影响类囊体膜反应,进而改变叶绿素荧光模式。
2活性氧解毒机制在植物耐热性中的作用
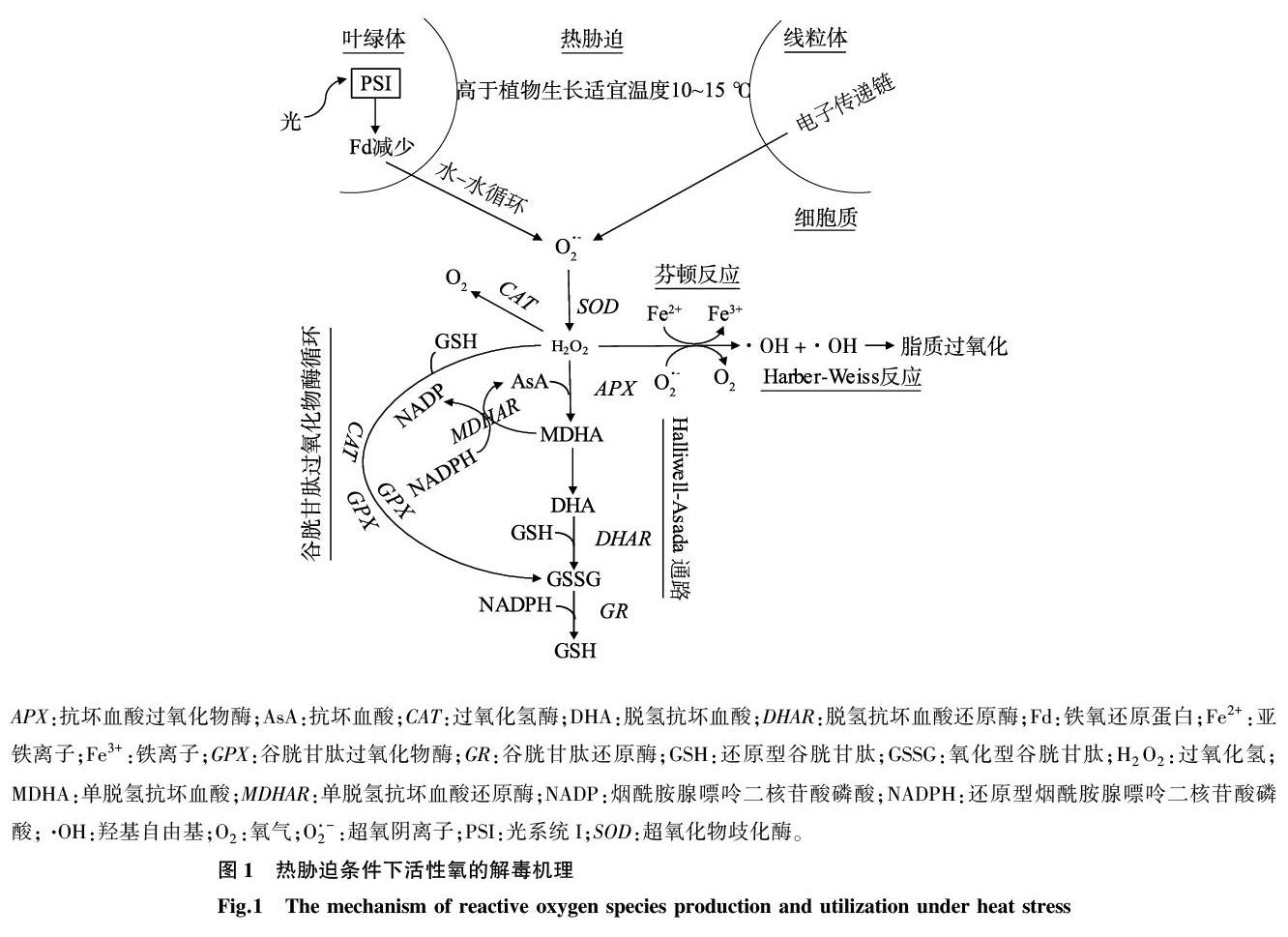
活性氧包括超氧阴离子(O2·-)、羟基(·OH)和过氧化氢(H2O2)等,是细胞代谢的天然产物(图1)。光合过程中能量耗散不足可导致叶绿素形成三重态。三重态的叶绿素可以与三重态的氧发生反应,释放出一种非常活泼的单态氧,对光系統I(PSI)、PSII以及整个光合机制都有破坏作用。热胁迫可促进活性氧的快速生成和积累[21-23]。活性氧的过度生产可能对所有细胞组分都有害,并对细胞代谢产生负面影响[24-25]。因此,这些活性氧的解毒机制对于植物的耐热性至关重要。
植物应对活性氧的防御系统包括酶抗氧化剂和非酶抗氧化剂(图1)[26]。主要的酶抗氧化剂是过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽还原酶(GR)和谷胱甘肽S-转移酶(GST)[27]。SOD将O2·-转化为H2O2,而CAT则将H2O2解离为H2O和O2。GPX需要一种酚类化合物邻甲氧基苯酚作为电子供体来分解H2O2,而APX则使用一种还原形式的抗坏血酸(AsA)来保护细胞免受H2O2的破坏[28]。APX反应产生的氧化形式AsA通过抗坏血酸-谷胱甘肽循环或单脱氢抗坏血酸还原酶(MDHAR)和DHAR的Halliwell-Asada通路再生,最终利用还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的还原能力,通过GR将氧化型谷胱甘肽(GSSG)转变为还原型谷胱甘肽(GSH)(图1)。
GST是一种多功能蛋白质的集合,基本上存在于所有生物体中。除了参与天然次生化合物的代谢[29]和有害外源物质的解毒[30],植物GST还可以将H2O2催化还原为危害较小的乙醇[30]。通过将转基因烟草的GST/GPX活性加倍,幼苗和成株的生长速度明显快于野生型,从而提供了更好的抗氧化保护作用[31]。
抗氧化酶的活性对温度敏感,在不同的温度范围内发生活化。在兵豆中观察到,随着温度的升高,CAT、APX和SOD活性逐渐增加,超过50 ℃后活性开始降低,而过氧化物酶(POX)和GR在20~50 ℃条件下随温度升高活性都会降低[8]。鹰嘴豆耐热品种的最高抗氧化活性温度为35~40 ℃,热敏品种为30 ℃[32]。抗氧化酶的活性也因不同作物、不同品种的耐热性、生长阶段和生长季节的差异而有所不同[23]。Goyal等[33]研究发现,GST、APX和CAT活性强的小麦品种表现出更强的耐热性,由此推测小麦品种的耐热性与其细胞抗氧化能力有关。
AsA、GSH和α-生育酚是在活性氧解毒中起关键作用的主要非酶抗氧化剂[10]。AsA几乎分布在植物的所有部位,在线粒体中合成,然后运输到植物的其他部位。APX以AsA为底物,在抗坏血酸-谷胱甘肽循环中将H2O2还原为H2O,生成单脱氢抗坏血酸(MDHA),MDHA进一步与AsA和脱氢抗坏血酸(DHA)解离(图1)。
α-生育酚主要存在于叶绿体中,尤其是在类囊体膜和质体小球中,可以使光合作用衍生的活性氧(主要是单线态氧和羟基)失活,并与其他抗氧化剂一起清除脂质过氧自由基。它作为亲脂性抗氧化剂,与多元不饱和脂酰基相互作用,从而稳定膜脂结构[28],还可作为调节信号转导的物质。α-生育酚的数量随着环境限制、胁迫强度和物种敏感性的变化而变化。α-生育酚的变化源于与其生物合成途径相关的基因表达的改变[34]。Kanwischer等[35]发现,在缺少α-生育酚的情况下,存在一个为细胞光合系统提供充分保护的补偿机制,这也进一步证明α-生育酚不是一种单一的抗氧化剂[36]。
GSH是一种非蛋白硫醇,在H2O2解毒中起着关键作用。据报道,在H2O2解毒过程中,GSH转变为其氧化形式GSSG的转化率是细胞氧化还原平衡的指标[33]。GSH和AsA被认为是植物氧化还原信号的重要组成部分[37]。
3热激蛋白在植物耐热性中的作用
热胁迫能够触发防御基因的表达,而这些基因在正常条件下是不表达的[38]。所有的逆境胁迫都会诱导细胞中相关胁迫响应基因的表达和蛋白质的合成[38-39]。然而,在胁迫发生后到细胞开始恢复之前,胁迫响应因子会立即阻断重要的代谢过程,包括DNA复制、转录、mRNA输出和翻译[40]。
热激蛋白根据分子量分为5个家族:Hsp100、Hsp90、Hsp70、Hsp60和小分子量Hsps(sHsps)。Hsps能够在一定程度上解决蛋白质错误折叠和聚集等问题,同时也起到伴侣蛋白的作用。Hsps的多样性和丰富性反映了植物对热胁迫的适应性。一般来说,植物的sHsps多样性最高。这些sHsps基因的表达受限于植物的某些发育阶段,如种子萌发、胚胎发生、胚胎发育或果实成熟等[41]。
Hsps基因的转录主要由胞质内处于非活性状态的调节蛋白质——热激转录因子(Hsfs)控制。每个Hsfs具有1个羧基末端(C末端)和3个氨基末端(N末端),并含有亮氨酸[42]。每个Hsfs都有调节作用,并且在触发、维持和恢复等热胁迫响应的所有阶段都相互合作。因此,这些因子被认为是热胁迫响应的转录激活因子[43-44]。在番茄中,HsfA1a是主要的转录调节因子,负责诱导基因表达,包括合成HsfA2(图2)[45]。这些调节因子根据其聚集成三联体的结构差异被分为3类:HsfA、HsfB和HsfC,所有这些Hsfs对植物耐热性的获得都很重要[44]。对拟南芥的研究发现,HsfAs是热诱导热激基因活化的主要因素[46]。HsfBs虽然具有正常的DNA结合功能,但缺乏热诱导的转录激活功能,与HsfAs共同转录激活。尽管对Hsfs进行了广泛的研究,但尚未发现Hsfs在热信号转导中的直接上游因子。无论是对Hsfs本身还是其他新的转录因子都有待进一步研究。
任何蛋白质的功能都是由其构型和折叠成的三维结构决定的[47]。Hsps的一般作用是作为分子伴侣,调控蛋白质的折叠、积累、定位和降解[39,44,48-50]。Timperio等[51]明确指出,在热胁迫条件下,Hsps作为分子伴侣可以维持正确的蛋白质结构,以保护蛋白质免受损害。这些蛋白质作为伴侣蛋白,在热胁迫过程中阻止其他蛋白质的不可逆聚集,并参与蛋白质的再折叠[47,52]。来源于拟南芥的Hsp101,在水稻植株中过表达可显著改善热胁迫恢复过程中的生长性能[53]。有研究结果表明,发育中的小麦籽粒含有Hsp100,热胁迫下耐热品种的Hsp100含量更高[54]。Hsp70在热胁迫下的积累量与开放的PSⅡ反应中心捕获激发能的效率呈线性正相关,并通过提高电子传递链的速率增加对高温的耐受性[55]。
sHsps是一组15 000~30 000的同源蛋白質[5,56]。在胁迫条件下,sHsps占细胞中蛋白质的1%。植物sHsps分为6类,3类定位于细胞质或细胞核,另外3类定位于质粒、内质网和线粒体[57]。Hsps在耐热性中的意义主要表现在其与细胞代谢活性的相关性上[58-59]。已有的研究结果表明,位于线粒体和叶绿体中的sHsps可以保护线粒体中的呼吸电子传递和叶绿体中的PSII电子传递[60]。在藜的研究结果中发现,大小为22 000的叶绿体sHsp定位于类囊体腔内,与PSII中不耐热的放氧复合体特异性互作,保护其免受热胁迫损伤[41,61]。sHsps在体外和体内均可作为分子伴侣。一个大小为18 000的sHsp被证明可以阻止蛋白质聚集,并通过其他伴侣保持其活跃的再折叠形式[41]。谷物中的淀粉合成是在淀粉体中进行的,根据已报道的sHsps在质粒中的定位,Hsp18在为小麦籽粒生长提供耐热性方面的作用可能是通过保护可溶性淀粉合成酶来实现的,这种酶对高温极为敏感[62]。
4各类保护剂在植物耐热性中的作用
近几十年来,渗透保护剂、植物激素、信号分子、微量元素等的外源应用对高温胁迫下植物生长产生有益的影响,这些保护剂通常具有促进生长和抗氧化能力[63]。脯氨酸、甘氨酸、甜菜碱和海藻糖等渗透物质的积累是植物抵抗包括热在内的非生物胁迫的一种众所周知的适应性机制。由于热敏性植物明显缺乏积累这些物质的能力,外源应用渗透保护剂可以提高其耐热性[64-65]。应用脯氨酸或甘氨酸甜菜碱可显著减少H2O2的产生,改善可溶性糖的积累,并保护发育中的组织免受热应激的影响,而脯氨酸通常比甜菜碱更有效。外源性脯氨酸和甘氨酸甜菜碱还能提高K+和Ca2+含量,增加内源性脯氨酸或甘氨酸甜菜碱和可溶性糖的含量,提高植物对热胁迫的耐受性[65]。细胞质中的Ca2+与植物对温度胁迫的耐受性有关,温和的热胁迫处理可使热胁迫后细胞内Ca2+浓度升高,促进拟南芥耐热性的获得[6],10 mmol/L CaCl2处理能提高滨梅幼苗对高温的耐受性[66]。
植物激素在减轻植物热胁迫方面也是有效的。经脱落酸预处理,玉米、拟南芥的耐热性都有所提高[67-68]。在致死热处理前,经水杨酸、氨基环烷羧酸(植物激素乙烯的前体)和脱落酸预处理的拟南芥幼苗存活率分别比对照提高了约5倍、3倍和2倍,并且减少了热胁迫诱导的氧化损伤[68]。
另外,一些主要的胁迫响应机制包括离子转运体、胚胎晚期丰富蛋白、抗氧化防御以及信号转导级联和转录控制相关的因子,有助于保护和修复受损的蛋白质和生物膜,重新建立稳态,在抵消胁迫效应方面具有重要意义[4,69-70]。
5展望
植物在热胁迫下的耐热性反应是通过一系列信号途径完成的,复杂而有序,这些信号机制中包括离子运输者、渗透保护剂、自由基清除剂、信号级联反应和转录控制中的一系列蛋白质和元素,这些物质的协同运作对抵制胁迫效应都是必需的。在植物耐热信号传导过程中,转录因子是一个关键因素,在胁迫反应中它们不断合成并将信号传递和放大,调控下游基因的表达,从而引起植物的一系列抗逆反应。在植物中有20多种Hsfs,番茄HsfA1a和拟南芥HsfA2是诱导产生耐热性的主要转录因子[71]。转录因子MBF1c在拟南芥耐热过程中是必需的,它可以通过控制热激反应中36种不同转录本的表达来介导植物对高温的耐性。细胞质抗坏血酸过氧化物酶1(APX1)和锌指蛋白(Zats)在植物耐热反应ROS信号传导中发挥着必不可少的作用[72-73]。DREB2A/DREB2C通过激活HsfA3来正调控植物的耐热性[74-75]。此外,MYB类、bZIP类、NAC类和AP2/EREBP类转录因子在植物防卫反应和逆境胁迫应答过程中具有重要功能[76]。在后续的研究中,还可能发现更多的信号机制参与植物的耐热性反应,有助于对植物耐热机理的进一步理解。
热胁迫对植物生长发育的影响很大,是世界范围内影响作物生产的一个主要问题。对于各类重要作物,需要更好地了解其热胁迫响应及耐热性机制机理。植物对热胁迫的响应在不同物种、不同发育阶段之间也有所不同。在热胁迫条件下,植物积累不同的代谢产物(如抗氧化剂、渗透保护剂、热激蛋白等),并激活不同的代谢途径和过程,这些复杂的变化体现了研究热胁迫响应的生理和分子机制对于了解植物耐热机理的重要性。全面了解热激信号和热胁迫响应表达相关基因,对培育耐热植物具有重要意义。
总体看来,植物耐热性的具体机理仍不完全清楚,需要继续进行相关研究,并且应该在不干扰植物其他重要代谢过程的前提下,通过改变传感、信号或调控等途径提高其耐热性。今后,植物代谢工程可能是开展作物耐热性研究的另一种途径。
参考文献:
[1]EITZINGER J, ORLANDINI S, STEFANSKI R, et al. Climate change and agriculture: introductory editorial[J]. The Journal of Agricultural Science, 2010, 148(5): 499-500.
[2]BOKSZCZANIN K L, FRAGKOSTEFANAKIS S, BOSTAN H, et al. Perspectives on deciphering mechanisms underlying plant heat stress response and thermotolerance[J]. Frontiers in Plant Science, 2013, 4: 315.
[3]BOHNERT H J, GONG Q Q, LI P H, et al. Unraveling abiotic stress tolerance mechanisms-getting genomics going [J]. Current Opinion in Plant Biology, 2006, 9(2): 180-188.
[4]WANG W, VINOCUR B, SHOSEYOV O, et al. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response [J]. Trends in Plant Science, 2004, 9(5): 244-252.
[5]HEMANTARANJAN A, NISHANT BHANU A, SINGH M N, et al. Heat stress responses and thermotolerance [J]. Advances in Plants & Agriculture Research, 2014, 1(3): 1-10.
[6]LARKINDALE J, KNIGHT M R. Protection against heat stress-induced oxidative damage in Arabidopsis involves calcium, abscisic acid, ethylene and salicylic acid [J]. Plant Physiology, 2002, 128(2): 682-695.
[7]SUZUKI N, MITTLER R. Reactive oxygen species and temperature stresses: a delicate balance between signaling and destruction [J]. Plant Physiology, 2006, 126(1): 45-51.
[8]CHAKRABORTY U, PRADHAN D. High temperature-induced oxidative stress in Lens culinaris, role of antioxidants and amelioration of stress by chemical pre-treatments [J]. Journal of Plant Interaction, 2011, 6(1): 43-52.
[9]XU S, LI J, ZHANG X, et al. Effects of heat acclimation pretreatment on changes of membrane lipid peroxidation, antioxidant metabolites, and ultrastructure of chloroplasts in two cool-season turfgrass species under heat stress[J]. Environmental and Experimental Botany, 2006, 56(3): 274-285.
[10]HAMEED A, GOHER M, IQBAL N. Heat stress-induced cell death, changes in antioxidants, lipid peroxidation, and protease activity in wheat leaves[J]. Journal of Plant Growth Regulation, 2012, 31(3): 283-291.
[11]SENTHIL-KUMAR M, KUMAR G, SRIKANTHBABU V, et al. Assessment of variability in acquired thermotolerance: potential option to study genotypic response and the relevance of stress genes[J]. Journal of Plant Physiology, 2007, 164(2): 111-125.
[12] MAESTRI E, KLUEVA N, PERROTTA C, et al. Molecular genetics of heat tolerance and heat shock proteins in cereals[J]. Plant Molecular Biology, 2002, 48(5/6): 667-681.
[13]GARG N, MANCHANDA G. ROS generation in plants: boon or bane? [J]. Plant Biosystem, 2009, 143(1): 81-96.
[14]WAGNER D, PRZYBYLA D, OP DEN CAMP R, et al. The genetic basis of singlet oxygen-induced stress responses of Arabidopsis thaliana[J]. Science, 2004, 306(5699): 1183-1185.
[15]MONTILLET J L, CHAMNONGPOL S, RUSTERUCCI C, et al. Fatty acid hydroperoxides and H2O2 in the execution of hypersensitive cell death in tobacco leaves [J]. Plant Physiology, 2005, 138(3): 1516-1526.
[16]PASTORE A, MARTIN S R, POLITOU A, et al. Unbiased cold denaturation: low- and high-temperature unfolding of yeast frataxin under physiological conditions [J]. Journal of the American Chemical Society, 2007, 129(17): 5374-5375.
[17]YAMADA K, FUKAO Y, HAYASHI M, et al. Cytosolic HSP90 regulated the heat shock response that is responsible for heat acclimation in Arabidopsis thaliana [J]. Journal of Biological Chemistry, 2007, 282(52): 37794-37804.
[18]VON KOSKULL-DORING P, SCHARF K D, NOVER L. The diversity of plant heat stress transcription factors [J]. Trends in Plant Science, 2007, 12(10): 452-457.
[19]GUPTA N K, AGARWAL S, AGARWAL V P, et al. Effect of short-term heat stress on growth, physiology and antioxidative defence system in wheat seedlings[J]. Acta Physiologiae Plantarum, 2013, 35(6): 1837-1842.
[20] SAIRAM R K, DESHMUKH P S, SAXENA D C. Role of antioxidant systems in wheat genotypes tolerance to water stress[J]. Biologia Plantarum, 1998, 41(3): 387-394.
[21] SAIRAM R K, SRIVASTAVA G C, SAXENA D C. Increased antioxidant activity under elevated temperatures: a mechanism of heat stress tolerance in wheat genotypes[J]. Biologia Plantarum, 2000, 43(2): 245-251.
[22] MITTLER R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410.
[23] ALMESELMANI M, DESHMUKH P S, SAIRAM R K, et al. Protective role of antioxidant enzymes under high temperature stress[J]. Plant Science, 2006, 171(3): 382-388.
[24] VAN BREUSEGEM F, VRANOV E, DAT J F, et al. The role of active oxygen species in plant signal transduction[J]. Plant Science, 2001, 161(3): 405-414.
[25]ESFANDIARI E, SHEKARI F, ESFANDIAR M. The effect of salt stress on antioxidant enzymes activity and lipid peroxidation on the wheat seedlings [J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2007, 35(1): 48-56.
[26]WAHID A, GELANI S, ASHRAF M, et al. Heat tolerance in plants: an overview[J]. Environmental and Experimental Botany, 2007, 61(3): 199-223.
[27] NOCTOR G, FOYER C H. Ascorbate and glutathione: keeping active oxygen under control[J]. Annual Review of Plant Biology, 1998, 49(1): 249-279.
[28] TRIPATHY B C, OELMLLER R. Reactive oxygen species generation and signaling in plants[J]. Plant Signaling & Behavior, 2012, 7(12): 1621-1633.
[29]DIXON D P, COLE D J, EDWARD R. Cloning and characterization of plant theta and zeta class GSTs: implication for plant GST classification [J]. Chemico-biological Interactions, 2001, 133: 33-36.
[30]DIXON D P, CUMMINIS I, COLE D J, et al. Glutathione mediated detoxification system in plants [J]. Current Opinion in Plant Biology, 1998, 1(3): 258-266.
[31] ROXAS V P, LODHI S A, GARRETT D K, et al. Stress tolerance in transgenic tobacco seedlings that overexpress glutathione S-transferase/glutathione peroxidase[J]. Plant and Cell Physiology, 2000, 41(11): 1229-1234.
[32]KAUSHAL N, GUPTA K, BHANDHARI K, et al. Proline induces heat tolerance in chickpea (Cicer arietinum L.) plants by protecting vital enzymes of carbon and antioxidative metabolism [J]. Physiology and Molecular Biology of Plants, 2011, 17(3): 203-213.
[33]GOYAL M, ASTHIR B. Polyamine catabolism influences antioxidative defense mechanism in shoots and roots of five wheat genotypes under high temperature stress[J]. Plant Growth Regulation, 2010, 60(1): 13-25.
[34]SANDORF I, HOLLANDER-CZYTKO H. Jasmonate is involved in the induction of tyrosine aminotransferase and tocopherol biosynthesis in Arabidopsis thaliana [J]. Planta, 2002, 216(1): 173-179.
[35]KANWISCHER M, PORFIROVA S, BERGMULLER E, et al. Alterations in tocopherol cyclase activity in transgenic and mutant plants of Arabidopsis affect tocopherol content, tocopherol composition, and oxidative stress [J]. Plant Physiology, 2005, 137(2): 713-723.
[36]MUNN-BOSCH S. The role of α-tocopherol in plant stress tolerance[J]. Journal of Plant Physiology, 2005, 162(7): 743-748.
[37]SUZUKI N, KOUSSEVITZKY S, MITTLER R, et al. ROS and redox signalling in the response of plants to abiotic stress [J]. Plant, Cell and Environment, 2012, 35(2): 259-270.
[38]MORIMOTO R I. Cells in stress: transcriptional activation of heat shock genes [J]. Science, 1993, 259(5100): 1409-1410.
[39]GUPTA S C, SHARMA A, MISHRA M, et al. Heat shock proteins in toxicology: how close and how far?[J]. Life Sciences, 2010, 86(11/12): 377-384.
[40]BIAMONTI G, CACERES J F. Cellular stress and RNA splicing [J]. Trends in Biochemical Sciences, 2009, 34(3):146-153.
[41] SUN W, VAN MONTAGU M, VERBRUGGEN N. Small heat shock proteins and stress tolerance in plants[J]. Biochimica et Biophysica Acta, 2002, 1577(1): 1-9.
[42]SCHUETZ T J, GALLO G J, SHELDON L, et al. Isolation of a cDNA for HSF2: evidence for two heat shock factor genes in humans [J]. Proceedings of the National Academy of Sciences of the United States of America, 1991, 88: 6911-6915.
[43]BANIWAL S K, BHARTI K, CHAN K Y, et al. Heat stress response in plants: a complex game with chaperones and more than twenty heat stress transcription factors [J]. Journal of Biosciences, 2004,29(4): 471-487.
[44]HU W, HU G, HAN B. Genome-wide survey and expression profiling of heat shock proteins and heat shock factors revealed overlapped and stress specific response under abiotic stresses in rice[J]. Plant Science, 2009, 176(4): 583-590.
[45]QU A L, DING Y F, JIANG Q, et al. Molecular mechanisms of the plant heat stress response[J]. Biochemical and Biophysical Research Communications, 2013, 432(2): 203-207.
[46] CZARNECKA-VERNER E, YUAN C X, SCHARF K D, et al. Plants contain a novel multi-member class of heat shock factors without transcriptional activator potential[J]. Plant Molecular Biology, 2000, 43(4): 459-471.
[47]LEVITT M, GERSTEIN M, HUANG E, et al. Protein folding: the endgame[J]. Annual Review of Biochemistry, 1997, 66(1): 549-579.
[48]FEDER M E, HOFMANN G E. Heat-shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology[J]. Annual Review of Physiology, 1999, 61(1): 243-282.
[49] SCHULZE-LEFERT P. Plant immunity: the origami of receptor activation[J]. Current Biology, 2004, 14(1): 22-24.
[50]PANARETOU B, ZHAI C. The heat shock proteins: their roles as multi-component machines for protein folding[J]. Fungal Biology Reviews, 2008, 22(3/4): 110-119.
[51]TIMPERIO A M, EGID M G, ZOLLA L. Proteomics applied on plant abiotic stresses: role of heat shock proteins (HSP) [J]. Journal of Proteomics, 2008, 71: 391-411.
[52]TRIPP J, MISHRA S K, SCHARF K D. Functional dissection of the cytosolic chaperone network in tomato mesophyll protoplasts[J]. Plant, Cell & Environment, 2009, 32(2): 123-133.
[53]LIU H C, LIAO H Y, CHARNG Y Y. The role of class A1 heat shock factors (HSFA1s) in response to heat and other stresses in Arabidopsis [J]. Plant, Cell & Environment, 2011, 34(5): 738-751.
[54]SUMESH K V, SHARMA-NATU P, GHILDIYAL M C. Starch synthase activity and heat shock protein in relation to thermal tolerance of developing wheat grains [J]. Biologia Plantarum, 2008, 52(4): 749-753.
[55]SULEMAN P, REDHA A, AFZAL M, et al. Temperature-induced changes of malondialdehyde, heat-shock proteins in relation to chlorophyll fluorescence and photosynthesis in Conocarpus lancifolius (Engl.) [J]. Acta Physiologiae Plantarum, 2013, 35(4): 1223-1231.
[56]DEROCHER A E, VIERLING E. Developmental control of small heat shock protein expression during pea seed maturation [J]. Plant Journal, 1994, 5(1): 93-102.
[57]AGARWAL M, SARKAR N, GROVER A. Low molecular weight heat shock proteins in plants [J]. Journal of Plant Biology, 2003, 30: 141-149.
[58]VIERLING E. The roles of heat shock proteins in plants[J]. Annual Review of Plant Biology, 1991, 42(1): 579-620.
[59]MORROW G, TANGUAY R M. Small heat shock protein expression and functions during development [J]. The International Journal of Biochemistry & Cell Biology, 2012, 44(10): 1613-1621.
[60]SHARMA-NATU P, SUMESH K V, GHILDIYAL M C. Heat shock protein in developing grains in relation to thermotolerance for grain growth in wheat [J]. Journal of Agronomy and Crop Science, 2010, 196: 76-80.
[61]HECKATHORN S A, DOWNS C A, SHARKEY T D, et al. The small, methionine-rich chloroplast heat-shock protein protects photosystem II electron transport during heat stress[J]. Plant Physiology, 1998, 116: 439-444.
[62]PREISS J, SIVAK M N. Starch synthesis in sinks and sources [M]. New York: Marcel Dekker Inc, 1996:63-96.
[63]HASANUZZAMAN M, HOSSAIN M A, FUJITA M. Nitric oxide modulates antioxidant defense and the methylglyoxal detoxification system and reduces salinity-induced damage of wheat seedlings [J]. Plant Biotechnology Reports, 2011, 5(4): 353-365.
[64]SAKAMOTO A, MURATA N. The role of glycine betaine in the protection of plants from stress: clues from transgenic plants [J]. Plant Cell and Environment, 2002, 25(2): 163-171.
[65]RASHEED R, WAHID A, FAROOQ M, et al. Role of proline and glycine betaine pretreatments in improving heat tolerance of sprouting sugarcane (Saccharum sp.) buds [J]. Plant Growth Regulation, 2011, 65(1): 35-45.
[66]宰學明,夏连全,闫道良,等. 外源Ca2+对高温强光胁迫下滨梅幼苗的保护效应[J]. 西北植物学报, 2011, 31(3): 558-563.
[67]GONG M, LI Y J, CHEN S Z. Abscisic acid-induced thermotolerance in maize seedlings is mediated by calcium and associated with antioxidant systems[J]. Journal of Plant Physiology, 1998, 153(3/4): 488-496.
[68]LARKINDALE J, KNIGHT M R. Protection against heat stress-induced oxidative damage in Arabidopsis involves calcium, abscisic acid, ethylene, and salicylic acid[J]. Plant Physiology, 2002, 128(2): 682-695.
[69]RODRIGUEZ M, CANALES E, BORRAS-HIDALGO O. Molecular aspects of abiotic stress in plants [J]. Biotecnologia Aplicada, 2005, 22(1): 1-10.
[70]VINOCUR B, ALTMAN A. Recent advances in engineering plant tolerance to abiotic stress: achievements and limitations [J]. Current Opinion in Biotechnology, 2005, 16(2): 123-132.
[71]VON KOSKULL-DRING P, SCHARF K D, NOVER L. The diversity of plant heat stress transcription factors[J]. Trends in Plant Science, 2007, 12(10): 452-457.
[72]MILLER G, SUZUKI N, RIZHSKY L, et al. Double mutants deficient in cytosolic and thylakoid ascorbate peroxidase reveal a complex mode of interaction between reactive oxygen species, plant development, and response to abiotic stresses[J]. Plant Physiology, 2007, 144: 1777-1785.
[73]MILLER G, SHULAEV V, MITTLER R. Reactive oxygen signaling and abiotic stress [J]. Physiologia Plantarum, 2008, 133: 481-489.
[74]YOSHIDA T, SAKUMA Y, TODAKA D, et al. Functional analysis of an Arabidopsis heat-shock transcription factor HsfA3 in the transcriptional cascade downstream of the DREB2A stress-regulatory system [J]. Biochemical and Biophysical Research Communications, 2008, 368: 515-521.
[75]CHEN H, HWANG J E, LIM C J, et al. Arabidopsis DREB2C functions as a transcriptional activator of HsfA3 during the heat stress response[J]. Biochemical and Biophysical Research Communications, 2010, 401(2): 238-244.
[76]李緒友,郑进,李万德.与植物抗逆性有关的转录因子研究概况[J].中国西部科技, 2006(36): 62.
(责任编辑:王妮)
