拟南芥SSCD1基因突变对苯丙氨酸诱导花青素积累的影响
2020-03-25曾祥如雷雨婷姜依何任春梅
曾祥如,雷雨婷,姜依何,任春梅,2*
拟南芥基因突变对苯丙氨酸诱导花青素积累的影响
曾祥如1,雷雨婷1,姜依何1,任春梅1,2*
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.作物基因工程湖南省重点实验室,湖南 长沙 410128)
为探索花青素生物合成的调控机制,以模式植物拟南芥野生型Col–0和酪氨酸降解途径缺陷突变体为试验材料,分析5种浓度(0、0.1、0.5、1.0、2.0 mmol/L)外源苯丙氨酸处理后花青素的积累和花青素生物合成相关基因的表达,探讨酪氨酸降解途径受阻是否影响苯丙氨酸诱导花青素的积累。结果发现:外源添加不同浓度苯丙氨酸能提高拟南芥幼苗花青素的含量,而且花青素的含量随着苯丙氨酸浓度的增加而增多;苯丙氨酸处理后,突变体幼苗中花青素的积累增多,同时花青素生物合成基因,如、、、、、的表达水平在突变体中都显著上调,表明基因突变会阻断酸酪氨酸降解,增加苯丙氨酸诱导花青素的合成。
拟南芥;花青素;苯丙氨酸;基因;突变体;酪氨酸降解途径

花青素是植物中常见的一种天然色素,主要存在于植物器官的表皮细胞,在植物抗逆、防御病虫害、育花、育种以及维持植物内部环境的稳定等方面都发挥着重要作用[1–2]。花青素经两部分合成:第一部分是花青素生物合成上游,花青素合成底物苯丙氨酸在苯丙氨酸解氨酶(PAL)、查尔酮合成酶(CHS)、查耳酮异构酶(CHI)等多种酶的作用下形成中间代谢物二氢黄酮醇;第二部分是花青素生物合成下游,二氢黄酮醇在二氢黄酮醇还原酶(DFR)、花青素合成酶(LDOX)、黄酮3,5–糖苷转移酶(UFGT)等多种酶的催化下形成稳定的花色素[3–4]。
酪氨酸降解途径是动物必需的代谢途径,苯丙氨酸可以在动物体内转化为酪氨酸进行降解[5]。HAN等[6]发现,植物中酪氨酸降解也具有生物功能,编码拟南芥酪氨酸降解途径的基因突变能导致短日照下细胞死亡。汤睿等[7]的研究结果表明,在长日照下酪氨酸也可以进行降解。然而,植物中苯丙氨酸是否转化为酪氨酸进行降解尚不清楚。苯丙氨酸是花青素的合成前体,如果苯丙氨酸在植物中可转化成酪氨酸进行降解,那么,由于阻断了酪氨酸降解,基因突变会减少苯丙氨酸转化成酪氨酸,从而增加苯丙氨酸诱导花青素的积累。本研究中,以突变体为试验材料,野生型Col–0为对照,通过苯丙氨酸处理,采用植物生理学方法检测花青素含量,并以分子生物学方法检测花青素生物合成关键基因的表达,探究酪氨酸降解途径受阻是否影响苯丙氨酸诱导花青素的合成。
1 材料与方法
1.1 材料
拟南芥()野生型Columbia (Col–0)和突变体种子均由作物基因工程湖南省重点实验室植物信号传导课题组提供。
1.2 主要试剂与仪器
苯丙氨酸;种子消毒液(20% Bleach + 0.1% Triton X–100);花青素提取液(18% 正丙醇,1% HCl,81% ddH2O);Bio–RAD CFX connectTMoptics Module型荧光定量PCR仪;UV–1700型紫外分光光度计;人工气候箱PRX–450B。
1.3 试验方法
1.3.1拟南芥幼苗的培养
将拟南芥Col–0及突变体种子在消毒液中浸泡10 min,用超纯水清洗4~5遍后,铺种于含1% 蔗糖的MS固体培养基上,4 ℃下春化处理3 d,置于人工气候箱(16 h光照/8 h黑暗)中进行培养,培养温度(22 ± 2) ℃,光照度80~120 lx,相对湿度65%。
1.3.2花青素相对含量的测定
将在MS培养基上生长7 d的Col–0及小苗分别转移至含5种浓度(0、0.1、0.5、1.0、2.0 mmol/L)苯丙氨酸的MS培养基上继续生长7 d。根据DEIKMAN等[8]的方法测定拟南芥幼苗中花青素的含量。随机选取苯丙氨酸处理后的材料,每个处理6个样品,每个样品取10株幼苗。吸干样品上的水分,测得材料鲜质量,置于装有1 mL花青素提取液的EP管中。沸水浴3 min后,室温下黑暗过夜。用UV–1700型紫外分光光度计测定处理样品在535 nm和650 nm的吸收值,花青素相对含量为每克植物材料在535nm和650nm吸光值的差值。3次重复。试验误差用SE表示。
1.3.3RNA提取与qRT–PCR分析
将在MS培养基上生长7 d的Col–0及小苗转移至含2 mmol/L苯丙氨酸的MS培养基上继续生长7 d,随机分别摘取Col–0及幼苗的新鲜叶片100 mg,通过Trizol法提取材料总RNA。采用罗氏SYBR qPCR Mix 荧光定量试剂盒进行qRT–PCR分析。具体操作按汤睿等[9]的方法进行,以两步法程序在荧光定量PCR仪(Bio–RAD CFX connectTMoptics Module)上完成。qRT–PCR内参基因为,引物序列见表1。

表1 qRT–PCR引物序列
1.4 数据分析
采用2–ΔΔCt法对基因表达数据进行分析。
2 结果与分析
2.1 SSCD1基因突变对苯丙氨酸诱导花青素积累的影响
为探究基因突变对苯丙氨酸诱导拟南芥幼苗花青素积累的影响,用5种浓度(0、0.1、0.5、1.0、2.0mmol/L)苯丙氨酸分别处理拟南芥野生型(Col–0)和突变体幼苗,结果如图1所示。当苯丙氨酸浓度为0、0.5 mmol/L时,突变体与野生型幼苗颜色无明显差别;用1.0 mmol/L苯丙氨酸处理后,植株茎秆和叶片背面开始出现淡紫色花青素的积累,突变体叶片的颜色略深于野生型的;苯丙氨酸浓度增至2.0 mmol/L时,突变体幼苗背面和茎秆的紫色面积扩大,呈深紫色,颜色明显深于野生型的。
为更明确地了解苯丙氨酸处理后拟南芥野生型和突变体的花青素积累,对其花青素相对含量进行了测定,结果如图2所示。当苯丙氨酸浓度为0、0.1 mmol/L时,突变体中花青素的相对含量较低,与野生型的无明显差异;当苯丙氨酸浓度为0.5 mmol/L时,突变体中花青素相对含量相比野生型的稍有上升;当苯丙氨酸浓度为1.0 mmol/L时,突变体中花青素相对含量显著高于野生型的(<0.05);当苯丙氨酸浓度为2.0 mmol/L时,二者具有极显著差异(<0.01)。以上结果表明,基因突变能促进苯丙氨酸诱导花青素的积累。

a、b、c、d分别为苯丙氨酸浓度为0、0.5、1.0、2.0 mmol/L时拟南芥野生型Col–0的表型;e、f、g、h分别为苯丙氨酸浓度为0、0.5、1.0、2.0 mmol/L时拟南芥突变体sscd1的表型。
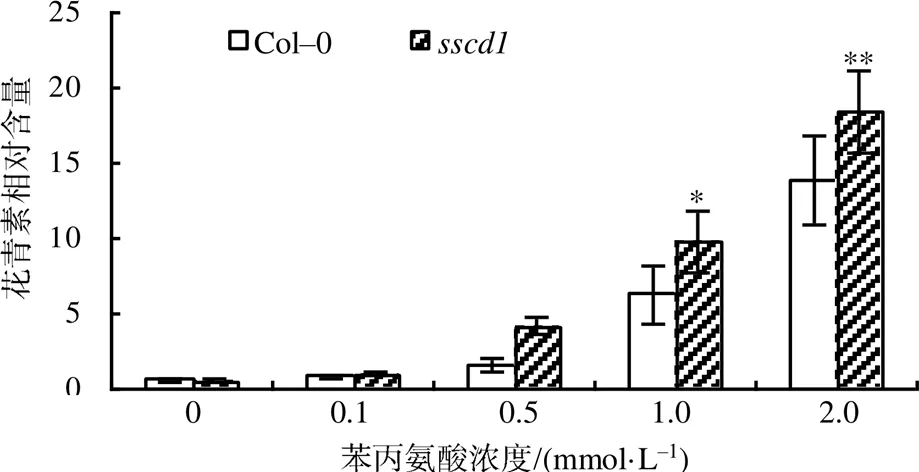
“*”表示在0.05水平下差异显著;“**”表示在0.01水平下差异极显著。
2.2 SSCD1基因突变对苯丙氨酸诱导花青素生物合成上游基因表达的影响
采用qRT–PCR对花青素生物合成上游基因和的表达进行分析(图3),发现未添加苯丙氨酸时,拟南芥突变体中这些基因的表达量较低,与野生型无明显差异;经苯丙氨酸处理后,突变体和野生型(Col–0)幼苗中3个基因的表达量均显著增加,且在突变体中的表达量显著高于野生型的(< 0.05),说明苯丙氨酸能诱导花青素生物合成上游基因的表达,基因突变能上调苯丙氨酸诱导花青素生物合成上游基因的表达。
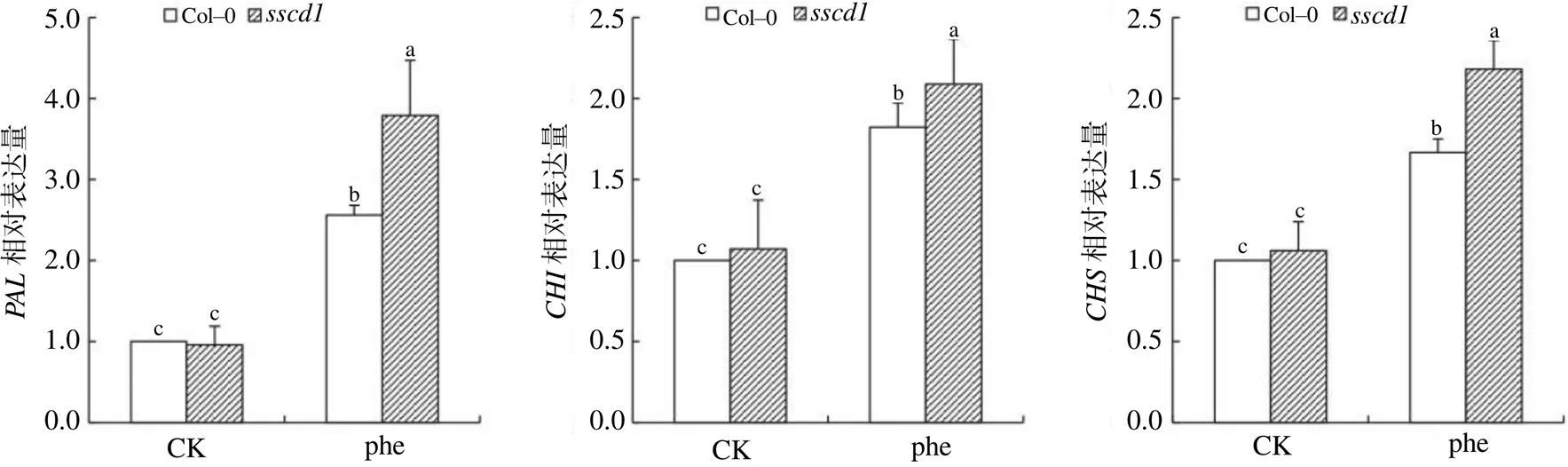
CK为未经苯丙氨酸处理的对照组;phe为经2.0 mmol/L苯丙氨酸处理的试验组。不同小写字母表示差异显著(P<0.05)。
2.3 SSCD1基因突变对苯丙氨酸诱导花青素生物合成下游基因表达的影响
对花青素生物合成下游基因、、进行测定,结果(图4)发现,未添加苯丙氨酸时,拟南芥突变体中、、基因的表达量相比野生型的无显著差别;经苯丙氨酸处理后,这些基因的表达量均显著增加,在突变体中的表达量显著高于野生型对照的(<0.05)。说明苯丙氨酸可诱导花青素生物合成下游基因的表达,而基因突变会增强苯丙氨酸的诱导作用。

CK为未经苯丙氨酸处理的对照组;phe为经2.0 mmol/L苯丙氨酸处理的试验组。不同小写字母表示差异显著(P<0.05)。
3 结论与讨论
苯丙氨酸参与植物次生代谢途径,并在一系列酶的作用下合成花青素及黄酮类物质,对植物生长具有重大意义[10]。在新疆紫草中,L–苯丙氨酸可显著促进毛状根中花青素的积累[11]。本研究中,外源添加不同浓度苯丙氨酸能提高拟南芥幼苗花青素的含量,而且花青素的含量随着苯丙氨酸浓度的增加而增多。对花青素合成的关键基因进行qRT–PCR分析,发现苯丙氨酸处理能上调花青素生物合成的上游和下游基因的表达,进一步验证了苯丙氨酸能调控植物中花青素的合成。
ZHOU等[12]的研究结果表明,酪氨酸处理拟南芥幼苗可诱导花青素的积累,但编码酪氨酸降解途径最后一个酶的基因突变后会降低酪氨酸诱导花青素的积累。突变会产生酪氨酸降解途径的异常代谢产物(琥珀酰丙酮),体内积累较多琥珀酰丙酮会对生物产生毒害作用[13–14]。外源酪氨酸处理会加速酪氨酸降解,从而增加琥珀酰丙酮在突变体中的积累,推测可能是因为琥珀酰丙酮的毒害影响了酪氨酸诱导花青素的生物合成。尿黑酸是酪氨酸降解途径的中间产物[15],汤睿等[9]研究发现,外源尿黑酸处理能诱导花青素的合成,并且在突变体中外源尿黑酸诱导合成的花青素增多,说明基因突变阻碍了尿黑酸经酪氨酸降解途径进行降解,从而增加了尿黑酸诱导花青素的积累。苯丙氨酸在动物中可转化为酪氨酸进行降解[16]。雷雨婷等[17]发现,外源苯丙氨酸处理更明显地抑制突变体的幼苗生长,说明在植物中苯丙氨酸也有可能转化成酪氨酸进行降解。苯丙氨酸是花青素的合成底物。本研究中,苯丙氨酸处理后突变体的花青素积累以及花青素生物合成上游和下游基因的表达都高于野生型,说明在野生型拟南芥中外源处理的苯丙氨酸除了用于花青素的合成,还有一部分转化成酪氨酸进行降解,而在突变体中,由于酪氨酸降解途径受阻,苯丙氨酸难以通过转化成酪氨酸进行降解;因此,苯丙氨酸处理后突变体幼苗合成的花青素要高于野生型的。该研究结果说明基因突变,可阻碍酪氨酸降解,增加苯丙氨酸诱导花青素的积累,也证明了在植物中苯丙氨酸可以转化成酪氨酸进行降解。
[1] WINKEL-SHIRLEY B.Flavonoid biosynthesis:a colorful model for genetics,biochemistry,cell biology,and biotechnology[J].Plant Physiology,2001,126(2):485–493.
[2] 胡可,韩科厅,戴思兰.环境因子调控植物花青素苷合成及呈色的机理[J].植物学报,2010,45(3):307–317.
HU K,HAN K T,DAI S L.Regulation of plant anthocyanin synthesis and pigmentation by environmental factors[J].Chinese Bulletin of Botany,2010,45(3):307–317.
[3] HOLTON T A,CORNISH E C.Genetics and biochemistry of anthocyanin biosynthesis[J].The Plant Cell,1995:1071–1083.
[4] 侯夫云,王庆美,李爱贤,等.植物花青素合成酶的研究进展[J].中国农学通报,2009,25(21):188–190.
HOU F Y,WANG Q M,LI A X,et al.Study progress on anthocyanidin synthase of plants[J].Chinese Agricultural Science Bulletin,2009,25(21):188–190.
[5] LINDBLAD B,LINDSTEDT S,STEEN G.On the enzymic defects in hereditary tyrosinemia[J].Proceedings of the National Academy of Sciences of the United States of America,1977,74(10):4641–4645.
[6] HAN C Y,REN C M,ZHI T T,et al.Disruption of fumarylacetoacetate hydrolase causes spontaneous cell death under short-day conditions in[J].Plant Physiology,2013,162(4):1956–1964.
[7] 汤睿,雷雨婷,周舟,等.尿黑酸对拟南芥酪氨酸降解缺陷突变体的影响[J].生命科学研究,2018,22(1):14–18.
TANG R,LEI Y T,ZHOU Z,et al.The effect of homogentisate on tyrosine pathway-deficientmutant of[J].Life Science Research,2018,22(1):14–18.
[8] DEIKMAN J,HAMMER P E.Induction of anthocyanin accumulation by cytokinins in[J]. Plant Physiology,1995,108(1):47–57.
[9] 汤睿,雷雨婷,任春梅.外源尿黑酸对拟南芥幼苗花青素生物合成的影响[J].湖南农业大学学报(自然科学版),2019,45(1):37–41.
TANG R,LEI Y T,REN C M.Effect of exogenous homogentisate on anthocyanin biosynthesis inseedlings[J].Journal of Hunan Agricultural University(Natural Sciences),2019,45(1):37–41.
[10] 王星,罗双霞,于萍,等.茄科蔬菜苯丙烷类代谢及相关酶基因研究进展[J].园艺学报,2017,44(9):1738–1748.
WANG X,LUO S X,YU P,et al.Advances in phenylaprapanoid metabolism and its enzyme genes in Solanaceae vegetables[J].Acta Horticulturae Sinica,2017,44(9):1738–1748.
[11] 葛素囡,张生翾,王芳,等.外源物质对新疆紫草毛状根次生代谢产物含量的影响[J].食品科学,2016,37(9):160–164.
GE S N,ZHANG S X,WANG F,et al.Effects of exogenous substances on the content of secondary metabolites injohnst hairy roots[J]. Food Science,2016,37(9):160–164.
[12] ZHOU Z,ZHI T T,LIU Y,et al.Tyrosine induces anthocyanin biosynthesis in[J]. American Journal of Plant Sciences,2014,5(3):328–331.
[13] ZHOU L Z,YANG Z G,ZHI T T,et al.A GC/MS method for determination of succinylacetone in[J].Analytical and Bioanalytical Chemistry,2016,408(17):4661–4667.
[14] ZHI T T,ZHOU Z,QIU B,et al.Loss of fumarylacetoacetate hydrolase causes light-dependent increases in protochlorophyllide and cell death in[J].The Plant Journal,2019,98(4):622–638.
[15] DIXON D P,EDWARDS R.Enzymes of tyrosine catabolism in[J].Plant Science,2006,171(3):360–366.
[16] LERNER A B.On the metabolism of phenylalanine and tyrosine[J].The Journal of Biological Chemistry,1949,181(1):281–294.
[17] 雷雨婷,汤睿,任春梅.苯丙氨酸处理对拟南芥酪氨酸降解途径的影响[J].湖南农业大学学报(自然科学版),2018,44(4):365–368.
LEI Y T,TANG R,REN C M.Effects of phenylalanine on tyrosine degradation pathway inseedlings[J].Journal of Hunan Agricultural University (Natural Sciences),2018,44(4):365–368.
Effects ofmutation on phenylalanine-induced anthocyanin accumulation in
ZENG Xiangru1,LEI Yuting1,JIANG Yihe1,REN Chunmei1,2*
(1.College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha, Hunan 410128, China; 2.Crop Gene Engineering Key Laboratory of Hunan Province, Changsha, Hunan 410128, China)
In this paper, the model plantwild type Col-0 and tyrosine degradation pathway defective mutantwere used as experimental materials to explore the regulatory mechanism of anthocyanin biosynthesis, to analyze the accumulation of anthocyanin and anthocyanin biosynthesis related gene expression after treatment with exogenous phenylalanine, and to explore whether the blocked tyrosine degradation pathway affect phenylalanine-induced anthocyanin accumulation. The results showed that the accumulation of anthocyanins inmutant seedlings increased after phenylalanine treatment, meanwhile, the expression levels of anthocyanin biosynthetic genes including,,,,andwere significantly upregulated inmutants. This results indicated that blocking tyrosine degradation bygene mutation could increase the synthesis of anthocyanin.
; anthocyanin; phenylalanine;gene;mutant; tyrosine degradation pathway
10.13331/j.cnki.jhau.2020.01.006
Q786
A
1007-1032(2020)01-0033-05
2019–05–23
2019–06–28
国家“973”计划前期研究专项(2014CB160308)
曾祥如(1996—),女,新疆玛纳斯人,硕士研究生,主要从事植物分子遗传学研究,1719809744@qq.com;
,任春梅,博士,教授,主要从事植物分子遗传学研究,rencm66@163.com
曾祥如,雷雨婷,姜依何,任春梅.拟南芥基因突变对苯丙氨酸诱导花青素积累的影响[J].湖南农业大学学报(自然科学版),2020,46(1):33–37.
ZENG X R,LEI Y T,JIANG Y H,REN C M. Effects ofmutation on phenylalanine-induced anthocyanin accumulation in[J].Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(1): 33–37.
http://xb.hunau.edu.cn
责任编辑:毛友纯
英文编辑:柳正
