赤水乌骨鸡MC1R基因多态性及其生物信息学分析
2020-03-25祖盘玉李维林家栋李洪林简华峰刘洋牟腾慧龙广丽张福平
祖盘玉,李维,林家栋,李洪林,简华峰,刘洋,牟腾慧,龙广丽,张福平*
赤水乌骨鸡基因多态性及其生物信息学分析
祖盘玉1,2,3,4,5,李维6,林家栋1,2,3,4,5,李洪林1,2,3,4,5,简华峰1,2,3,4,5,刘洋1,2,3,4,5,牟腾慧1,2,3,4,5,龙广丽1,2,3,4,5,张福平1,2,3,4,5*
(1.贵州大学动物科学学院,贵州 贵阳 550025;2.高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳 550025;3.贵州省动物遗传育种与繁殖重点实验室,贵州 贵阳 550025;4.贵州大学科研鸡场,贵州 贵阳 550025;5.贵州大学家禽研究所贵州 贵阳 550025;6.贵州省畜禽遗传资源管理站,贵州 贵阳550001)
采用DNA混池及PCR产物直接测序技术,对赤水乌骨鸡、泰和乌鸡、兴义白鸡、兴义白鸡F2代、贵州黄快羽鸡、贵州黄慢羽鸡、罗曼蛋鸡和瑶山鸡8个鸡种群基因外显子区域进行多态性分析。结果显示:瑶山鸡与红色原鸡序列一致,无SNPs,赤水乌骨鸡的4个SNPs分别为G23A(Arg→His)、C69T、T212C、G274A,泰和乌鸡的8个SNPs分别为C69T、T212C、G274A、T398C(Leu→Pro)、G636A、T637C、A644C(His→Pro)、C834T,贵州黄快、慢羽鸡和兴义白鸡均有3个SNPs,分别为A427G(Thr→Ala)、G636A、T637C,罗曼蛋鸡的4个SNPs分别为T398A(Leu→Gln)、G636A、T637C、C834T,兴义白鸡F2代的4个SNPs分别为C69T、T212C、G274A、A644C(His→Thr);生物信息学分析发现,除G274A、T398C、T398A、A644C位点的稳定性增加外,其余位点的稳定性均有所降低;除G274A、T398C、T637C、A644C位点的整体多样性有所下降外,其余位点的均有所增加;除泰和乌鸡基因编码蛋白为不稳定蛋白外,其余种群的均属于稳定蛋白,且包括泰和乌鸡在内的7个鸡群基因编码蛋白均为疏水性蛋白和非分泌蛋白;赤水乌骨鸡、泰和乌鸡、兴义白鸡、兴义白鸡F2代和罗曼蛋鸡的MC1R蛋白三级结构均由α–螺旋、β–转角、无规则卷曲组成。
赤水乌骨鸡;泰和乌鸡;兴义白鸡;兴义白鸡F2代;贵州黄快羽鸡;贵州黄慢羽鸡;罗曼蛋鸡;瑶山鸡;基因;SNPs;羽色;胫色;生物信息学分析

赤水乌骨鸡是贵州优良的肉蛋兼用型品种。母鸡羽毛为纯黑色,公鸡的背部、颈部和镰羽多带红色羽丝,尾部羽毛油黑带墨绿色光泽,其余部分为纯黑色,公母鸡的皮、肉、喙、胫、爪均为乌黑色。赤水乌骨鸡体型较大、耐热、耐粗饲、觅食能力强、肉质鲜美、营养丰富[1],与被国际上列为乌鸡标准品种的泰和乌鸡相比,其皮肤、胸肌、腿肌、舌头等组织乌度均浅于泰和乌鸡。研究表明,乌骨鸡乌度、药用价值及其独特的滋补功效均与其所含的黑色素有关[2–4]。而黑素皮质素受体1(melanocortin 1 receptor,)基因是影响黑色素合成的主控基因[5–6]。目前,多数研究[7–9]均集中在其SNPs与羽色及胫色上。TAKEUCHI等[10]和KERJE等[11]的研究结果表明,的突变与鸡的羽色有关。刘骐嘉[12]的研究结果表明,基因型和单倍型在不同胫色表型鸡中存在着明显差异。为了进一步研究基因的SNPs除与羽色和胫色相关外,是否还是影响赤水乌骨鸡与泰和乌鸡皮肤、胸肌、腿肌、舌头、骨骼等组织乌度差异的原因,本研究中,以黑羽赤水乌骨鸡及白丝羽泰和乌鸡为主要研究对象,同时选取全黄羽的贵州黄快羽鸡、贵州黄慢羽鸡(黄色胫)和全白羽的罗曼蛋鸡(白色胫)、兴义白鸡(青色胫)、兴义白羽鸡F2代(兴义白鸡(母本)与罗曼蛋鸡(父本)杂交后再自交,白色胫)及麻羽的瑶山鸡(青色胫)作为对照,运用DNA混池结合PCR产物直接测序法及生物信息学法对基因在不同羽色鸡群中的SNPs进行分析,以期找到赤水乌骨鸡和泰和乌鸡基因关键SNPs,为后期赤水乌骨鸡的选育、黑色素沉积规律的研究及其药用价值的开发利用提供依据。
1 材料与方法
1.1 材料
1) 试验动物。赤水乌骨鸡血样144份、泰和乌鸡血样98份,贵州黄快羽鸡、贵州黄慢羽鸡、兴义白鸡、罗曼蛋鸡(粉壳)、兴义白鸡F2代等鸡群血样公母各30份。以上鸡群为贵州大学科研鸡场同条件饲养至150日龄的健康鸡。瑶山鸡150日龄血样采集于贵阳绿源禽业有限公司。血样均用翅下静脉肝素钠抗凝采血法采集。
2) 试验试剂。琼脂糖、PCR Master Mix和Ezup柱式动物基因组DNA抽提试剂盒均购自上海生工生物工程技术服务有限公司。
1.2 方法
1) 基因组DNA的提取。采用DNA试剂盒提取DNA,用紫外分光光度计测定总DNA的浓度和纯度,利用1%琼脂糖凝胶电泳,随机抽取检测其DNA提取效果。
2) 引物的设计与合成。参照刘骐嘉[12]的研究设计基因引物:F,5–GCTTTGTAGGT GCTGCAGTTGTG–3;R,5–CCATCCATCCTCCT GTCTGT–3。扩增长度为1 048 bp。
3) PCR扩增和SNPs鉴定及其等位基因频率估算。分别取各鸡群鸡只的DNA 1 μL,分别构建各鸡群DNA混池,进行PCR扩增。PCR扩增反应体系:体积为30 μL,dd H2O 7.5 μL,PCR Master Mix 15 μL,DNA 3 μL,上、下游引物各2.25 μL。PCR反应条件:94 ℃预变性5 min;95 ℃变性30 s,63 ℃退火30 s,72 ℃延伸30 s,共34个循环;72 ℃延伸10 min。利用1%琼脂糖凝胶电泳检测其产物,由上海生工生物工程技术服务有限公司进行产物纯化和DNA池双向测序。运用DNA star和MWsnap 3.0分析NCBI上鸡的基因序列(红色原鸡),即原序列和测序峰图,并根据以下公式估算等位基因频率。
A=B/(1+2)(=1,2)。
式中:A表示SNP位点某等位基因频率;1与2分别表示测序峰图上该等位基因1、2峰的高度。
1.3 MC1R基因生物信息学分析
利用在线软件RNAfold web server(http://nibiru. tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi)预测基因突变前后编码区序列的mRNA二级结构;运用ExPASy–ProtParam tool (https://web. expasy.org/protparam/)预测蛋白质理化性质;采用TMHMM Server.2.0(http://www.cbs.dtu.dk/services/ TMHMM/)分析MC1R蛋白跨膜区域;利用SignalP 4.0 Server(http://www.cbs.dtu.dk/services/SignalP/)分析MC1R蛋白信号肽;运用NPS@: SOPMA secondary structure prediction (https://npsa-prabi.ibcp.fr/cgi-bin/ npsa_automat.pl?page=npsa_sopma.html)预测和分析MC1R蛋白的二级结构;在线软件SWISS–MODEL (https://swissmodel.expasy.org/)预测MC1R蛋白的三级结构。
2 结果与分析
2.1 PCR检测结果
用含核酸染料的1%琼脂糖凝胶电泳检测PCR产物,结果见图1。

M Marker DL2000;1~8分别为赤水乌骨鸡、泰和乌鸡、贵州黄快、慢羽、罗曼蛋鸡、兴义白鸡、兴义白鸡F2代、瑶山鸡。
2.2 MC1R基因SNP位点鉴定
利用DNAStar,将赤水乌骨鸡及其他7个鸡群基因双向测序结果与GenBank上提交的红色原鸡基因序列(GenBank登录号为NC_006098) (后简称原序列)进行比对,结果发现,赤水乌骨鸡有4个SNPs(以基因的第一外显子第一个碱基为+1位),分别为G23A(Arg→His)、C69T、T212C、G274A;泰和乌鸡有8个SNPs,分别为C69T、T212C、G274A、T398C(Leu→Pro)、G636A、T637C、A644C(His→Pro)、C834T;贵州黄快、慢羽鸡和兴义白鸡均有3个SNPs,分别为A427G(Thr→Ala)、G636A、T637C;罗曼蛋鸡有4个SNPs,分别为T398A(Leu→Gln)、G636A、T637C、C834T;兴义白鸡F2代有4个SNPs,分别为C69T、T212C、G274A、A644C(His→Thr);瑶山鸡的与原序列一致,无SNPs。测序结果如图2所示。特征序列列于表1。

图2 不同鸡种群MC1R基因PCR产物测序结果

表1 不同鸡种群MC1R基因的SNPs位点及序列
2.3 MC1R基因的SNPs等位基因频率估算及mRNA二级结构预测结果
由表2可知,除泰和乌鸡C69T、T212C、T637C 3个SNP位点等位基因频率突变前大于突变后外,其余SNP位点等位基因频率均为突变前小于突变后;除G274A、T398C、T398A、A644C位点的最低自由能有所降低外,其余位点的最低自由能均有所增加,即G274A、T398C、T398A、A644C位点稳定性增加,其余位点稳定性均有所降低;除G274A、T398C、T637C、A644C位点的整体多样性有所下降外,其余位点的整体多样性均有所增加,而除A644C和T398C位点外,其余发生异义突变的G23A、A427G、T398A的整体多样性均有所增加。

表2 不同鸡种群MC1R基因的SNPs等位基因频率及mRNA二级结构预测
表中SNP位点基因频率是SNP位点标示位置后面的碱基频率,如G23A的基因频率是碱基A的频率。
2.4 MC1R蛋白质序列分析
2.4.1MC1R蛋白的理化性质
由表3可知,除罗曼蛋鸡的相对分子质量比原序列的高外,其余种群的相对分子质量均低于原序列;除赤水乌骨鸡的理论等电点低于原序列的外,其余种群的理论等电点与原序列的相同;除瑶山鸡与红色原鸡外,其余7个种群的总原子数较原序列均有所减少;除泰和乌鸡属于不稳定蛋白外,其余种群均属于稳定蛋白;本研究的8个鸡种群MC1R蛋白均属于疏水性蛋白。
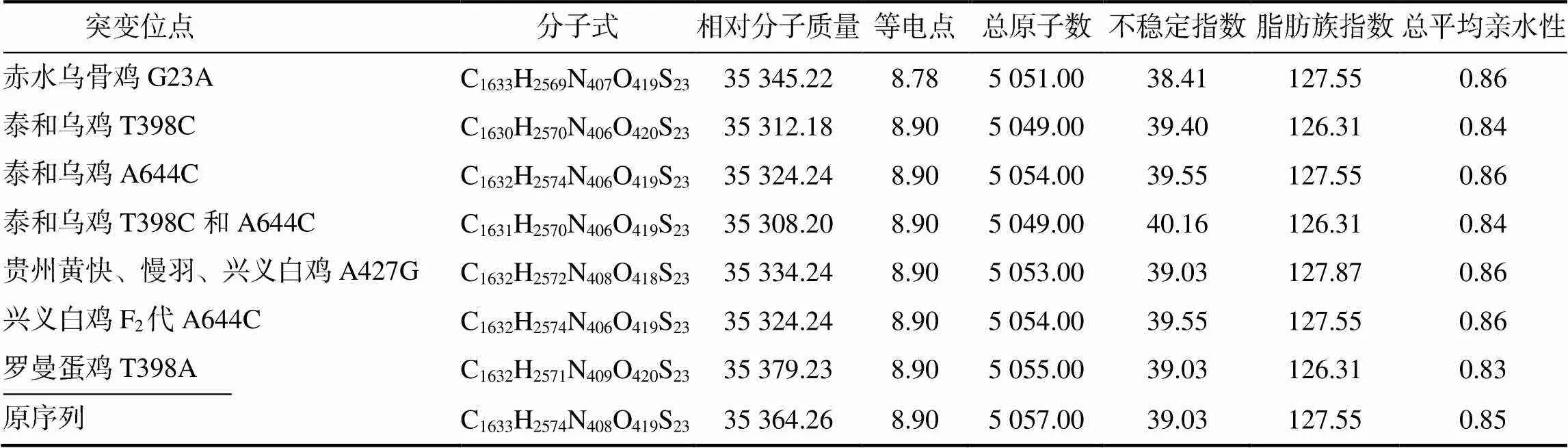
表3 不同鸡种群MC1R蛋白的理化性质
2.4.2MC1R蛋白跨膜区域及信号肽分析
MC1R蛋白的7个跨膜结构区域与原序列相比,均属于跨膜蛋白,且7个跨膜区的氨基酸残基个数及连接跨膜区的区域长度也均未改变,其中在细胞膜外有G23A和C69T,在细胞膜内有T212C、A427G、G636A、T637C、A644C,细胞膜上有G274A、T398C和C834T。对8个种群的MC1R蛋白信号肽分析,发现8个种群均属于非分泌蛋白。
2.4.3MC1R蛋白的二级结构预测
由表4可知,8个种群的MC1R蛋白二级结构均有α–螺旋、无规则卷曲、β–转角及扩展链,而无β–折叠,且α–螺旋均大于45%,故MC1R蛋白属于全α蛋白。

表4 不同鸡种群MC1R蛋白的二级结构
2.4.4MC1R蛋白的三级结构预测
利用SWISS–MODEL预测MC1R蛋白的三级结构,发现其由α–螺旋、β–转角、无规则卷曲构成(图3)。

红色示α–螺旋;黄色示β–转角;绿色示无规则卷曲;蓝色示跨膜区。
3 结论与讨论
本研究中,在除瑶山鸡外的7个种群中共找到基因10个SNPs,分别是G23A、C69T、T212C、G274A、T398C/A、A427G、G636A、T637C、A644C、C834T。
G23A突变位点仅在赤水乌骨鸡中被发现,且引起了基因mRNA二级结构、氨基酸、蛋白质理化性质、蛋白质二级及三级结构的改变。此位点,在其他鸡品种还未见报道,有可能是影响赤水乌骨鸡和泰和乌鸡乌度差异的原因之一。
本研究中,在贵州黄快、慢羽品系、罗曼蛋鸡、兴义白鸡和瑶山鸡中均未发现有C69T突变位点,而在赤水乌骨鸡、泰和乌鸡和兴义白鸡F2代中均发现C69T。通过测序峰图估算发现,赤水乌骨鸡仅出现TT型,这与张涛等[13]研究的略阳鸡花羽品系、郭秀丽[14]研究的海兰褐和罗曼褐及陈多珍等[15]研究的狄高肉鸡D品系一致,但在略阳黑羽乌鸡中,却发现2种基因型,其中TT型和CT型分别占比42%和58%[16]。泰和乌鸡、略阳普通鸡及河北柴鸡的黑羽、灰麻和白羽系的中势等位基因均为C,且在河北柴鸡中各基因型在各种羽色中的差异极显著(<0.01)[14],而兴义白鸡F2代的为T。此外,泰和乌鸡和赤水乌骨鸡均为青色胫,兴义白鸡F2代为白色胫。刘骐嘉[12]研究发现,CC型在黄色胫和豆绿胫鸡中为优势等位基因型,TT型在青色胫鸡中为优势等位基因型。由此推测,在不同鸡品种中,C69T的3种基因型与羽色及胫色关联性不一,但T等位基因与青色胫关联性较强。
本研究中,在兴义白鸡、罗曼蛋鸡、贵州黄鸡和瑶山鸡中均未发现T212C突变位点,而在泰和乌鸡中,T为优势等位基因。这与略阳黑羽乌鸡[13]和他留乌骨鸡白羽、麻羽、黑羽品系[16]及河北柴鸡黑羽、白羽、灰麻羽、黄麻羽品系[14]的表现一致,而赤水乌骨鸡和兴义白鸡F2代中C均为优势等位基因,而在略阳普通鸡[13]和狄高肉鸡D品系[15]仅发现CC型,略阳鸡花羽乌鸡中仅发现CT型[13]。杨慧[17]利用TalL酶切位点研究金水乌鸡F2代中T212C表明,TT型在黑羽和花系羽中未发现,CT型仅出现在花羽系,而CC型在黑羽、白羽和花羽中均有发现。此外,在刘骐嘉[12]的研究中,青色胫中C均为优势等位基因,赤水乌骨鸡与其一致。由于目前报道中,未涉及到白色胫,T212C的3种基因型是否与白色胫有关联性,还需进一步研究。
本研究中,仅赤水乌骨鸡、泰和乌鸡和兴义白鸡F2代发现有G274A突变位点,且泰和乌鸡和赤水乌鸡与他留乌骨鸡黑羽系[16]、海兰褐[14]、罗曼褐[14]及狄高肉鸡D品系[15]均只发现AA型。在略阳黑羽乌鸡中,却发现GG型和GA型2种基因型,且GG型为优势等位基因型[13]。根据测序峰图的估算,兴义白鸡F2代可能出现GG、GA和AA 3种中的2种或3种基因型。田宽校[18]利用MscI限制性内切酶对纯合黑羽灵山土鸡和温氏401黄鸡的G274A位点进行酶切后,认为黑色素扩散基因是由基因来编码的,但基因又不是决定灵山土鸡羽色的唯一基因。此外,本研究中的赤水乌骨鸡和泰和乌鸡及刘骐嘉[12]研究的青色胫鸡中,优势等位基因型均为AA型。由此推测,在不同鸡品种中,G274A的3种基因型与羽色及胫色关联性不一,但A等位基因与青色胫关联性较强,与白色胫关联性如何还需要进一步研究。
本研究中的泰和乌鸡与河北柴鸡[14]黑羽、灰麻、黄羽系均发生T398C,且TT型为优势等位基因型,而在白羽系中未发现此突变,其中CC型仅在黑羽系中发现,TC型在灰麻系的2个世代中均有发现,而在黄麻品系中,仅在1世代中有发现。本研究中的罗曼蛋鸡与冉金山[19]研究的罗曼蛋鸡均有T398A。冉金山[19]研究发现,在罗曼蛋鸡(白羽)、广元灰鸡(灰羽)及芦花鸡(横斑羽)中,优势等位基因均为T,而本研究中的罗曼蛋鸡优势等位基因为A,可能是由于样本量较小所致。就T398C/A而言,在同品种中,CC型与黑羽关联性较大,而在不同鸡品种中,是否与羽色相关联还需进一步研究。由于T398C(Leu→Pro)发生异义突变,此位点可能是影响赤水乌骨鸡和泰和乌鸡乌度差异的原因之一。
A427G突变位点仅出现在贵州黄快、慢羽系和兴义白鸡中,且只发现GG型,这与陈多珍等[15]对狄高肉鸡AB和C品系的研究发现一致。在郭秀丽[14]研究的河北柴鸡黄麻系中,经过一个世代的提纯后,GG基因型频率有所提高,但在黑羽系、白羽系及灰麻系零世代中均未出现此基因型,而在灰麻系1世代中又发现此基因型。在郭秀丽[14]研究的海兰褐和罗曼褐中也只出现AG和GG型。此外,郭秀丽[14]对A427G在胫色上的关联性研究发现,黄色胫鸡中,G为优势等位基因,且青胫和黄胫、黄胫和豆绿胫的等位基因频率差异都达到了极显著水平(<0.01),而青胫和豆绿胫的差异不显著[12]。由此推测,A427G的G等位基因可能与黄羽及黄色胫关联性较大,但与白羽及白色胫关系如何还需要进一步研究。本研究中,G636A突变位点在贵州黄快、慢羽系及罗曼蛋鸡中均只发现AA型,与狄高肉鸡AB和C品系[15]中发现的一致。郭秀丽[14]研究发现,GA和AA型在其所研究的所有鸡品种中均有发现,经过1个世代的提纯后,GG型和AA型在黑羽和灰羽系中均有所降低,而GA型在黑羽、灰羽和黄麻品系中均有所增加,AA型仅在黄麻系中有所增加。本研究的泰和乌鸡A等位基因频率为0.53,而他留乌骨鸡白羽、麻羽、黑羽3个品系与郑嫩珠等[20]研究的C品系(黑羽,皮肤、肌肉、骨膜、心脏、肝脏等组织均为黑色)和D品系(白羽,皮肤、肌肉、骨膜、心脏、肝脏等组织均为白色)的一致,G为优势等位基因。此外,青色胫的泰和乌鸡的优势等位基因为A,这与刘骐嘉[12]的研究结果(青胫鸡中G为优势等位基因)不一致,可能是由于品种差异所致。刘骐嘉[12]在黄胫和豆绿胫的研究中,A为优势等位基因,本研究对贵州黄鸡和罗曼蛋鸡的研究结果与其一致。由此推测,G636A的3种基因型与羽色关联性不大,但A等位基因与黄色胫关联性较大,可对此位点与胫色进行关联性分析。
与陈多珍[15]研究的狄高肉鸡AB和C品系一致,本研究中,贵州黄快、慢羽和罗曼蛋鸡的T637C突变位点均只发现CC型。在本研究的泰和乌鸡的T637C中,除CC基因型外还存在其他基因型,且C为优势等位基因,这与郭秀丽[14]研究的海兰褐、罗曼褐、河北柴鸡的黑羽和黄麻系及冉金山[19]研究的罗曼蛋鸡的一致。在滕召纯等[16]研究的他留乌骨鸡白羽、麻羽、黑羽3个品系和郭秀丽[14]研究的河北柴鸡白羽系中,T为优势等位基因。郑嫩珠等[20]对德化黑鸡的研究中发现,在C品系和D品系中均只有TT和CC 2种基因型,C品系中有TT型(93.18%)和CC型(6.82%),D品系中有TT型(92%)和CC型(8%),其羽色依旧是TT型为优势等位基因型。本研究中,青色胫的泰和乌鸡优势等位基因为C,而刘骐嘉[12]研究发现,青色胫鸡中T为优势等位基因,可能是由于品种差异所致;但刘骐嘉[12]研究发现在黄色胫鸡中,C为优势等位基因,本研究的贵州黄鸡和罗曼蛋鸡与其一致。由此推测,在同品种中,T637C的C等位基因与黄色羽和黄色胫关联性较强。
本研究中,A644C突变位点仅在泰和乌鸡和兴义白鸡F2代中发现,其优势等位基因分别为A和C。略阳普通鸡为CC型,略阳花羽乌鸡为AC型,从略阳黑羽乌鸡中发现有AA型和AC型2种基因型,且AA型为优势等位基因型[13]。在他留乌骨鸡中仅从白羽和麻羽品系中发现有A644C,且A均为优势等位基因,而在黑羽品系中未发现此突变位点[16]。郭秀丽[14]研究发现,AA型在其所研究的所有鸡品种中均为优势等位基因型,AC型在除白羽系外的其他鸡品种中均有所发现,AA型在黑羽和灰羽系中均有所降低,而CC型在黑羽和黄麻系中均有所增加,但未在海兰褐和罗曼褐中发现CC型[14]。在狄高肉鸡中,AA型出现在AB和C品系中,CC型仅出现在D品系中[15]。此外,本研究中,泰和乌鸡的优势等位基因为A,而青色胫鸡的优势等位基因为C[12]。由此推测,A644C在不同鸡品种中,不同基因型与羽色和胫色性状关联性不一,在同一品种中,与胫色有一定的关联性。
本研究中,仅从罗曼蛋鸡和泰和乌鸡中发现有C834T突变位点,二者优势等位基因分别为T和C。杨永升[7]研究发现,C834T位点在C系为丝羽乌骨鸡亲本(白羽、黑皮肤、活体与屠体胫色黑色、黑肉、黑色内脏膜)中发现CC、CT和TT 3种基因型,CC型为优势等位基因型,而在A品系为明星肉鸡亲本(白羽、白皮肤、内脏膜无色、肉色微红、活体胫色为黄色,屠体胫色白色)中未发现此突变位点。此外,在以丝羽乌骨鸡与明星肉鸡为亲本建立的中国农业大学资源家系群体中,C834T突变与鸡的活体胫色性状显著相关(<0.05),在其他组织黑色素性状中差异不显著。王建等[21]研究发现CC和TT基因型在不同活体胫色性状中差异显著(<0.05)。由此推测,C834T可能与白色羽和胫色性状有很大的相关性。
基因是一个高度多态的基因,对不同鸡品种羽色和胫色的影响并不是某一单个位点所决定的,而是多个突变位点共同作用所致。单对本研究的赤水乌骨鸡和泰和乌鸡而言,通过生物信息学分析发现,赤水乌骨鸡的G23A和泰和乌鸡的T398C、A644C发生异义突变,从而导致MC1R蛋白质二级及三级结构的改变,而泰和乌鸡T398C和A644C同时突变会导致MC1R蛋白稳定性降低,变为不稳定蛋白。由此推测,G23A、T398C和A644C可能是影响赤水乌骨鸡和泰和乌鸡乌度差异的重要原因。此外,基因[22]和基因[23]分别与横斑羽及金银羽有关,且都位于Z染色体上。郭军等[24]研究表明,Z染色体基因对蛋鸡早期体质量加性遗传方差有贡献,而赤水乌骨鸡公鸡的背部、颈部和镰羽还带有红色羽丝,母鸡则全是黑羽,且母鸡肤色比公鸡乌度深,性别也可作为后期选育乌度更深的赤水乌骨鸡的一项指标。
[1] 肖竺宏.贵州赤水竹乡鸡的遗传资源调查[J].贵州畜牧兽医,2012,36(4):27–28.
XIAO Z H.Investigation on genetic resources of Chishui black-bone chickens in Guizhou[J].Guizhou Journal of Animal Husbandry & Veterinary Medicine,2012,36(4):27–28.
[2] 郑从义,胡国斌,屈三甫,等.黑色素对流感病毒诱导细胞凋亡的抑制效应[J].武汉大学学报(自然科学版),1999,45(4):469–472.
ZHENG C Y,HU G B,QU S F,et al.Inhibition of melanin fromon the apoptosis induced by influenza virus in MDCK cells[J].Wuhan University Journal(Natural Science Edition),1999,45(4):469–472.
[3] GANTZ I,SHIMOTO Y,KONDA Y,et al.Molecular cloning,expression,and characterization of a fifth melanocortin receptor[J].Biochemical & Biophysical Research Communications,1994,200(3):1214–1220.
[4] MOUNTJOY K G,ROBBINS L S,MORTRUD M T,et al.The cloning of a family of genes that encode the melanocortin receptors[J].Science,1992,257:1248–1251.
[5] 王乐,张斌,郑文新,等.动物毛色与黑色素皮质素受体1()基因[J].草食家畜,2009(2):10–12.
WANG L,ZHAGN B,ZHENG W X,et al.The hair color of animal and melanocortin receptor 1()[J]. Grass-Feeding Livestock,2009(2):10–12.
[6] 徐幸莲,庄苏,陈伯祥.乌骨鸡黑色素对延缓果蝇衰老的作用[J].南京农业大学学报,1999,22(2):105–108.
XU L,ZHUANG S,CHEN B X.The effect of melanin from White Silky Fowl on antiageing in[J].Journal of Nanjing Agricultural University,22(2):105–108.
[7] 杨永升.鸡基因的SNPs分析与染色体定位[D].杭州:浙江大学,2004.
YANG Y S.SNPs analysis and chromosomal location ofgene in chicken[D].Hangzhou:Zhejiang University,2004.
[8] RODRIGUES A R,ALMEIDA H,GOUVEIA A M. Intracellular signaling mechanisms of the melanocortin receptors:current state of the art[J].Cellular and Molecular Life Sciences,2015,72(7):1331–1345.
[9] 封竣淇,徐伟,黄兰,等.基因的研究进展[J].中国畜牧兽医,2017(4):1141–1148.
FENG J Q,XU W,HUANG L,et al.Research advance ofgene[J].China Animal Husbandry & Veterinary Medicine,2017,44(4):1141–1148.
[10] TAKEUCHI S,SUZUKI H,HIROSE S,et al. Molecular cloning and sequence analysis of the chick melanocortin 1-receptor gene[J].Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression,1996,1306(2/3):122–126.
[11] KERJE S,LIND J,SCHUTZ,K,et al. Melanocortin 1-receptor () mutations are associated with plumage colour in chicken[J].Animal Genetics,2003,34(4):241–248.
[12] 刘骐嘉.不同胫色优质鸡生产性能比较及其与基因多态性的相关分析[D].雅安:四川农业大学,2015.
LU Q J.Comparison of different shank color quality chicken production performance and associated with theSNP analysis[D].Ya’an:Sichuan Agricultural University,2015.
[13] 张涛,路宏朝,江海,等.略阳乌鸡黑素皮质素受体1()基因变异及蛋白质结构的预测[J].贵州农业科学,2012,40(10):120–125.
ZHANG T,LU H Z,JIANG H,et al.Variation ofgene and prediction of protein structure in Lueyang Silky Fowl[J].Guizhou Agricultural Sciences,2012,40(10):120–125.
[14] 郭秀丽.河北柴鸡基因变异研究[D].保定:河北农业大学,2009.
GUO X L.Study on variation ofgene Hebei Domestic Chicken[D].Baoding:Hebei Agricultural University,2009.
[15] 陈多珍,李艳梅,杨向东,等.基因在狄高肉鸡配套系羽色纯化中的应用[J].中国家禽,2018,40(18):8–12.
CHEN D Z,LI Y M,YANG X D,et al.Application ofgene in purification of feather color of Diga Broiler Lines[J].China Poultry,2018,40(18):8–12.
[16] 滕召纯,陆哓屏,王玉祥,等.基因ⅠPCR– RFLP标记与他留乌骨鸡羽色性状的相关性研究[J].中国家禽,2013,35(20):11–14.
TENG Z C,LU X P,WANG Y X,et al.Association ofⅠ PCR-RFLP aenetic marker with plumage color in Taliu Black-Boned Chicken [J]. China poultry,2013,35(20):11–14.
[17] 杨慧.金水丝羽乌骨鸡资源群体的构建和三个基因的SNPs检测及其与羽色性状的连锁分析[D].武汉:华中农业大学,2010.
YANG H.Construction of resource population for Jinshui Silky Chicken and SNPs detection of three genes and their linkage analysis with plumage colour[D].Wuhan:Huazhong Agricultural University,2010.
[18] 田宽校.灵山土鸡基因的多态性与羽色的相关性研究[D].南京:南京农业大学,2009.
TIAN K X.Association of PCR-RFLP polymorphism ofgene with plumage colour in Lingshan Local Chicken[D].Nangjing:Nanjing Agricultural University,2009.
[19] 冉金山.鸡羽色相关基因、和的多态性及组织表达研究[D].雅安:四川农业大学,2017.
RAN J S.Study on polymorphisms and tissues expression of,andgenes in different feather color chicken[D].Ya’an:Sichuan Agricultural University,2017.
[20] 郑嫩珠,董晓宁,陈晖,等.德化黑鸡黑素皮质素受体1()基因单核苷酸多态性分析[J].福建农业学报,2008,23(2):132–136.
ZHENG N Z,DONG X N,CHEN H,et al.Single nucleotide polymorphism analysis on melanocortin 1-receptor gene in Dehua Black Chicken[J].Fujian Journal of Agricultural Sciences,2008,23(2):132–136.
[21] 王建,钟发刚,吴桐忠.基因多态性与其肤色、胫色表型相关性的分析[J].国外畜牧学(猪与禽),2008,28(2):75–77.
WANG J,ZHONG F G,WU T Z.Correlation betweengene polymorphism and skin color and shin phenotype [J].Pigs and Poultry,2008,28(2):75–77.
[22] HELLSTRÖM A R,SUNDSTRÖM E,GUNNARSSON U,et al.Sex-linked barring in chickens is controlled by thetumour suppressor locus[J].Pigment Cell Melanoma Res,2010,23(4):521–530.
[23] GUNNARSSON U,HELLSTRÖM A R,TIXIER- BOICHARD M,et al.Mutations incause plumage color variation in chicken and Japanese quail[J].Genetics,2007,175(2):867–877.
[24] 郭军,曲亮,窦套存,等.3周龄蛋鸡体质量性连锁遗传效应分析[J].湖南农业大学学报(自然科学版),2018,44(6):645–649.
GUO J,QU L,DOU T C,et al.Effects of sex linkage genetic variances on chick’s body weight at third week age[J].Journal of Hunan Agricultural University(Natural Sciences),2018,44(6):645–649.
Polymorphism and bioinformatics analysis ofgene in Chishui Black-Bone chickens
ZU Panyu1,2,3,4,5, LI Wei6, LIN Jiadong1,2,3,4,5, LI Honglin1,2,3,4,5, JIAN Huafeng1,2,3,4,5, LIUYang1,2,3,4,5, MOU Tenghui1,2,3,4,5, LONG Gangli1,2,3,4,5, ZHANG Fuping1,2,3,4,5*
(1.College of Animal Sciences, Guizhou University, Guiyang, Guizhou 550025, China; 2.Key Laboratory of Animal Genetics, Breeding and Reproduction in the Plateau Mountainous Region, Ministry of Education, Guiyang, Guizhou 550025, China; 3.Guizhou Key Laboratory of Animal Genetics, Breeding and Reproduction, Guiyang, Guizhou 550025, China; 4.Chicken Farm of Guizhou University, Guiyang, Guizhou 550025, China; 5.Poultry Research Institute of Guizhou University, Guiyang, Guizhou 550025, China; 6.Guizhou Province Animal and Poultry Genetic Resources Management Station, Guiyang, Guizhou 550001, China)
DNA mixing pool and direct sequencing of PCR products were used to analyze the polymorphism ofexon regions in 8 chicken populations of Chishui Black-Bone Chickens, Taihe Silky Fowl, Xingyi White Chickens, the F2Xingyi White Chickens, Guizhou Yellow Fast Chickens, Guizhou Yellow Slow Chickens, Luoman Laying Hens and Yaoshan Chickens. The results showed that the sequence of Yaoshan Chickens was identical to that of Red Jungle Fowl without SNPs. The four SNPs of Chishui Black-Bone Chickens were G23A(Arg→His), C69T, T212C and G274A. The eight SNPs of Taihe Silky Fowl were C69T, T212C, G274A, T398C(Leu→Pro), G636A, T637C, A644C(His→Pro) and C834T. Guizhou Yellow Fast Chickens, Guizhou Yellow Slow Chickens and Xingyi White Chickens all had 3 SNPs, A427G(Thr→Ala), G636A and T637C. The 4 SNPs of Luoman Laying Hens were T398A(Leu→Gln), G636A, T637C and C834T. The 4 SNPs of the F2Xingyi White Chickens were C69T, T212C, G274A and A644C(His→Thr). The bioinformatics analysis found that except for the stability of G274A, T398C, T398A and A644C sites, the stability of the other sites decreased. Except that Taihe Silky Fowl, whosegene encoding protein was unstable, the other populations’s MC1R protein were stable, and all the proteins from the 7 chicken populations were owing hydrophobic and non-secreted character. The tertiary structure of MC1R protein of Chishui Black-Bone Chickens, Taihe Silky Fowl, Xingyi White Chickens, the F2Xingyi White Chickens and Luoman Laying Hens were composed of α-helix, β-turn, and random curl.
Chishui Black-Bone Chickens; Taihe Silky Fowl; Xingyi White Chickens; the F2Xingyi White Chickens; Guizhou Yellow Fast Chickens; Guizhou Yellow Slow Chickens; Luoman laying hen; Yaoshan chicken;gene; SNPs; plumage color; shank color;bioinformatics analysis
10.13,331/j.cnki.jhau.2020.01.013
S831.2
A
1007-1032(2020)01-0084-09
2019–02–22
2019–04–22
贵州省科技计划项目(黔科合支撑[2016]2507、[2017]2533–1);贵州省科技计划项目(2019[2288]);贵州省生态家禽产业技术体系建设项目
祖盘玉(1992—),女,贵州盘县人,硕士研究生,主要从事特种经济动物饲养研究,1473326412@qq.com;
,张福平副教授,主要从事家禽育种研究,zfu-1010@126.com
祖盘玉,李维,林家栋,李洪林,简华峰,刘洋,牟腾慧,龙广丽,张福平.赤水乌骨鸡基因多态性及其生物信息学分析[J].湖南农业大学学报(自然科学版),2020,46(1):84–92.
ZU P Y, LI W, LIN J D, LI H L, JIAN H F, LIUY, MOU T H, LONG G L, ZHANG F P. Polymorphism and bioinformatics analysis ofgene in Chishui Black-Bone Chickens[J].Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(1):84–92.
http://xb.hunau.edu.cn
责任编辑:邹慧玲
英文编辑:柳正
