外源水杨酸对烟草幼苗低温胁迫的缓解效应
2020-03-25侯爽陈锦芬刘溶荣王瑞陈俊鸿邹聪明谢小玉
侯爽,陈锦芬,刘溶荣,王瑞,陈俊鸿,邹聪明,谢小玉*
外源水杨酸对烟草幼苗低温胁迫的缓解效应
侯爽1,陈锦芬1,刘溶荣1,王瑞1,陈俊鸿2,邹聪明3*,谢小玉1*
(1.西南大学农学与生物科技学院,重庆 400715;2.云南省烟草公司红河州公司,云南 弥勒 661500;3.云南省烟草农业科学研究院,云南 昆明 657000)
为探究外源水杨酸(SA)对烤烟在低温胁迫下的缓解作用,运用人工气候培养箱模拟4 ℃低温,设置SA(质量浓度10、25、50、100、150 mg/L)对盆栽K326烟草幼苗进行连续3 d根灌预处理,随后再进行连续4 d的低温处理,以常温(25 ℃)作为正向对照(CK),以4 ℃低温且未施用外源SA处理为负向对照(CK0),测定烟草叶片的相对电导率、丙二醛(MDA)含量、渗透调节物质含量、抗氧化酶活性、非酶抗氧化剂含量等指标。结果表明:4 ℃胁迫前根施3 d SA预处理下的烟草幼苗,在随后持续4 d的低温胁迫后,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性均显著提高,这3种保护酶分别在50、10、25 mg/ L SA处理下活性最高;谷胱甘肽还原酶(GR)和抗坏血酸过氧化物酶(APX)活性增强,其中GR和APX活性分别在根施100 mg/ L和50 mg/ L SA处理下达到最大值;低温胁迫下烟草幼苗可溶性糖(SS)含量在10 mg/L SA处理下较CK0提高了17.46%,可溶性蛋白(SP)、脯氨酸(Pro)、抗坏血酸(ASA)在50 mg/L SA处理下含量均达到最高,较CK0分别提升了30.35%、316.44%和31.21%,还原型谷胱甘肽(GSH)含量在25 mg/L SA处理下较CK0显著提高了51.38%,这些指标的提升,缓解了REC和MDA含量在低温胁迫下的上升。抗寒性隶属函数分析表明,50 mg/L的SA预处理对4 ℃低温胁迫下的K326具有最大缓解效应。
烟草;外源水杨酸;低温胁迫;缓解作用

烟草是喜温植物,对低温较为敏感,缺乏冷适应机制,25~28 ℃是烟草生长的最适温度。中国大部分烟区自然气候适宜种植烟草,但仍然存在气温较低或者气温波动较大的极端气候[1],福建、江西等南方烟区,烟苗移栽后倒春寒带来的低温冷害问题普遍存在[2]。低温冷害是影响烟草种植最严重的非生物胁迫因素。从表观形态上看,低温胁迫引起发芽率降低、幼苗发育不良、叶片黄化、阻碍叶片伸展,同时导致叶片萎蔫,抑制叶片的光合速率,严重时甚至可能导致组织死亡[3–4];从内部代谢角度看,低温胁迫下活性氧(ROS)大量产生,最终导致细胞膜的相变或氧化损伤[5];极端低温还会破坏细胞内环境的平衡,破坏植物正常的新陈代谢[6]。近年来,外源水杨酸(SA)被大量应用于缓解植物低温胁迫[7–9]。笔者以低温敏感型烟草品种K326为材料,以常温(25 ℃)生长作为正向对照(CK),以未施用外源SA预处理且持续4 d 4 ℃处理的烟草幼苗为负向对照(CK0),设置5个外源SA质量浓度(10、25、50、100、150 mg/L),对低温处理前的烟草幼苗进行连续3 d的根灌预处理,随后进行持续4 d低温处理(4 ℃),测定烟草叶片相对电导率、丙二醛(MDA)含量、渗透调节物质含量、抗氧化酶活性和非酶抗氧化剂含量等指标,探讨外源SA提高烟草抗低温胁迫能力的机理,以期为缓解烟草低温胁迫提供依据。
1 材料与方法
1.1 材料
烤烟品种K326,由中烟种子有限责任公司提供。
1.2 试验设计
试验于2019年3月至7月在西南大学试验农场温室和人工气候培养箱中进行。烤烟漂浮育苗,常规管理。待幼苗长到4片真叶时,挑选长势好、大小一致的幼苗移栽于装有育苗基质的塑料盆中(盆高17 cm、直径15 cm),置于人工气候培养箱培养(白天25 ℃、光照度20 000 lx、14 h,夜间18 ℃、10 h),每隔3 d于9:00根施1/2 Hoagland营养液50 mL。待幼苗长出第9片叶时,分为7组(每组3盆,每盆留1苗),取其中2组分别作为正向对照(CK)和负向对照(CK0):CK于人工气候培养箱25 ℃培养,CK0于人工气候培养箱25 ℃培养3 d后,进行4 ℃处理。另外5组于人工气候培养箱25 ℃培养3 d,每天9:00分别根施50 mL质量浓度分别为10、25、50、100、150 mg/L外源SA溶液,3 d后进行4 ℃处理,连续4 d后,于第8天9:00—10:00 对7组烟苗叶片取样(液氮速冻,–80 ℃保存),测定各项生理指标。每个处理3次重复。
1.3 测定项目及方法
采用上海优选生物科技有限公司生产的丙二醛(MDA)含量检测试剂盒、脯氨酸(Pro)含量检测试剂盒、植物可溶性糖试剂盒、可溶性蛋白含量测定试剂盒、抗坏血酸过氧化物酶(APX)活性检测试剂盒、谷胱甘肽还原酶(GR)活性测定试剂盒、抗坏血酸(ASA)含量检测试剂盒和还原型谷胱甘肽(GSH)含量检测试剂盒分别测定烟叶丙二醛、脯氨酸、可溶性糖(SS)、可溶性蛋白(SP)含量、APX活性、GR活性、ASA和GSH含量。相对电导率采用陈爱葵等[10]的方法测定。
使用上海净信JXFSTPRP–48型打样机低温快速研磨,4 ℃、12 000 r/min离心10 min,取上清液即粗酶液进行保护性酶活性测定。超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定;过氧化物酶(POD)活性采用愈创木酚法测定[11];过氧化氢酶(CAT)活性采用上海优选生物科技有限公司生产的过氧化氢酶(CAT)检测试剂盒(比色法)测定。
1.4 统计方法
采用Microsoft Excel 2006和 SPSS 18.0 软件中的Duncans多重比较分析法,对试验数据进行统计分析。采用隶属函数值法对抗寒性进行分析:当生理指标增加有利于提高植株抗低温能力时,选择隶属函数公式U=(U–min)/(max–min);反之,则选择隶属函数公式U=1–(U–min)/(max–min)。式中:max为某系列指标测定最大值;min为某系列指标测定最小值;为相应系列指标测定值。最后计算出各指标的隶属函数值的加权平均数。
2 结果与分析
2.1 外源水杨酸对低温胁迫烟草MDA含量和相对电导率的影响
烟草叶片质膜透性和MDA含量测定结果列于表1。根施10~150 mg/L的外源SA时,随着SA浓度的增加,叶片相对电导率先下降后上升,各处理较CK0分别下降了24.74%、49.73%、40.99%、33.92%、30.11%;25 mg/L外源SA处理下,相对电导率降至最低,与CK无显著差异。在10~150 mg/L外源SA处理下,随着SA质量浓度的增加,叶片MDA含量上升,10~100 mg/L的外源SA处理具有缓解效应,各处理较CK0分别下降了34.62%、34.49%、31.36%、12.87%,10~50 mg/L外源水杨酸处理具有最佳缓解效果。
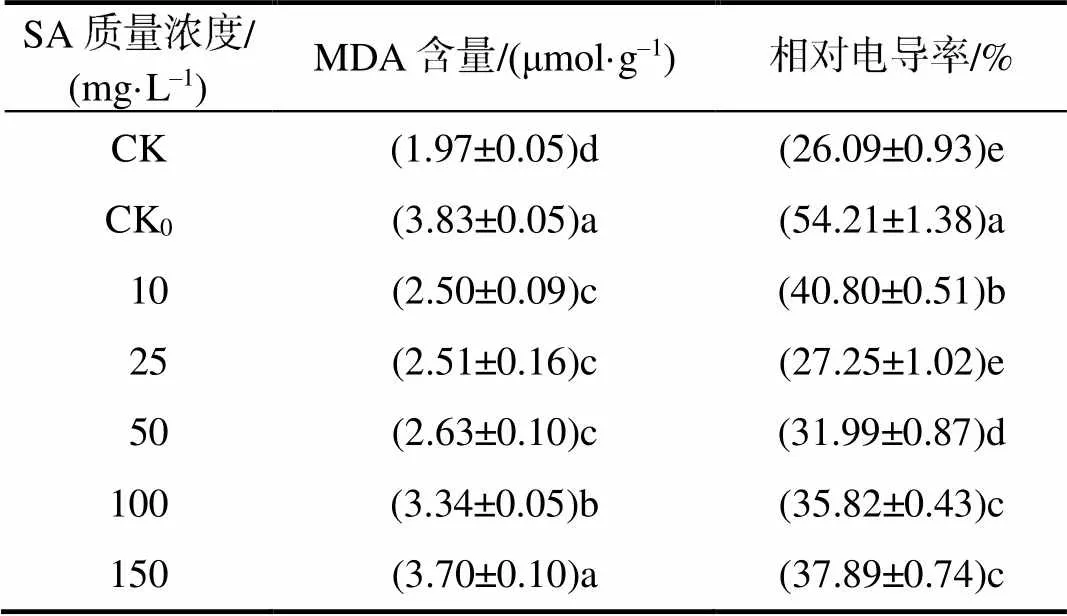
表1 外源水杨酸处理低温胁迫烟叶的相对电导率和MDA含量
不同小写字母表示差异显著(<0.05)。
2.2 外源水杨酸对低温胁迫烟草叶片抗氧化酶活性的影响
2.2.1对SOD、POD、CAT活性的影响
表2结果表明,CK0处理后,烟叶保护性酶SOD、POD、CAT活性较CK分别下降了10.54%、30.15%、20.58%,与各自CK均存在显著差异(<0.05)。低温胁迫下,外源SA质量浓度10~150 mg/L处理,SOD活性均显著高于CK0的(<0.05),分别上升了12.85%、19.00%、30.11%、16.20%、17.13%,整体呈先上升后下降的趋势,在外源SA质量浓度为50 mg/L时,SOD活性达到最大值;随着外源SA质量浓度的增加,POD活性呈先上升后下降的趋势,较CK0处理分别上升了40.38%、56.05%、44.49%、43.37%、27.10%,与CK0均存在显著差异(<0.05),在25 mg/L时达到最大值;4 ℃胁迫下,在10 mg/L外源SA处理下,CAT活性达到最大值,随着外源SA质量浓度的增加,CAT活性呈下降的趋势,10~150 mg/L各处理较CK0处理CAT活性分别上升了104.53%、79.17%、69.36%、37.56%、31.92%。
2.2.2对APX和GR活性的影响
表2结果表明,根施10~150 mg/L外源SA,均显著提高了4 ℃低温下烟草幼苗叶片APX酶的活性,10~50 mg/L时,随着外源SA质量浓度的增加,APX酶活性上升;SA超过50 mg/L,随着SA质量浓度增加,APX活性下降;CK0处理下GR活性大幅度下降,CK下降了66.64%,且存在显著差异(<0.05)。低温胁迫下,随着外源SA质量浓度的增加,GR活性呈先上升后下降的趋势,25~150 mg/L外源SA处理下,GR活性均显著高于CK0处理,分别提升了33.19%、62.21%、195.11%、105.51%,100 mg/L外源SA处理的GR活性达到最大值,缓解效应最佳。

表2 外源水杨酸处理烟草幼苗叶片抗氧化酶的活性
不同小写字母表示差异显著(<0.05)。
2.3 外源水杨酸对低温胁迫下烟草叶片渗透调节物质的影响
如表3所示,CK0处理下,烟草幼苗渗透调节物质含量较CK均呈显著上升的趋势,低温胁迫下烟草幼苗具有一定的抵抗力,随着根施水杨酸浓度的增加,可溶性糖、可溶性蛋白和脯氨酸含量均呈先上升后下降的趋势。可溶性糖含量在根施SA 10 mg/L时达到最大值,较CK0提高了17.46%,且存在显著差异(<0.05);根施10~150 mg/L外源SA,可溶性蛋白含量较CK0分别上升了8.60%、8.78%、30.35%、4.67%、3.14%,在50 mg/L处理下,可溶性蛋白含量达到最大值,且与CK0处理存在显著差异(<0.05);脯氨酸含量在外源SA各浓度处理下均显著高于CK0处理(<0.05),10~150 mg/L外源SA处理下,脯氨酸含量较CK0分别上升了250.73%、272.88%、316.44%、187.98%、115.35%,50 mg/L SA处理下脯氨酸含量达到最大值。

表3 外源水杨酸处理低温胁迫烟苗叶片渗透调节物质的含量
2.4 外源水杨酸对低温胁迫下烟草幼苗叶片非酶抗氧化剂含量的影响
CK0处理时,ASA和GSH含量较CK显著降低,分别下降了4.25%、20.63%。随着外源SA的施用,在适宜浓度下ASA和GSH含量均得到有效提升。10~100 mg/L外源SA处理, 烟叶ASA含量均显著高于CK0的(<0.05),较CK0的ASA含量分别上升了13.60%、21.90%、31.21%、4.72%,在50 mg/L外源SA处理下,ASA含量达到最高值;10~150 mg/L外源SA处理,各组GSH含量均显著高于CK0的(<0.05),分别提升了45.21%、51.38%、42.98%、25.44%、17.04%,随着外源SA质量浓度的增加,GSH含量呈先上升后下降的趋势,在25 mg/L外源SA处理时,GSH含量达到最大值,具有最大缓解效应(表4)。
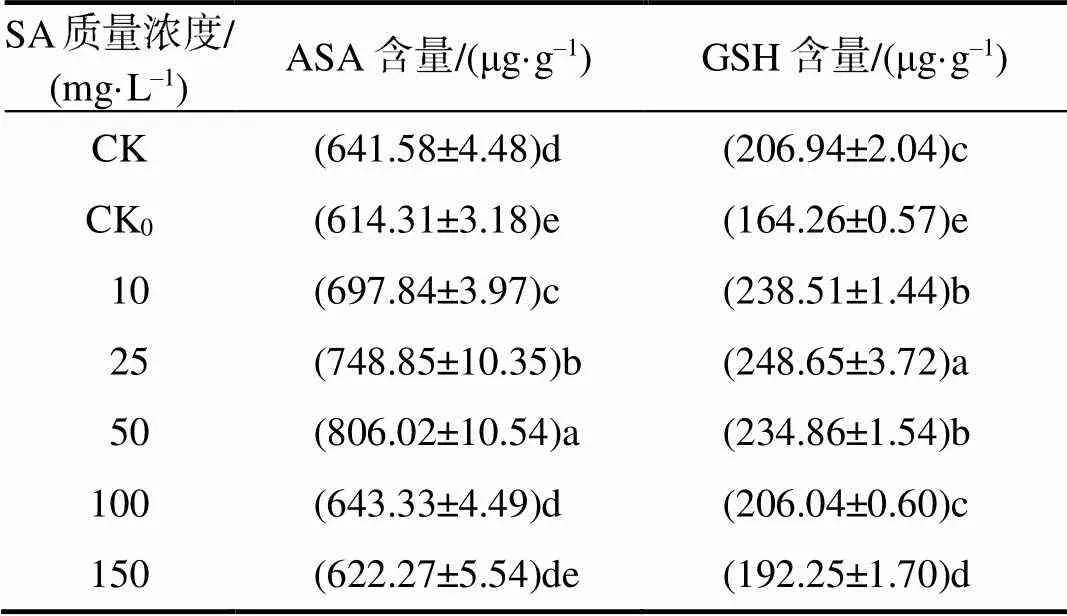
表4 外源水杨酸处理烟草幼苗ASA和GSH含量
2.5 隶属函数综合分析
计算烟叶各项指标的隶属函数值(表5),得到4 ℃胁迫下,0~150 mg/L外源SA处理的各组对低温胁迫的缓解效应,由大到小依次为50 mg/L、25 mg/L、10 mg/L、100 mg/L、150 mg/L、CK0处理,50 mg/L的外源SA处理综合值最高,说明该处理对4 ℃胁迫的K326具有最大缓解效应。
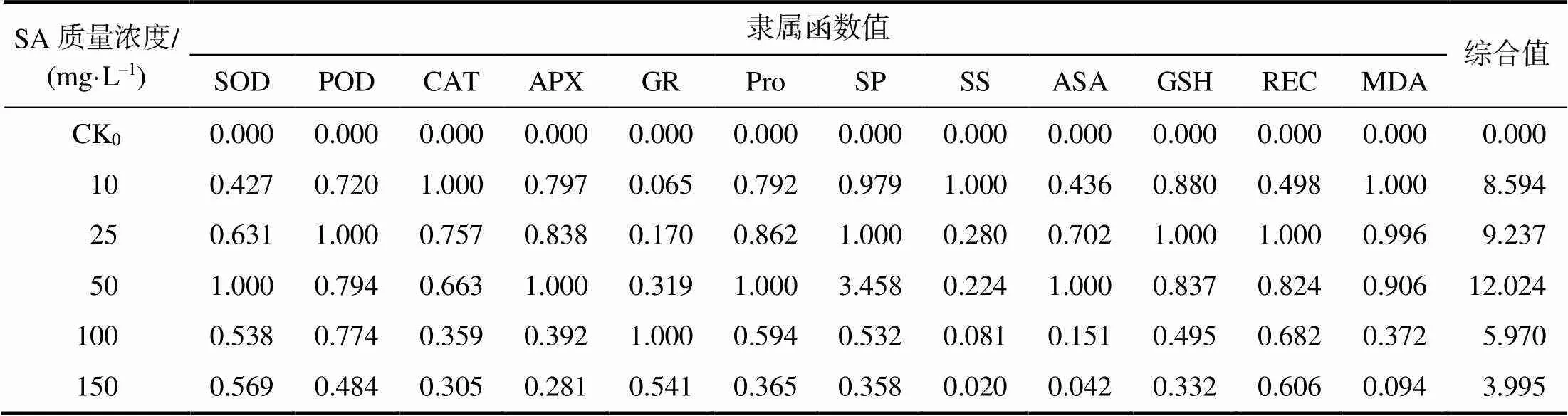
表5 外源SA处理低温胁迫烟苗抗寒指标隶属函数值及综合评价
3 结论与讨论
本研究中,保护性酶(SOD、POD、CAT)在低温胁迫持续4 d且未施用外源SA(CK0)条件下,它们的活性较CK均显著下降,表明K326烟草幼苗的保护酶系统在4 ℃下并不能有效发挥功能,无法通过提高保护性酶活性来降低细胞膜的氧化与过氧化损伤。在设置的5个外源SA浓度下,3种酶活性均有提高,SOD、CAT、POD在各自最适浓度的外源SA作用下,活性最大,能较CK0分别提高30.11%、104.53%、56.05%,这说明适宜浓度的外源SA对提高低温胁迫下的烟草幼苗保护性酶活性有着显著的效果[12],增强植株在低温逆境下清除活性氧自由基的能力,防止膜系统的氧化损伤和过氧化损伤,增强幼苗的抗寒能力,有助于烟草幼苗顺利度过低温逆境,这与刁倩楠等[13]、周丽霞等[14]、陈明辉等[15]的研究结果一致。
APX和GR活性在连续4 d的4 ℃胁迫下均显著下降,与保护性酶的变化趋势一致,此时AsA–GSH 循环受阻碍,会导致清除H2O2等活性氧自由基的效率降低,叶绿体内过量的H2O2无法被有效清除,将引起内膜系统受损,光合效率降低,严重时甚至无法进行光合作用。经过外源SA预处理的烟草幼苗在4 ℃胁迫下,APX和GR均能维持在较高水平,有利于保障AsA–GSH 循环的正常运转,维持叶绿体等SOD、POD、CAT功能发挥不足的细胞器的正常结构,进而正常发挥功能。
烟草幼苗在4 ℃胁迫处理下,可溶性糖、可溶性蛋白和脯氨酸含量较CK均显著上升,说明植株对于低温具有一定的抵抗力,但根施外源SA后,可溶性糖、可溶性蛋白和脯氨酸的含量进一步上升,其中脯氨酸含量增加幅度尤为显著。细胞质中脯氨酸含量的增加,不仅能够调节细胞的渗透势,而且能够很好地保护细胞质中的各种酶;可溶性糖、可溶性蛋白含量的增加,可以维持细胞较低的渗透势,并且可溶性蛋白亲水力较强,可以保证植物在低温逆境下的持水能力[16–17]。
非酶抗氧化剂是植物体内产生的能有效阻止或延缓自动氧化的物质,一方面作为非酶抗氧化剂能在植物遭受逆境胁迫,ROS的产生与降解平衡被打破的情况下,减缓ROS的产生速率或者直接清除过量的ROS;另一方面能提高内源性抗氧化物质的水平或抑制氧化酶的表达,亦或同时执行上述两个功能[18]。ASA和GSH是重要的非酶抗氧化剂。许英等[19]研究发现,ASA 可在逆境胁迫下还原O2–,能有效清除OH–、H2O2等 ROS,GSH因其结构中具有活性的巯基,容易被氧化,因此,在逆境胁迫下,能够减缓膜系统中不饱和脂肪酸及其他部位的氧化分解,防止细胞膜过氧化,从而保持细胞膜系统的稳定,增强植物逆境下的抗性。4 ℃低温胁迫持续4 d后,CK0处理下ASA和GSH含量较常温CK均显著下降,低温逆境下非酶抗氧化剂ASA和GSH含量的降低,致使植株的低温抗性从非酶抗氧化剂处得到的支持减弱,植株对ROS的降解能力相对降低,对氧化酶的表达抑制能力下降,导致植株在低温胁迫下抗氧化能力减弱,抗寒性降低。根施适宜浓度的外源SA能有效提高ASA和GSH的含量,进而增强低温胁迫下烟草植株的抗氧化能力,提升植株对ROS的降解效率以及抑制氧化酶的表达,这与黄志明等[20]在枇杷中的研究结果一致。
本研究中,CK0的烟叶相对电导率和MDA含量较CK均大幅增加,此时,胞内电解质大量外渗,膜系统破损严重,严重时将导致光合磷酸化和氧化磷酸化解偶连,ATP的生成过程受到破坏,代谢紊乱,植株无法正常生长,致使植株死亡[19–20]。由于低温胁迫前,对烟草幼苗进行适宜浓度的外源SA预处理,渗透调节物质可溶性糖、可溶性蛋白和脯氨酸含量显著增加,在维持细胞渗透势的同时,降低冰点,增强细胞的持水能力,其中外源SA作用下产生的大量脯氨酸亦能延缓抗氧化酶的降解,保护性酶活性、非酶抗氧化剂含量和抗氧化酶活性也得到了提升,从而有效降低了低温逆境下烟草幼苗的损伤程度,增强了植株的低温抗性,MDA含量和相对电导率的上升趋势得到有效抑制。
隶属函数法能根据所测定的多个指标,对植物的抗寒能力进行综合全面的评价。对各指标进行隶属函数综合分析的结果表明, 50 mg/L的外源SA处理对4 ℃胁迫下的K326具有最佳缓解效应,能有效抵御低温胁迫对烟株的伤害,有利于烟株顺利度过低温逆境,减少损失。
[1] 方松,刘加红,刘新民,等.烟草漂浮育苗防御倒春寒自动增温措施[J].江苏农业科学,2013,41(3):57–58,407. FANG S,LIU J H,LIU X M,et al.Tobacco floating seedlings to prevent cold spring and automatic temperature increase measures[J].Jiangsu Agricultural Sciences,2013,41(3):57–58,407.
[2] 李琦瑶,陈爱国,王程栋,等.低温胁迫对烤烟幼苗光合荧光特性及叶片结构的影响[J].中国烟草学报,2018,24(2):30–38. LI Q Y,CHEN A G,WANG C D,et al.Effects of low temperature stress on photosynthetic fluorescence characteristics and leaf tissue structure of flue-cured tobacco seedlings[J].Acta Tabacaria Sinica,2018,24(2):30–38.
[3] YADAV S K.Cold stress tolerance mechanisms in plants:a review[J].Agronomy for Sustainable Development,2010,30(3):515–527.
[4] 安飞飞,李庚虎,陈霆,等.低温胁迫对木薯叶片叶绿素荧光参数及PSⅡ相关蛋白表达水平的影响[J].湖南农业大学学报(自然科学版),2014,40(2):148–152. AN F F,LI G H,CHEN T,et al.Influence of low temperature stress on chlorophyll fluorescence parameters and expression levels of proteins in PSⅡof cassava[J]. Journal of Hunan Agricultural University(Natural Sciences),2014,40(2):148–152.
[5] PRADHAN S,GOSWAMI A K,SINGH S K,et al. Physiological and biochemical alterations due to low temperature stress in papaya genotypes[J].Indian Journal ofHorticulture,2017,74(4):491.
[6] AWASTHI R,BHANDARI K,NAYYAR H. Tempera- ture stress and redox homeostasis in agricultural crops[J]. Frontiers in Environmental Science,2015,3(11):24.
[7] 张素勤,耿广东,程智慧.外源水杨酸对茄子抗寒性的影响[J].湖南农业大学学报(自然科学版),2007,33(6):687–689. ZHANG S Q,GENG G D,CHENG Z H.Effects of salicylic acide on chilling-resistance of different eggplant varieties[J].Journal of Hunan Agricultural University (Natural Sciences),2007,33(6):687–689.
[8] IGNATENKO A,TALANOVA V,REPKINA N,et al. Exogenous salicylic acid treatment induces cold tolerance in wheat through promotion of antioxidant enzyme activity and proline accumulation[J].Acta Physiologiae Plantarum ,2019,41(6):80.
[9] MA L F ,HE S L ,LI F R ,et al.Effects imposed by exogenous salicylic acid on the physiological conditions and membrane damage of rhodiola algida seedling under stress of low temperature[J].Oxidation Communications,2016,39(2):1300–1308.
[10] 陈爱葵,韩瑞宏,李东洋,等.植物叶片相对电导率测定方法比较研究[J].广东教育学院学报,2010,30(5):88–91. CHEN A K,HAN R H,LI D Y,et al.A comparison of two methods for electrical conductivity about plant leaves[J]. Journal of Guangdong University of Education Institute,2010,30(5):88–91.
[11] 李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2001:164–169. LI H S.Principles and Techniques of Plant Physiological and Biochemical Experiments[M].Beijing:Higher Education Press,2001:164–169.
[12] 殷全玉,张利军,柯油松,等.水杨酸浸种对低温下烟草种子萌发率和几个与幼苗抗寒性有关的生理生化指标影响[J].植物生理学通讯,2007,43(1):189–190. YIN Q Y,ZHANG L J,KE Y S,et al.Effects of salicylic acid soaking on tobacco seed germination rate and several physiological and biochemical indexes related to cold resistance of seedlings at low temperature[J].Plant Physiology Communications,2007,43(1):189–190.
[13] 刁倩楠,蒋雪君,陈幼源,等.外源水杨酸预处理对低温胁迫下甜瓜幼苗生长及其抗逆生理特性的影响[J].西北植物学报,2018,38(11):2072–2080. DIAO Q N,JIANG X J,CHEN Y Y,et al.Effects of exogenous salicylic acid pretreatment on growth and resistance physiological indexes in melon seedling under chilling stress[J].Acta Botanica Boreali-Occidentalia Sinica,2018,38(11):2072–2080.
[14] 周丽霞,曹红星,肖勇.外源水杨酸对低温胁迫椰子幼苗生理特性的影响[J].南方农业学报,2017,48(11):2039–2045. ZHOU L X,CAO H X,XIAO Y,et al.Effects of exogenous salicylic acid on physiological characteristics ofL.young seedlings under cold stress[J].Journal of Southern Agriculture,2017,48(11):2039–2045.
[15] 陈明辉,程世平,佟伟霜,等.水杨酸对低温胁迫下铁皮石斛幼苗根系活力及抗氧化酶活性的影响[J].北方园艺,2017(22):83–87. CHEN M H,CHENG S P,TONG W S,et al.Effects of SA on root activity and antioxidant enzyme activity of dendrobium officinale seedlings under low temperature stress[J].Northern Horticulture,2017(22):83–87.
[16] 初敏,王秀峰,王淑芬,等.外源SA预处理对低温胁迫下萝卜幼苗的生理效应[J].西北农业学报,2012,21(2):142–145,183. CHU M,WANG X F,WANG S F,et al.Physiological effects of exogenous salicylic acid on radish seedlings under low temperature stress[J].Acta Agriculturae Boreali-occidentalis Sinica,2012,21(2):142–145,183.
[17] 何威.涝胁迫对豫楸1号4种砧木嫁接苗渗透调节物质的影响[J].河南林业科技,2011,31(2):1–3,6. HE W.Physiological response to submergence stress of four kinds of stocks grafted seedlings ofcl. ‘Yu–1’[J].Journal of Henan Forestry Science and Technology,2011,31(2):1–3,6.
[18] 唐功.活性氧·抗氧化酶及抗氧化剂之间关系的探讨[J].安徽农业科学,2010,38(33):18619–18621. TANG G.The discuss on the relationship among reactive oxygen species,antioxidant enzyme and antioxidant[J]. Journal of Anhui Agricultural Sciences,2010,38(33):18619–18621.
[19] 许英,陈建华,朱爱国,等.低温胁迫下植物响应机理的研究进展[J].中国麻业科学,2015,37(1):40–49. XU Y,CHEN J H,ZHU A G,et al.Research progress on response mechanism of plant under low temperature stress[J].Plant Fiber Sciences in China,2015,37(1):40–49.
[20] 黄志明,吴锦程,陈伟健,等.SA对低温胁迫后枇杷幼果AsA–GSH循环酶系统的影响[J].林业科学,2011,47(9):36–42. HUANG Z M,WU J C,CHEN W J ,et al.Effects of SA on enzymes of ascorbate-glutathione cycle in young loquat fruits after low temperature stress[J].Scientia Silvae Sinicae,2011,47(9):36–42.
Mitigative effect of exogenous salicylic acid on low temperature stress in tobacco seedlings
HOU Shuang1, CHEN Jinfen1, LIU Rongrong1, WANG Rui1, CHEN Junhong2, ZOU Congming3*, XIE Xiaoyu1*
(1.College of Agronomy and Biotechnology, Southwest University, Chongqing 400715, China; 2.Honghe Branch of Yunnan Tobacco Company, Mile, Yunnan 661500, China; 3.Yunnan Academy of Tobacco Agricultural Sciences, Kunming, Yunnan 657000,China)
In order to investigate the mitigating effect of exogenous salicylic acid (SA) on flue-cured tobacco under low temperature stress, our experiment used an artificial climate incubator to simulate a low temperature of 4 ℃, and set five mass concentrations of exogenous salicylic acid (SA) (10, 25, 50, 100, 150 mg/L) to pretreat potted K326 tobacco seedlings through roots for 3 consecutive days, followed by low temperature stress treatment for 4 consecutive days. Normal temperature (25 ℃) growth was used as a positive control (CK), and a low temperature of 4 ℃without the application of exogenous SA was performed as a negative control (CK0). The relative electrical conductivity, malondialdehyde (MDA) content, osmotic adjustment substance content, antioxidant enzyme activity and non-enzyme antioxidant content of tobacco leaves were measured. The results showed that the application of exogenous SA could significantly increase the activities of superoxide dismutase (SOD), catalase (CAT) and peroxidase (POD). The enzymes were the most active under 50, 10, 25 mg/L exogenous SA treatment, respectively; the glutathione reductase (GR) and ascorbate peroxidase (APX) activities were increased, and GR and APX activities reached the maximum under the treatment of 100 mg/L and 50 mg/L exogenous SA respectively. Under low temperature stress, the soluble sugar (SS) content of tobacco seedlings was increased by 17.46% compared to CK0under the treatment of 10 mg/L exogenous SA. The contents of soluble protein (SP), proline (Pro), and ascorbic acid (ASA) were the highest at 50 mg/L exogenous, which increased by 30.35%, 316.44% and 31.21% respectively compared with CK0. The content of reduced glutathione (GSH) was significantly increased by 51.38% compared with CK0under 25 mg/L exogenous SA treatment. The improvement of various indicators has alleviated the rise of REC and MDA content under low temperature stress, and cold resistance membership function analysis shows 50mg /L exogenous SA treatment had the greatest alleviation effect on K326 under 4 ℃ low temperature stress.
tobacco; exogenous salicylic acid; low temperature stress; mitigation
10.13,331/j.cnki.jhau.2020.01.003
S572.01
A
1007-1032(2020)01-0014-07
2019–10–18
2019–12–20
云南省烟草专卖局科技计划重点项目(2017yn09)
侯爽(1993—),女,重庆人,硕士研究生,主要从事植物生理与分子生物学研究,hs152012@163.com;
,谢小玉,博士,副教授,主要从事植物生理与分子生物学研究,xiexy8009@163.com;*通信作者,邹聪明,副研究员,主要从事烟叶栽培与调制研究,284630460@qq.com
侯爽,陈锦芬,刘溶荣,王瑞,陈俊鸿,邹聪明,谢小玉.外源水杨酸对烟草幼苗低温胁迫的缓解效应[J].湖南农业大学学报(自然科学版),2020,46(1):14–20.
HOU S, CHEN J F, LIU R R, WANG R, CHENG J H, ZOU C M, XIE X Y. Mitigative effect of exogenous salicylic acid on low temperature stress in tobacco seedlings[J].Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(1):14–20.
http://xb.hunau.edu.cn
责任编辑:罗慧敏
英文编辑:罗维
