L-鼠李树胶糖激酶在D-阿洛酮糖合成中的应用
2020-03-22温俊婷李子杰高晓冬
温俊婷, 李子杰, 高晓冬*
(1. 江南大学 生物工程学院,江苏 无锡214122;2. 江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122)
稀有糖(rare sugar)指自然界中存在但含量极少的一类单糖及其衍生物[1]。 目前已发现34 种稀有糖及糖醇[2],包括D-阿洛酮糖、D-塔格糖、D-阿洛糖等。 稀有糖具有独特的生物活性,可作为添加剂改善食品的理化性质[3],发挥多种生理功能[4-5],因此在食品、保健、医药等领域引起了广泛关注。
D-阿洛酮糖(D-psicose)属于稀有糖中的一种,其甜度为蔗糖的70%, 但能量仅为蔗糖的0.3%,具有低热量的特性,可作为蔗糖的食用性替代物[6-7]。 随着稀有糖研究的不断推进,D-阿洛酮糖受到了广泛的关注,其在医疗、保健方面具有显著功效,如降血糖[8]、降血脂[9],因而非常适用于糖尿病患者的食用[10]。另外,D-阿洛酮糖可以作为肝脂类酶[11]和肠道α-糖苷酶的抑制剂,减少脂肪堆积[12],具有减肥功效。
D-阿洛酮糖在自然界中含量极少,主要存在于小麦、鼠刺植物以及甜菜糖蜜中[13-14]。 目前应用较广泛的合成方法为化学合成法和生物合成法。 相较于化学合成法,生物合成法的优势更为突出,例如反应条件温和、副产物少、利于目的产物的纯化,因此更适合工业化生产[15]。
目前最常见的酶法合成方法是利用D-阿洛酮糖-3-差向异构酶(D-psicose-3-epimerase,DPE)催化D-果糖和D-阿洛酮糖之间的转化[16-17]。 但由于DPE 催化的异构化反应是一个可逆的过程, 所以D-阿洛酮糖的产率较低[18]。 因此,如何提高异构化反应的转化率是生产D-阿洛酮糖所面临的重大挑战。
L-鼠李树胶糖激酶 (L-rhamnulose kinase,RhaB)是己糖激酶-hsp70-超蛋白家族成员[19],其N端结构域是ATP 的结合位点, 可以控制ATP 的结合过程。 RhaB 是一种底物特异性激酶[20],同时也是大肠杆菌体内代谢L-鼠李糖所涉及的关键酶之一[21]。其催化的底物为C3-R 构型的稀有糖,如D-阿洛酮糖。 它的催化机制为: 将D-阿洛酮糖磷酸化生成D-阿洛酮糖-1-磷酸,同时消耗一分子ATP,生成对应的ADP。由于RhaB 催化的反应为不可逆过程,因此将异构酶DPE 与RhaB 串联,可以破坏异构化反应的平衡,从而提高D-阿洛酮糖的产率,有利于工业化生产。
多聚磷酸盐激酶(polyphosphate kinase,PPK)分为2 种:多聚磷酸盐激酶1(PPK1)和多聚磷酸盐激酶2 (PPK2), 其中PPK1 主要负责多聚磷酸盐(polyphosphate,polyP)的合成以及ATP 的代谢(合成)[22],参与的酶促反应为:

PPK2 主要负责GTP 的代谢, 大肠杆菌中只有PPK1,不存在PPK2[23]。 由于PPK1 催化的反应为可逆过程,当ATP / ADP 值偏低时,PPK1 可催化ADP转化为ATP[24]。因此,本文中主要利用大肠杆菌来源的PPK1 参与的ATP 再生过程,以减少反应中ATP的用量和ADP 的积累, 从而降低合成D-阿洛酮糖的成本。
本研究中将重组蛋白RhaB 在大肠杆菌中大量表达,以D-阿洛酮糖为底物,研究RhaB 的酶学性质,并对纯酶RhaB 的反应条件进行优化。 同时,将梭状芽孢杆菌(Clostridium cellulolyticumH10)来源的DPE 和大肠杆菌来源的RhaB 酶偶联,以D-果糖为底物,优化偶联体系的反应条件,计算反应的转化率。 最后,将DPE、RhaB 和PPK(E. coli)三酶偶联,降低ATP 的用量,合成D-阿洛酮糖。
1 材料与方法
1.1 试验材料
1.1.1 质粒和菌株 pET-28a 质粒: 购于Novagen公司;pET28a-rhaB、pET28a-ppk: 作者所在实验室构建;大肠杆菌MG1655 和Rosetta (DE3):作者所在实验室保存;pET28a-dpe: 作者所在实验室前期构建的质粒。
1.1.2 酶、 试剂及耗材 限制性内切酶和DNA 连接酶:购于TaKaRa 生物公司;腺苷-5′-三磷酸二钠盐(ATP)和多聚磷酸盐(polyphosphate,polyP):购于上海生工生物公司;卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)、酸性磷酸酶(acid phosphatase from sweet potato,AP): 购于Sigma-Aldrich 公司;Ni2+亲和层析柱:购于GE 公司;D-果糖:购于阿拉丁有限公司;D-阿洛酮糖:购于TCI(上海)化成工业发展有限公司;C18色谱柱(250 mm×4.6 mm)和Sugar-PakTM色谱分析柱(300 mm×6.5 mm):购于Waters 公司。
1.1.3 培养基及其他溶液配制 TB 培养基: 酵母抽提物(24 g/L),胰蛋白胨(12 g/L),K2HPO4·3H2O(16.4 g/L),KH2PO4(2.31 g/L),甘油体积分数0.4%。LB 固体培养基:胰蛋白胨(10 g/L),酵母抽提物(5 g/L),NaCl (10 g/L),琼脂粉(20 g/L);湿热灭菌121 ℃,20 min。
蛋白质纯化缓冲液:1) 裂解、 平衡缓冲液:25 mmol/L Tris-HCl( pH 8.0),150 mmol/L NaCl;洗涤缓冲液:25 mmol/L Tris-HCl (pH 8.0),150 mmol/L NaCl,60 mmol/L imidazole;2)洗脱缓冲液:25 mmol/L Tris-HCl (pH 8.0),150 mmol/L NaCl,500 mmol/L imidazole;3) 脱盐缓冲液:25 mmol/L Tris-HCl (pH 8.0),50 mmol/L NaCl。
1.2 仪器与设备
PCR 分析仪:Eppendorf 公司产品;Bio-Rad Power/PAC300 电泳仪:美国伯乐公司产品;高效液相色谱仪HPLC:日本日立公司产品;超声波细胞粉碎机:南京新辰生物科技有限公司产品。
1.3 实验方法
1.3.1 重组质粒的构建 采用PrimeSTAR 聚合酶进行PCR 时, 以大肠杆菌BL21 菌液为模板,以rhaB-F:5′-GCGCGGATCCATGACCTTTCGCAATTG TGTC-3′(BamH I)为上游引物,以rhaB-R:5′- GCG CAAGCTTTCATGCGCAAAGCTCCTTTGT -3′ (Hind III)为下游引物来扩增rhaB基因。 采用BamH I 和Hind III 2 种限制性内切酶分别对pET-28a 和rhaB基因进行双酶切处理,37 ℃静置3 h。 反应结束后,对酶切产物进行胶回收,并用DNA 连接酶ligationmix 将基因片段和质粒片段进行连接,16 ℃静置2 h。将连接产物转入大肠杆菌感受态,冰浴25 min,42 ℃热激40 s,冰上放置3 min。将转化产物涂布于带有卡那霉素抗性的平板进行筛选,挑取转化子进行菌落PCR 鉴定,并进行质粒提取、酶切验证和基因测序, 从而得到正确编码的表达载体pET28arhaB。 pET28a-dpe为作者所在实验室前期构建的质粒。 pET28a-ppk的构建方法同上。
1.3.2 重组蛋白在大肠杆菌中的诱导表达 将重组质粒pET28a-rhaB转入大肠杆菌Rosetta(DE3)中,转化步骤同上,涂布到LB-Kan 平板上,37 ℃过夜培养,挑取正确的转化子在5 mL LB-Kan 培养基中37 ℃过夜培养后,取500 μL 培养基,离心收集菌体作为诱导前样品, 另取2 mL 转接入200 mL TB-Kan 培 养 基 中,37 ℃摇 床 培 养3 ~4 h,待OD600为0.6~0.8 时,加入IPTG 诱导(终浓度0.1 mmol/L),16 ℃诱导20 h,取500 μL 培养基,离心收集菌体作为诱导后样品, 另取5 mL 菌体超声破碎离心, 分别取上清液和沉淀用于SDS-PAGE 检测。剩余培养基收集菌体,-20 ℃保存待用。
1.3.3 重组蛋白的分离纯化及脱盐 菌体收集后,平衡缓冲液清洗2 遍,用10 mL 平衡缓冲液充分悬浮菌体,超声破碎,4 ℃下超声5 s 间歇5 s,超声时间共为30 min。 结束后12 000g离心30 min,收集上清液,用于蛋白质纯化。 破碎上清液中存在大量杂蛋白质,采用Ni2+亲和层析柱对其进行纯化,可以得到高浓度、纯净的目的蛋白。 蛋白质纯化步骤如下:取30 mL 去离子水清洗Ni2+亲和层析柱,约6 个柱体积;10 mL 0.1 mol/L NiSO4再生柱子,去离子水洗掉柱子中多余Ni2+;20 mL 平衡缓冲液平衡Ni2+亲和层析柱,约4 个柱体积;缓慢上样,使上清液中蛋白质与Ni2+柱充分结合; 取20 mL 平衡缓冲液再次平衡Ni2+亲和层析柱, 洗掉未结合的蛋白质;20 mL洗涤缓冲液平衡Ni2+亲和层析柱, 利用低浓度咪唑洗掉与Ni2+柱结合较弱的杂蛋白质;20 mL 洗脱缓冲液平衡Ni2+亲和层析柱, 利用高浓度咪唑洗脱并收集与Ni2+柱结合较强的目的蛋白;20 mL 0.1 mol/L EDTA 洗掉Ni2+; 最后20 mL 0.1mol/L NaOH 保存柱子。
由于最后收集到的洗脱液里含有高浓度的咪唑和NaCl,为避免其影响后续反应,需要进行脱盐处理。 纯化后的蛋白质经由超滤管进行浓缩,4 ℃下,4 000g离心30 min,并换用脱盐缓冲液以降低蛋白质中的盐浓度。 最后,利用BCA 蛋白质浓度检测试剂盒精确检测目的蛋白浓度, 分装后加入甘油,-80 ℃长期保存。 DPE、PPK 的表达纯化步骤与RhaB 一致。
1.3.4 重组蛋白RhaB 活性测定方法 检测RhaB的活性反应条件 (250 μL 反应体系) 如下: 在50 mmol/L Tris-HCl (pH 8.0)缓冲液中,加入D-阿洛酮糖5 g/L,5 mmol/L Mg2+,30 mmol/L ATP,0.2 g/L RhaB,在35 ℃反应30 min 后,用高浓度NaOH 调pH, 终止反应。 15 000g离心10 min, 上清液过0.22 μm 的水膜除去杂质, 通过高效液相色谱(HPLC)检测是否有产物的产生。 利用色谱柱C18来测定反应液中ATP 和ADP 的含量。 HPLC 工作条件:0.1 mol/L KH2PO4(pH 6.25)作为流动相,流速1 mL/min,柱温箱温度25 ℃,用紫外检测器进行检测(λ=254 nm)。
1.3.5 DPE 和RhaB 偶联体系的活性测定方法 检测DPE 和RhaB 偶联体系的活性反应条件(250 μL反应体系)如下:在50 mmol/L Tris-HCl (pH 8.0)缓冲液中, 加入D-果糖5 g/L,Mg2+5 mmol/L,ATP 30 mmol/L,DPE 0.2 g/L,RhaB 0.4 g/L,在35 ℃反应30 min 后,100 ℃灭活10 min,15 000g离心取上清液, 将pH 值调为5.0 左右, 外加酸性磷酸酶AP(0.8 μL)处理,30 ℃静置过夜。 反应结束后,将pH值调回7.0 左右,100 ℃加热10 min, 终止反应。15 000g离心,上清液过0.22 μm 的水膜除去杂质,利用Sugar-PakTM色谱分析柱来检测产物D-阿洛酮糖的生成量。 HPLC 工作条件: 流动相为500 mg/L EDTA 钙盐,其流速为0.5 mL/min,柱温80 ℃,RI 示差检测器。
1.3.6 DPE、RhaB 和PPK 偶联体系的活性测定方法 检测DPE、RhaB 和PPK 偶联体系的活性反应条件(250 μL 反应体系)如下:在50 mmol/L Tris-HCl (pH 8.0)缓冲液中,加入D-果糖5 g/L,Mg2+5 mmol/L,ATP 6 mmol/L,polyphosphate 6 mmol/L,DPE 0.2 g/L,RhaB 0.4 g/L,PPK 0.4 g/L, 在35 ℃反应1 h 后,后续步骤参照1.3.5。
1.3.7 重组蛋白RhaB 反应条件的优化 温度和pH 对RhaB 活性的影响均以1.3.4 中所提到的反应体系为基础,反应时间均为30 min。 相对酶活定义为各组样品转化率相对于最高转化率所占的百分比。为了测定温度对RhaB 活性的影响,以50 mmol/L Tris-HCl (pH 8.0)作为缓冲液,采用不同温度(10~70 ℃) 测定RhaB 的酶活。 为了测定不同pH 对RhaB 活性的影响,采用3 种不同缓冲液测定酶活,pH 5.0~7.0 为磷酸缓冲液,pH 7.0~9.0 为Tris-HCl缓冲液,pH 9.0~11.0 为Glycine-NaOH 缓冲液。
1.3.8 DPE 和RhaB 偶联体系的条件优化 为了测定温度对偶联体系活性的影响, 反应体系参照1.3.5。采用不同温度(10~70 ℃)测定酶活,反应时间为30 min。 为了测定不同pH 对偶联体系活性的影响,采用3 种不同缓冲液测定酶活,pH 5.0~7.0 为磷酸缓冲液,pH 7.0~9.0 为Tris-HCl 缓冲液,pH 9.0~11.0 为Glycine-NaOH 缓冲液。 为了测定金属离子对偶联体系活性的影响,选取Mg2+、Ca2+以及Mn2+等8 种离子测定酶活。 为了测定DPE 和RhaB 酶比例对偶联体系活性的影响, 采用不同的酶质量比(1∶4、1∶2、1∶1、2∶1、4∶1)测定酶活,其他条件不变。
2 结果与讨论
2.1 RhaB 和DPE 在大肠杆菌中的表达
根据大肠杆菌来源的rhaB基因的理论碱基序列长度,软件预测出其蛋白质相对分子质量为5.3×104。SDS-PAGE(见图1(a))显示,经IPTG 诱导20 h后, 样品在5.0×104~7.0×104之间有清晰的目的条带,相对分子质量在5.3×104左右,与预测大小基本一致。 同时,RhaB 蛋白质大量表达在上清液中,经Ni2+亲和层析柱纯化后可得到纯度较高的目的蛋白。同理,DPE 的相对分子质量大小为3.4×104,与理论值吻合(见图1(b))。

图1 SDS-PAGE 检测RhaB 和DPE 的表达Fig. 1 SDS-PAGE analysis of RhaB and DPE expression
2.2 RhaB 的酶活性分析
RhaB 磷酸化D-阿洛酮糖生成D-阿洛酮糖-1-磷酸,后者是一种比较昂贵的磷酸化单糖,目前在市场上难以获得,因此本研究中通过检测另一副产物ADP 的生成来验证RhaB 酶活性。由图2 可知,反应初始,体系中仅含有ATP;反应30 min 后,ATP 的峰值降低,ADP 的峰生成, 加入脱磷酸酶AP 后,ATP 和ADP 的峰均消失。 由此说明RhaB 的确催化D-阿洛酮糖生成D-阿洛酮糖-1-磷酸, 并将ATP转化成ADP。

图2 HPLC 检测RhaB 的活性Fig. 2 Activity of RhaB detected by HPLC
2.3 温度、pH 对RhaB 活性的影响
研究温度、pH 对RhaB 活性的影响, 如图3(a)所示,当温度为35 ℃时,RhaB 活性最高,且耐受温度范围较广;在10 ℃时,活性仍可达到60%以上,在60 ℃的高温下仍保有80%左右的酶活;但当温度高于70 ℃时,酶活逐渐丧失。 根据报道,来自海栖热袍菌MSB8(Thermotoga maritimaMSB8)的RhaB最适反应pH 值为8.0[25]。 由图3(b)可知,来自大肠杆菌的RhaB 最适pH 值为8.0,且该酶在弱酸或弱碱下,仍保有50%以上的酶活。

图3 温度、pH 对RhaB 活性的影响Fig. 3 Effect of temperature and pH on RhaB activity

图4 温度、pH 对DPE 和RhaB 偶联体系活性的影响Fig. 4 Effect of temperature and pH on the activity of DPE and RhaB
2.4 温度、pH 对DPE 和RhaB 偶联体系活性的影响
由2.3 可知,RhaB 酶的最适温度为35 ℃,而文献报道DPE 酶的最适温度为55 ℃,二者相差较大,因此需要确定偶联体系的最适反应温度。如图4(a)所示,偶联体系在35 ℃时拥有最高酶活,温度继续升高后,酶活逐渐下降。 另外,RhaB 和DPE 对外界温度的变化均有较强的适应性, 在10~70 ℃范围内,酶活可以保持在51%以上。 由图4(b)可知,当pH 值为8.5 时,整个体系的酶活性最高;当pH 偏酸性时,酶活性迅速降低,仅有10%;当外界环境偏碱性时,酶活趋势稍有下降,但仍保持在50%以上。 因此,该反应更适合于在碱性环境下进行。
2.5 金属离子、酶质量比对DPE 和RhaB 偶联体系活性的影响
由文献报道可知,DPE 是Co2+依赖型酶,而RhaB 是一种激酶, 因此需要研究金属离子对偶联体系酶活的影响。 如图5(a)所示,Co2+存在条件下,反应的转化率最高,其次是Mg2+和Mn2+;相比于不加金属离子,多数离子显著提高了酶活,但Cu2+却使酶活降低。考虑到Co2+属于工业重金属离子,本实验选择Mg2+加入反应体系中。 如图5(b)所示,当DPE和RhaB 的质量比为1∶2 时,该体系的转化率最高,可达70%;随着DPE 所占比例的提高,反应的转化率逐渐降低。 因此,RhaB 的酶质量应为DPE 的2 倍。
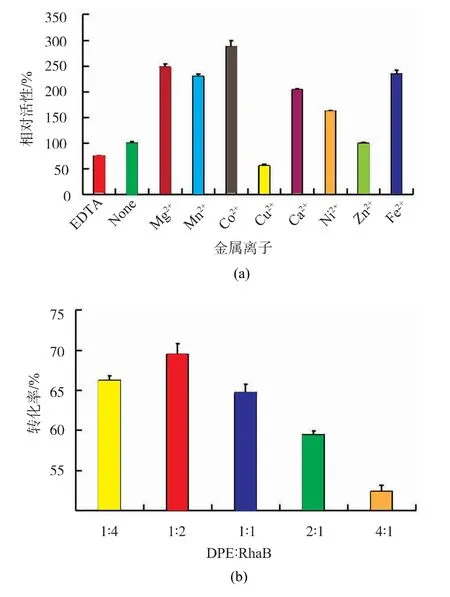
图5 各种金属离子、酶质量比对DPE 和RhaB 偶联体系活性的影响Fig. 5 Effect of various metal ions and enzyme ratios on the activity of DPE and RhaB
2.6 DPE 和RhaB 偶联体系的活性
本实验在上述最适条件下,以D-果糖为底物,在DPE 和RhaB 共同催化下合成D-阿洛酮糖-1-磷酸,外加酸性磷酸酶AP 处理后,可得到产物D-阿洛酮糖, 利用Sugar-PakTM色谱分析柱检测D-阿洛酮糖的生成,如图6 所示,D-果糖和D-阿洛酮糖的出峰时间分别为11.6 min 和16.1 min。 根据HPLC 结果计算可得: 偶联体系的反应转化率约为70%,该体系显著提高了D-阿洛酮糖的得率。
2.7 PPK 在大肠杆菌中的表达
根据大肠杆菌来源的ppk基因的理论碱基序列长度, 软件预测出其蛋白质相对分子质量为8.0×104。 SDS-PAGE(见图7)显示,相对分子质量在8.0×104左右,与预测大小基本一致。同时,PPK 蛋白质大量表达在上清液中,纯化后所得目的蛋白质较少,再对蛋白质进行浓缩除盐,结果发现PPK 的蛋白质质量明显增多,但同时含有一定量的杂蛋白质。

图7 SDS-PAGE 检测PPK 的表达Fig. 7 SDS-PAGE analysis of PPK expression
2.8 DPE、RhaB 和PPK 偶联体系的活性
本实验在上述反应条件的基础上, 以D-果糖为底物, 同时将ATP 用量降低至原来的1/5,在DPE、RhaB 和PPK 共同催化下合成D-阿洛酮糖-1-磷酸,外加酸性磷酸酶AP 处理后,可得到产物D-阿洛酮糖, 利用Sugar-PakTM色谱分析柱检测D-阿洛酮糖的生成,如图8 所示,其中,图8(a)对照组为DPE 和RhaB 双酶混合, 图8 (b) 实验组为DPE、RhaB 和PPK 三酶混合。 根据HPLC 结果计算可得,在降低ATP 用量的条件下,双酶体系的转化率仅有27%,而三酶偶联体系的反应转化率可达到50%,因此,该体系显著提高了D-阿洛酮糖的得率。

图8 HPLC 分析DPE、RhaB 和PPK 偶联体系的活性Fig. 8 Activity of DPE,RhaB and PPK detected by HPLC
3 结 语
D-阿洛酮糖是一种功能性稀有糖,具有多种生理活性, 市场价格较高。 其合成方法主要为利用DPE 催化D-果糖直接转化为D-阿洛酮糖,但此反应为可逆过程,转化率较低。 本研究将DPE 催化的异构化反应与RhaB 参与的磷酸化反应串联, 借助后者的不可逆过程打破前者存在的可逆平衡,促进D-阿洛酮糖的合成,最终偶联体系的转化率可达到70%。在上述研究的基础上,构建DPE、RhaB 和PPK偶联体系,使得ATP 得以循环利用,同时减少体系中ADP 的积累。 结果表明,ATP 的用量降低至原来的1/5,同时最终产物得率为50%。 相比于双酶偶联体系,引入PPK 酶后,ATP 用量明显减少,反应转化率有所降低,原因可能是由于PPK 酶的纯度影响了产物的合成。 因此,在后期研究中,可考虑换用其他方法对PPK 进行纯化,以提高其纯度。综上所述,此法显著提高了D-阿洛酮糖的产率, 适用于稀有糖的大规模合成。 同时,建立的DPE、RhaB 和PPK 三酶偶联体系可应用于全细胞体系中,从而简化整个生产流程,具有实际应用意义。
