苍术挥发油杀菌活性评价及抑菌机制
2020-03-22蒋圆婷靳羽含赵晨宇刘艳丽梁寒峭马国需
王 喆, 蒋圆婷, 靳羽含, 赵晨宇, 刘艳丽, 梁寒峭*, 马国需
(1. 北京城市学院 生物医药学部, 北京100094;2. 中国医学科学院北京协和医学院 药用植物研究所, 北京100093)
苍术为菊科植物茅苍术Atractylodes lancea(Thunb.) DC. 或北苍术Atractylodes chinensis(DC.)Koidz.的干燥根茎。 味辛、苦,性温,入脾、胃、肝经,具有燥湿健脾、祛风散寒、明目之功[1]。 苍术作为常用中药在我国拥有2000 多年的应用历史, 最早记载于《神农本草经》,被列为上品。 《本草备要》记载其有辟秽之功。 《名医别录》中记载运用含有苍术的复方,来治疗皮肤瘙痒,达到止痒效果[2]。 经过现代科学研究证明, 苍术的主要杀菌活性成分为挥发油,其中包括苍术素(atractylodin)、茅术醇(hinesol)、苍术酮(atractylone)、核桉油醇(eudesmol)等[3]。 大量研究表明,苍术挥发油具有较强的抗菌活性,对大肠埃希氏菌、酵母、金黄色葡萄球菌、枯草芽孢杆菌等临床常见致病菌具有良好的抑制作用,且抑菌效果与挥发油浓度正相关,挥发油中的苍术素比苍术酮具有更强的抑菌活性[4]。 本研究中对苍术挥发油的体外杀菌活性进行实验,以常见的大肠埃希氏菌、金黄色葡萄球菌、白假丝酵母作为供试菌,从药物对菌体生长的影响、AKP 的含量变化、胞外大分子物质蛋白质含量的测定等多个方面阐述苍术挥发油对供试菌的作用机制,从而为拓展中药苍术的开发利用提供理论依据。
1 仪器与材料
1.1 仪器
BSA2202S 电子天平:德国Sartorius 公司产品;DNP-9052BS-Ⅲ恒温培养箱: 上海新苗公司产品;分光光度计:Spectrum 公司产品;ZWYR-2102C 恒温培养摇床: 上海智城公司产品;SW-CJIF 超净工作台:天津市中环实验电炉有限公司产品;立式压力蒸汽灭菌器:上海博迅公司产品;麦氏比浊管:广东环凯微生物科技有限公司产品。
1.2 药材
苍术饮片(批号20180403):产地河南信阳。
1.3 试剂
碱性磷酸酶试剂盒(批号20181228):南京建成生物工程研究所提供;甘氨酸(批号080702):上海康达氨基酸厂制造; 吐温-80 (批号2017052):Biotopped 公司产品;酵母浸粉(批号20130728):北京奥博星生物技术有限责任公司产品; 胰蛋白胨(批号20181022):北京奥博星生物技术有限责任公司产品;蛋白胨(批号20170306):北京奥博星生物技术有限责任公司产品;牛肉膏(批号20150102):北京奥博星生物技术有限责任公司产品; 葡萄糖(批号20160828):北京化工厂制造;十二烷基硫酸钠(档案编号069709005200):山东优索化工科技有限公司产品;琼脂粉、氯化钠(批号20140623):北京化工厂制造;磷酸二氢钾(分析纯):北京化工厂制造;氢氧化钠(分析纯):北京化工厂制造。
1.4 指示菌和培养基
CICC 21530 大肠埃希氏菌Escherichia coliEHECO157:H7、CICC 21600 金黄色葡萄球菌Staphylococcus aureus:胰酪大豆胨琼脂斜面培养基(TSA);CICC 32380 白假丝酵母Candida albicans:沙氏琼脂斜面培养基(SDA)。
2 实验方法
2.1 苍术挥发油的制备
研究发现,水蒸气蒸馏法提取的苍术挥发油对各供试菌体的抑制作用要强于微波萃取法和索氏提取法[6]。 本实验结合前期考察的挥发油提取方法,将苍术饮片粉碎为干粉, 装入盛有10 倍量水的水蒸气蒸馏提取器中,温度控制在100 ℃左右,6 h 后提取器支管中流出的液体变为无色, 随即停止提取。 用分液漏斗分离去除下部蒸馏水,上部棕黄色液体即为苍术挥发油粗提物,于4 ℃冰箱中密封保存[5]。
2.2 抑菌活性研究
2.2.1 平板的制备 指示菌平板分上下两层。 先加入8 mL 琼脂培养基作为下层培养基, 待培养基完全凝固后,在其上摆放4~6 只牛津杯,再加入20 mL相应培养基。 待上层培养基完全凝固后,将牛津杯取出。
2.2.2 抑菌实验 用新鲜培养的指示菌株菌悬液,调至菌液浓度0.5 McFarland,均匀涂布在双层平板上,孔内加入100 μL 的样品、阴性对照(100 μL 新鲜培养基)和阳性对照(阿莫西林溶液),置于4 ℃冰箱4 h 后,放置在37 ℃的环境中培养24 h(或28 ℃培养48 h),观测抑菌圈形成情况,使用游标卡尺精密测量抑菌圈的外径d(cm),以反映抑菌活性强弱。
制备含挥发油提取物的培养基平皿:将挥发油提取物用DMSO 稀释,每一菌株制备7 个系列质量分数。 将不同质量分数的试液分别定量地加到热溶解后的相应培养基中,混匀,制成分别含挥发油提取物 (质量分数)0.01%、0.025%、0.05%、0.10%、0.25%、0.50%、1.0%共7 个不同的平皿。
用新鲜培养的指示菌株将菌悬液浓度调至0.5 McFarland,而后均匀涂布在上述平板上,放置相应温度下培养24 h, 观察各平皿的菌落生长情况,确定出挥发油提取物的最小抑菌浓度(MIC)[7-8]。
2.3 悬液定量杀菌实验
2.3.1 挥发油溶液的配制 分别取苍术挥发油纯品和醇提物与无水乙醇混溶,分别制成含挥发油质量分数25%和2.5%的溶液, 醇提物质量分数10%和1%的溶液,备用。
2.3.2 菌悬液制备 将各实验菌经过分离培养,选取单个典型菌落, 白假丝酵母接种于SDA 培养基,大肠埃希氏菌、 金黄色葡萄球菌接种于TSA 培养基,培养24 h,用磷酸盐缓冲液洗下斜面培养物,经充分混匀, 稀释配制成实验菌悬液, 含菌量为1×107~5×107CFU/mL[9]。
2.3.3 中和剂的制备及选择 中和剂的制备:准确量取0.68 g 磷酸二氢钾、1.415 g 无水磷酸氢二钠,加水稀释至1 000 mL,配制成磷酸盐缓冲液。 准确称量甘氨酸、吐温-80,按实验需要,配制成含0.5 g/dL甘氨酸,3 g/dL 吐温-80 的磷酸盐缓冲液[10]。
实验菌为金黄色葡萄球菌、大肠埃希氏菌和白假丝酵母,设计6 组实验,按悬液定量杀菌实验程序进行中和剂选择实验[11-12]。 当第6 组不长菌,第3—5 组组间菌数差不超过10%,第1 组不长菌或菌数远少于第2 组,第2 组菌数超过100 CFU/mL 时,连续3 次重复实验结果一致,表明所试中和剂及其浓度适宜。
2.3.4 悬液定量杀菌实验 实验在20 ℃条件下进行, 用质量分数3%DMSO 将各苍术挥发油乙醇溶液溶解,再用无菌蒸馏水稀释成实验浓度。 在无菌试管内加入0.5 mL 菌悬液与4 mL 不同浓度的苍术挥发油溶液以及0.5 mL 硬水混匀,作用至规定时间,吸取0.5 mL 反应液,加入4.5 mL 中和剂,混匀。中和作用10 min,取混合后的样液1 mL 接种培养,接种于事先准备好的营养培养皿上,放入37 ℃的恒温培养箱内进行培养,48 h 后对菌落数进行统计[11]。
制剂溶剂对照实验是将0.5 mL 菌悬液与4 mL稀释液及0.5 mL 硬水混匀,作用10 min 后,按上述程序进行活菌计数,计算平均杀灭率。
阳性对照实验是将0.5 mL 菌悬液与4 mL 阿莫西林或氟康唑溶液及0.5 mL 硬水混匀,作用10 min后,按上述程序进行活菌计数,计算平均杀灭率。
2.4 抑菌机制研究
2.4.1 对菌体生长曲线的影响 分别将不同浓度的苍术挥发油溶液加入菌悬液中,使得挥发油终质量分数分别为0.5%、1.0%、2.0%,菌体浓度为1×107CFU/mL 的NB 培养基,对照组加灭菌双蒸水,将以上培养基放入恒温培养箱,37 ℃、120 r/min 的摇床中培养12 h,每隔1 h 取样,于600 nm 处测定吸光度[13]。
2.4.2 对菌体细胞壁的影响 分别将不同浓度的苍术挥发油溶液加入菌悬液中,挥发油终质量分数分别为0.5%、1.0%、2.0%, 菌体浓度为1×107CFU/mL 的NB 培养基,对照组加灭菌双蒸水;将以上培养基置于恒温培养箱,37 ℃、120 r/min 的摇床中培养,定时于0、1、2、3、4、5、6、7、8 h 取样,离心10 min,速度4 000 r/min,吸取上清液按照试剂盒方法测定碱性磷酸酶(AKP)的含量变化。 每个样品平行实验3 次,取平均值[13-15]。
2.4.3 对菌体可溶性蛋白质泄露量的影响 分别将不同浓度的苍术挥发油加入菌悬液中,使得挥发油终质量分数分别为0.5%、1.0%、2.0%, 菌体浓度为1×107CFU/mL 的NB 培养基,对照组加灭菌双蒸水,将以上培养基放入恒温培养箱,37 ℃、120 r/min 的摇床中培养。 分别于0、1、2、3、4、5、6、7、8 h 定时取样,蛋白质含量按照Bradford 的方法进行。 每个样品平行实验3 次,取平均值[15-16]。
3 结果与分析
3.1 苍术挥发油抑菌活性
3.1.1 不同提取溶剂对提取物抑菌效果 实验结果可知,质量分数为2.5%和25%苍术蒸馏提取的挥发油具有抑菌效果,随着质量分数的增加对菌体的抑制作用随之增加。 苍术醇提物无抑菌效果,助溶剂无抑菌效果。 阳性对照对细菌有抑制效果,对白假丝酵母无抑菌效果,见表1。
3.1.2 不同质量分数苍术挥发油抑菌效果 苍术挥发油提取物对白假丝酵母的抑制活性最强,MIC值为0.5%;对金黄色葡萄球菌和大肠埃希氏菌抑制活性较弱,MIC 值均为1.0%。 见表2。
3.2 苍术挥发油杀菌活性
3.2.1 中和剂选择实验 实验结果表明,以含5 g/L甘氨酸、30 g/L 吐温-80 的磷酸盐缓冲液组成的中和剂, 可有效中和苍术挥发油抑菌液残余抑菌作用,且中和剂及其中和产物对实验菌和培养基无影响,结果见表3。 中和剂选择含0.5 g/dL 甘氨酸,3 g/dL 吐温-80 的磷酸盐缓冲液符合要求。
3.2.2 悬液定量杀菌实验 实验结果表明,苍术挥发油质量分数为0.5%时对大肠埃希氏菌具有一定抑制效果,对白假丝酵母和金黄色葡萄球菌的抑制质量分数均大于2%。 单方使用抑菌效果有限,由于受到苍术挥发油溶解性的影响, 当质量分数大于2%时,会产生分层现象,影响产品稳定性和抑菌效果。 结果见表4。

表1 苍术挥发油的抑菌实验Table 1 Bacteriostasis experiment of volatile oil of Atractylodes chinensis

表2 挥发油的最小抑菌浓度Table 2 Minimum bacteriostatic concentration of volatile oil
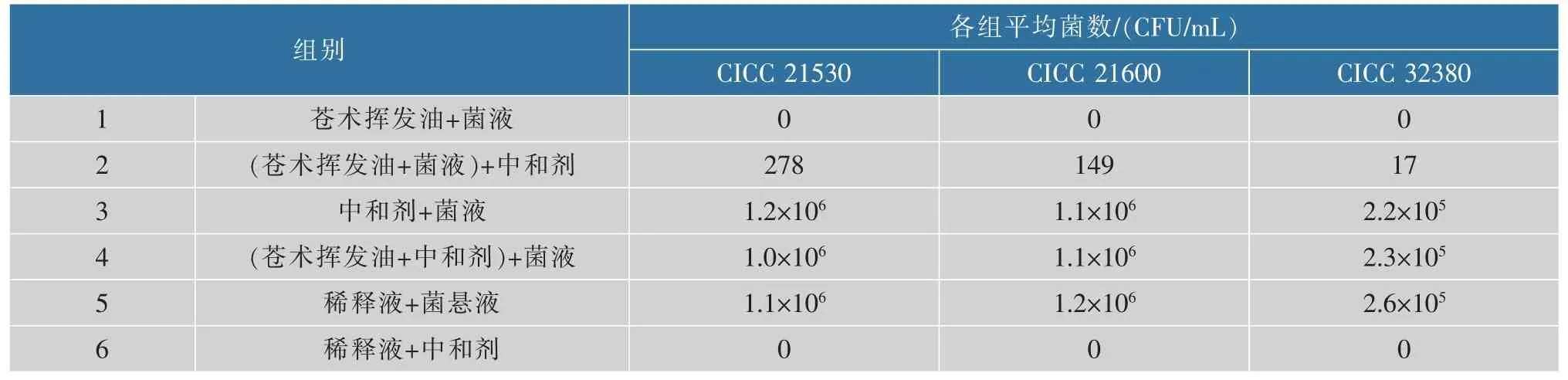
表3 苍术挥发油中和剂实验结果Table 3 Experimental results of volatile oil neutralizer in traditional Chinese medicine

表4 苍术挥发油杀菌效果Table 4 Germicidal effect of volatile oil of Atractylodes chinensis
3.3 苍术挥发油抑菌机制实验
3.3.1 苍术挥发油对菌体生长曲线的影响 由图1—3 可见,各菌体经过苍术挥发油处理后生长趋势与阴性对照组相比变化明显,且苍术挥发油质量分数越大对生长曲线的影响也越大。 在12 h 内,阴性对照组菌体数量呈现增加趋势,中低剂量样品溶液吸光度虽略有增加, 但总体水平低于阴性对照组,说明菌体的繁殖受到一定程度的抑制;而当苍术挥发油质量分数增加到2%时,12 h 反应结果与初始质量分数基本保持一致, 始终维持于0 点附近,表明苍术挥发油对于各菌体均具有抑制作用,抑菌活性强弱与挥发油质量分数呈正相关。

图1 不同质量分数苍术挥发油对大肠埃希氏菌生长曲线的影响Fig. 1 Effect of different volatile oil concentrations of Atractylodes chinensis on the growth curve of Escherichia coli

图2 不同质量分数苍术挥发油对金黄色葡萄球菌生长曲线的影响Fig. 2 Effect of different volatile oil concentrations of Atractylodes chinensis on the growth curve of Staphylococcus aureus

图3 不同质量分数苍术挥发油对白假丝酵母生长曲线的影响Fig. 3 Effect of different volatile oil concentrations of Atractylodes chinensis on the growth curve of Candida albicans
3.3.2 苍术挥发油对菌体细胞壁的影响 碱性磷酸酶是存在于细胞膜与细胞壁之间的一种酶,在正常情况下细胞外很难检测到它的含量。 当细胞膜或细胞壁被破坏后,细胞通透性增加,碱性磷酸酶泄露到细胞外,通过检测细胞外酶的变化可以反映出细胞结构及通透性的改变。 从图4—6 中可以看出,从反应最初开始,3 种菌在不同质量分数的苍术挥发油的作用下碱性磷酸酶水平显著高于对照组,碱性磷酸酶含量与苍术精油质量分数成正相关,且一直处于平稳状况。 通过观察可以得知,苍术挥发油对3 种指示菌细胞壁具有很强的破坏性。

图4 不同质量分数苍术挥发油对大肠埃希氏菌细胞壁的影响Fig. 4 Effect of different volatile oil concentrations of Atractylodes chinensis on cell wall of Escherichia coli

图5 不同质量分数苍术挥发油对金黄色葡萄球菌细胞壁的影响Fig. 5 Effect of different volatile oil concentrations of Atractylodes chinensis on cell wall of Staphylococcus aureus
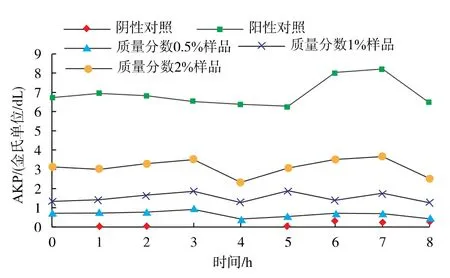
图6 不同质量分数苍术挥发油对白假丝酵母细胞壁的影响Fig. 6 Effect of different volatile oil concentrations of Atractylodes chinensis on cell wall of Candida albicans
3.3.3 苍术挥发油对菌体胞外蛋白质的影响 标准曲线方程在0~0.1 μg/mL 质量浓度范围内具有良好的线性关系,x为蛋白质质量浓度,y为吸光度,菌液蛋白质质量浓度的标准曲线方程为y= 7.435 7x+0.022,R2=0.996 4。
由图7—9 可见, 经不同质量分数的苍术挥发油处理后,与对照组相比,在600 nm 处的吸光度值明显增加,且胞外蛋白质的吸光度随着挥发油质量分数的增大而增大,说明随着苍术挥发油质量分数的增高,菌体通透性屏障受损程度随之增高,从而从胞内流出的蛋白质量越多,苍术挥发油可通过破坏菌体细胞膜结构,从而发挥抑菌杀菌的效果。
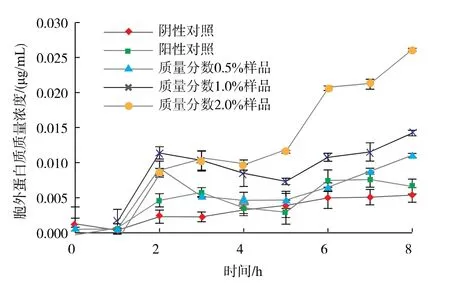
图7 不同质量分数苍术挥发油对大肠埃希氏菌胞外可溶性蛋白质泄露量的影响Fig. 7 Effects of different volatile oil concentrations of Atractylodes chinensis on the extracellular soluble protein leakage of Escherichia coli

图8 不同质量分数苍术挥发油对金黄色葡萄球菌胞外可溶性蛋白质泄露量的影响Fig. 8 Effect of different volatile oil concentrations of Atractylodes chinensis on the extracellular soluble protein leakage of Staphylococcus aureus

图9 不同质量分数苍术挥发油对白假丝酵母胞外可溶性蛋白质泄露量的影响Fig. 9 Effects of different volatile oil concentrations of Atractylodes chinensis on the extracellular soluble protein leakage of Candida albicans
4 结 语
本研究中考察了苍术挥发油对大肠埃希氏菌、金黄色葡萄球菌和白假丝酵母的体外抑菌活性、杀菌活性和抑菌机制。 从抑菌效果可知,苍术蒸馏提取的挥发油对于3 种指示菌均具有抑菌效果,其中对白假丝酵母的抑制活性最强,最小抑菌质量分数为0.5%,对大肠埃希氏菌和金黄色酵母菌的抑制活性相对较弱,最小抑菌质量分数为1.0%。 通过体外杀菌实验可知,苍术挥发油对大肠埃希氏菌表现出明显杀菌效果, 但苍术挥发油质量分数增加到2%时,对金黄色葡萄球菌和白假丝酵母虽有一定杀灭作用,但杀菌率仍未达到要求。 通过抑菌机制研究可以看出,苍术挥发油能够通过影响和破坏菌体细胞膜、细胞壁结构,改变菌体正常渗透作用,导致菌体内AKP、蛋白质等胞内物质外泄,从而导致菌体死亡,发挥抑菌效果。 苍术挥发油具有一定抑菌效果,但由于其水溶性有限,高浓度单独使用容易分层析出,影响使用效果,因此以苍术挥发油为原料的复配制剂还有待进一步研究。
