五指毛桃组培育苗研究*
2020-03-05黄锦荣谢金兰张冬生朱昔娇陈新强范秀琼范剑明
黄锦荣 张 凤 谢金兰 张冬生 朱昔娇 陈新强 范秀琼 范剑明
(梅州市农林科学院林业研究所,广东 梅州 514011)
五指毛桃中文名粗叶榕Ficus hirta,属桑科Moraceae 榕属Ficus 植物,别名佛掌榕、土北芪、五爪龙、五指牛奶等;我国主要分布在广东省、广西自治区、江西省、福建省、海南省等地区;国外马来西亚、缅甸、越南、泰国等国家亦有分布[1-3]。五指毛桃以根入药,其味甘、辛,性平,有益气健脾、舒筋化湿之功效,用于脾虚浮肿、自汗、风湿痹痛、慢性支气管炎等症,是多种中成药的原材料;同时五指毛桃是食药同源的植物,开发了很多保健食品和药膳,东南亚及我国港澳地区以五指毛桃为原料的汤料日渐盛行[2,4-5]。随着其用量的逐年上升,野生资源日渐匱乏,为保证五指毛桃资源的可持续利用,人工种植,特别是林下仿野生种植优良无性系是必然趋势。五指毛桃的主要活性成分为补骨脂素,王晓平等[6]与刘春玲等[7]的试验均认为五叶裂型五指毛桃中补骨脂素含量最高,为获得大量优良五指毛桃苗木,通过组织培养繁育成为首选。
国内关于五指毛桃组织培养的研究已有报道。其中陶瑜等[8]的研究以五指毛桃种子萌发的无菌芽苗为所需培养材料;李林轩等[3]的研究以五指毛桃叶片为外植体诱导丛芽得到培养材料;梁春辉等[9]的试验以五指毛桃叶片、叶柄和茎段为外植体诱导愈伤组织,认为叶片产生愈伤优于叶柄,而茎段无愈伤产生,亦无芽分化,不适合作外植体;蒋林等[10]的研究以带顶芽或带腋芽的茎段为外植体,通过从茎段上切面诱导出丛芽得到培养材料;苏钰琴[11]的研究以从顶芽切取的微茎尖为外植体诱导丛芽获得培养材料。以上各研究均未见通过诱导腋芽或顶芽萌发来获得培养材料的报道,本试验以带顶芽的茎段为外植体,诱导顶芽萌发得到所需培养材料。
1 材料与方法
1.1 试验材料
1.1.1 外植体 试验所用外植体来自梅州市农林科学院林业研究所2017 年3 月五指毛桃扦插试验培育的优良植株,扦插试验所用插穗全为五叶裂型五指毛桃枝条,来自大埔县世源农业生态有限公司在西河镇水祝村的五指毛桃种植基地,扦插试验在本所龙上苗圃场实施(116°7′29″~116°7′33″E,24°15′4″~24°15′12″N),苗木培育基质为黄心土,剪取无病虫、健壮的带顶芽嫩枝为外植体。
1.1.2 培养基及培养条件 试验所用培养基除生根培养基蔗糖浓度为20 g·L-1、活性碳为0.5 g·L-1外,其余培养基蔗糖浓度为30 g·L-1,卡拉胶浓度均为6.5 g·L-1,培养基灭菌前调整pH 值为5.8~6.2,培养基加入的激素均由上海伯奥生物科技有限公司生产,培养基在121℃下灭菌15~20 min。 培 养 室 温 度 为(26±2) ℃, 相 对 湿 度 为65%~70%,光照强度为1 000~2 000 lx,光照时长为10~12 h·d-1。
1.2 试验方法
1.2.1 外植体灭菌 将采回的嫩枝剪去叶片,切取长约2~3 cm 带顶芽茎段,置入干净玻璃瓶中,注入适量洗涤剂和水清洗茎段表面,用自来水反复冲洗干净,然后在超净工作台上用75 %的酒精浸泡10~15 s,无菌水冲洗1~2 次,再浸泡到添加1~2 滴吐温80 的1 g·L-1升汞溶液灭菌,时间为13、14、15 min,随后用无菌水冲洗4~6 次,取出茎段,在切口上方切去一小段,接种于培养基MS+6-BA1.0 mg·L-1+IBA0.1 mg·L-1中,每个处理接种15 瓶,每瓶接种1 个茎段,在培养室培养15 d 后观察灭菌效果,计算灭菌成功率。
1.2.2 芽诱导培养 用MS 作为基本培养基,加入6-BA 1.0 mg·L-1,IBA(0.1、0.5 mg·L-1) 或NAA(0.1、0.5 mg·L-1),试验设置4 个处理,3个重复,每个处理接种15 瓶,每瓶接种1 个外植体。在超净工作台上,用无菌纸吸干已灭菌茎段表面水分,在切口上方切去少许接种在培养基中,在培养室培养30 d 后统计外植体诱导萌芽数,计算芽诱导率。
1.2.3 增殖培养 用MS 作为基本培养基,加入6-BA(0.5、1.0、1.5 mg·L-1),IBA(0.1、0.3、0.5 mg·L-1),试验设置9 个处理,3 个重复,每个处理接种5 瓶,每瓶接种3 个单芽或小丛芽。在超净工作台上,将经过数次初代培养获得的丛芽,分切成单芽或小丛芽接种在培养基中,在培养室培养35 d 后统计芽个数,计算芽增殖倍数。
1.2.4 生根培养 用1/4MS(大量元素1/4)作为基本培养基,加入IBA(1.0、1.5、2.0 mg·L-1),NAA(0.1、0.3、0.5 mg·L-1),试验设置9 个处理,3 个重复,每个处理接种5 瓶,每瓶接种10个芽苗。在超净工作台上,从增殖培养的芽苗中,切取具3 片以上舒展叶片、高2.5~3.5 cm 的芽苗,接种在培养基中,在培养室培养25 d 后统计生根数,计算生根率。
1.2.5 瓶苗移栽 将炼苗后的生根植株从瓶中移到盆中,用清水轻轻洗去根部粘附的培养基,种植于容器基质中,基质采用黄心土与轻型基质(椰糠70%,泥炭30%),种植时先在基质中挖个小坑,将小苗植入坑中,用基质完全覆盖小苗根部,注意不要按压基质防止伤及苗根,栽后淋透水,保持基质湿润,种植一个月后调查存活率。
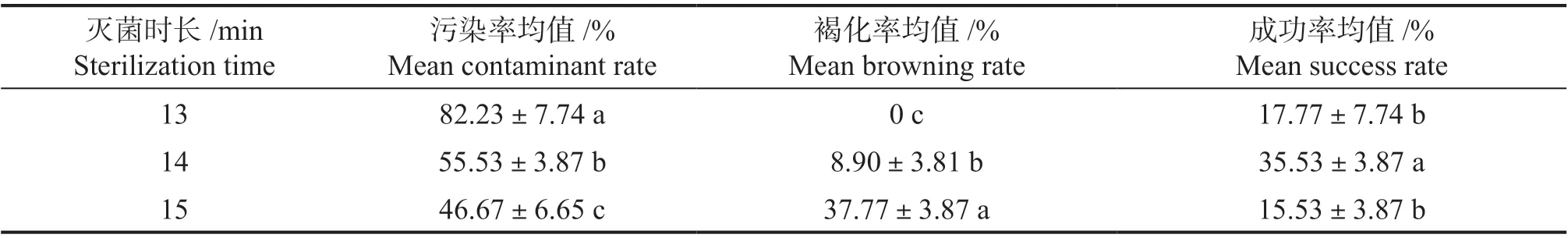
表1 不同灭菌时间对五指毛桃外植体的影响Tab.1 The effect of different sterilization time on the explants of Ficus hirta
2 结果与分析
2.1 外植体灭菌
将灭菌后的五指毛桃外植体接种到培养基MS+6-BA1.0 mg·L-1+IBA0.1 mg·L-1+蔗糖30 g·L-1+卡拉胶6.5 g·L-1中,培养15 d 后的灭菌效果分析见表1。可见灭菌时长对五指毛桃外植体的污染率、褐化率及灭菌成功率的影响均差异显著(P <0.05)。灭菌时长13 min 的处理污染率最高,为82.23%,无褐化,灭菌成功率为17.77%;灭菌时长14 min 的处理污染率为55.53%,褐化率为8.9%,灭菌成功率最高,为35.53%;灭菌时长15 min 的处理污染率最低,为46.67%,而褐化率最高达37.77 %,灭菌成功率仅为15.53%。因此五指毛桃外植体最合适的灭菌时长为14 min。
2.2 芽诱导培养
外植体接种到芽诱导培养基中,在培养室培养30 d 后的统计分析结果见表2。可见4 个处理的芽诱导率差异不显著。表2 直观可见,在培养基中加入相同浓度的IBA 或NAA 时,IBA 作用下的芽诱导率稍高;在培养基中加入不同浓度的同一生长素时,芽诱导率会随着生长素浓度的增加而小幅下降;在IBA 的浓度为0.1 mg·L-1时,五指毛桃外植体的芽诱导率最高,平均芽诱导率为40%。因此认为,加入6-BA 1.0 mg·L-1与IBA0.1 mg·L-1的培养基适合五指毛桃外植体芽诱导培养。
2.3 增殖培养
将单芽或小丛芽接种在增殖培养基中,在培养室培养35 d 统计分析结果见表3。不同浓度6-BA 与IBA 配比,对五指毛桃增殖倍数的影响差异显著(P <0.05),随着6-BA 浓度由0.5 mg·L-1增加至1.5 mg·L-1,芽的增殖倍数亦从2.87 上升至6.64,当6-BA 的浓度为1.5 mg·L-1时芽增殖倍数最高为6.64,但在此浓度时芽苗生长慢,叶逐渐变黄,长期使用不利于增殖培养,当6-BA 的浓度为1.0 mg·L-1时芽增殖倍数为5.43,芽苗生长正常,叶绿色,适合五指毛桃增殖培养;由表3 可见,不同浓度IBA 对增殖培养的影响与6-BA 的浓度有关,当6-BA 浓度为0.5 mg·L-1时IBA 不同浓度对芽增殖影响差异不显著,当6-BA 浓度为1.0 mg·L-1与 1.5 mg·L-1时IBA 不同浓度对芽增殖影响差异显著,当IBA浓度由0.1 mg·L-1增加至0.3 mg·L-1时,芽增殖倍数亦上升,而当IBA 浓度由0.3 mg·L-1增加至0.5 mg·L-1时,芽增殖倍数则下降;因此,加入6-BA 1.0 mg·L-1与IBA0.3 mg·L-1的培养基,最适合五指毛桃芽增殖培养。
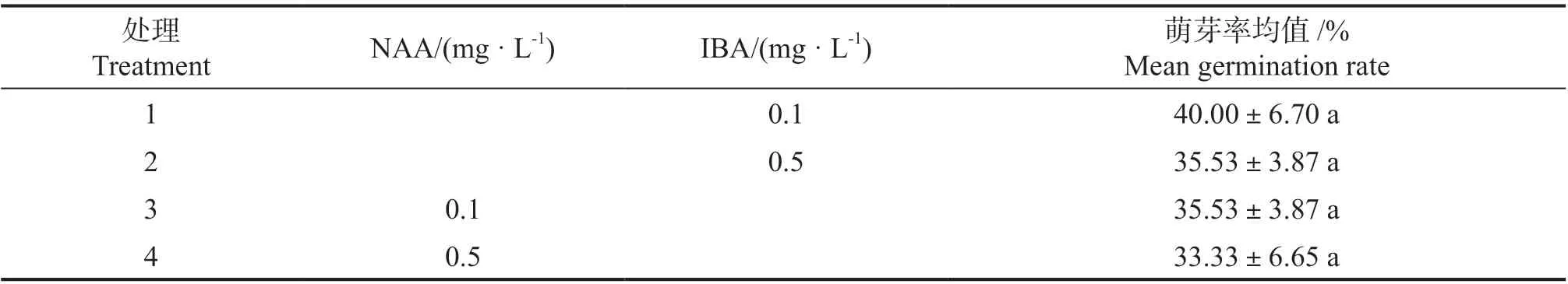
表2 不同激素配比对五指毛桃芽诱导的影响Tab.2 The effect of different hormone ratio on the bud induction of Ficus hirta
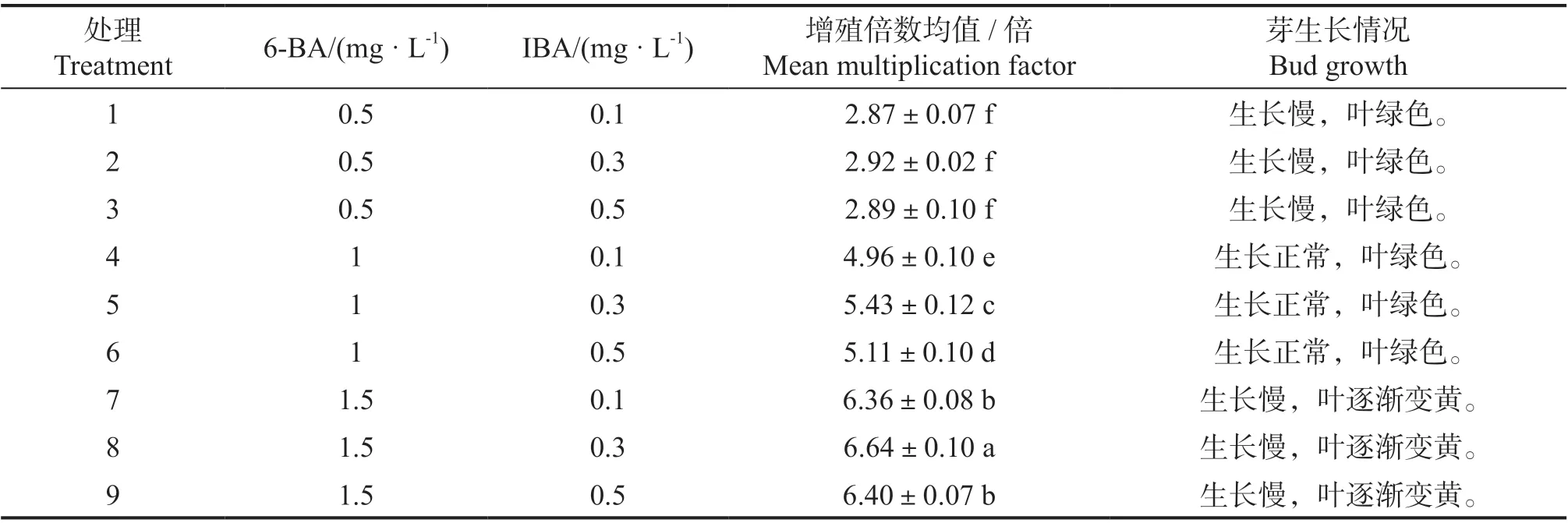
表3 不同激素配比对五指毛桃芽增殖的影响Tab.3 The effect of different hormone ratio on the bud proliferation of Ficus hirta
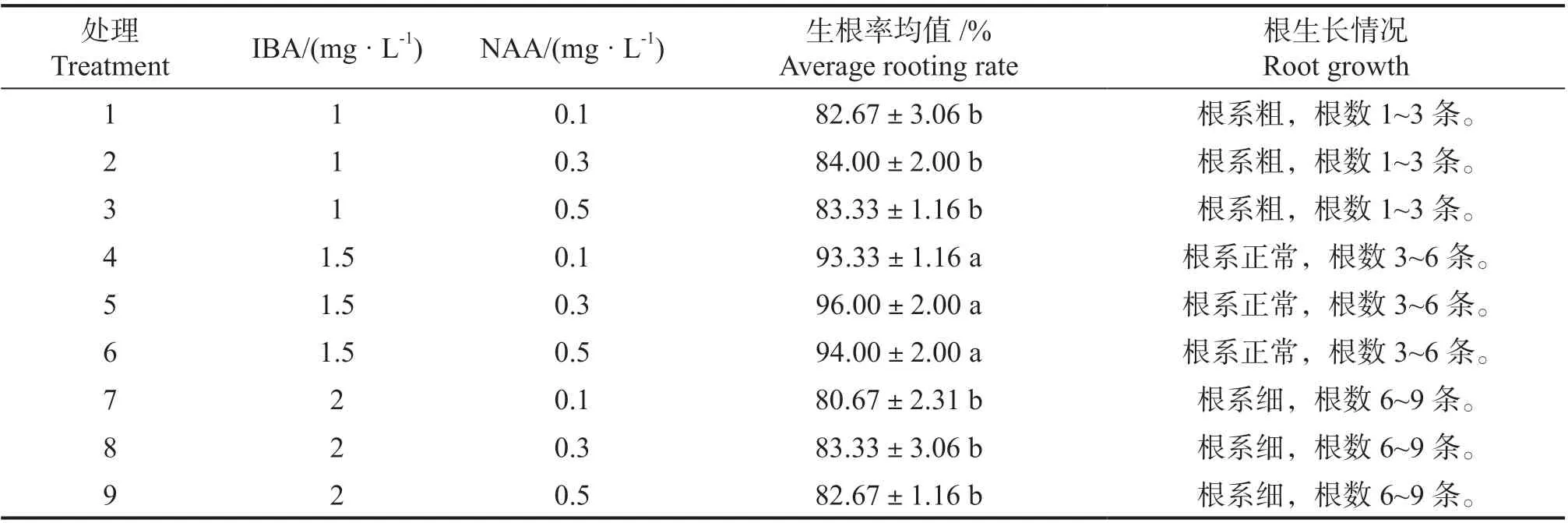
表4 不同激素配比对五指毛桃生根的影响Tab.4 The effect of different hormone ratio on the take root of Ficus hirta
2.4 生根培养
将芽苗接种在生根培养基中,在培养室培养25 d 后统计分析结果见表4。不同浓度IBA与NAA 配比,对五指毛桃生根率的影响差异显著(P <0.05)。当IBA 的 浓 度 由1.0 mg·L-1增加至1.5 mg·L-1时,生根率随着IBA 的浓度增加而升高;当IBA 的浓度由1.5mg·L-1增加至2.0 mg·L-1时,生根率随着IBA 的浓度增加而下降,并且根系纤细;当IBA 的浓度不变,NAA的浓度在0.1~0.5 mg·L-1时,随着NAA 的浓度升高,生根率没有显著变化;在IBA 的浓度为1.5 mg·L-1、NAA 浓度为0.3 mg·L-1时生根率最高,达到了96%,根数较多,根系生长正常。因此,加入IBA1.5 mg·L-1与NAA0.3 mg·L-1的培养基,是五指毛桃生根的最佳培养基。
2.5 瓶苗移栽
瓶苗移栽30 d 后统计分析结果见表5。不同基质对五指毛桃组培苗移栽存活率的影响差异显著(P <0.05),移栽到黄心土中的幼苗平均存活率为94.73%,移栽到轻型基质中的幼苗平均存活率为98.15%,轻型基质中生长的五指毛桃幼苗的平均存活率明显高于黄心土中五指毛桃幼苗的平均存活率,因此,五指毛桃组培苗移栽最佳的基质为轻型基质。
3 结论与讨论
本研究确定了五指毛桃外植体用1 g·L-1升汞灭菌最适合的时长为14 min;适合五指毛桃外植体芽诱导的培养基为MS+6-BA 1.0 mg·L-1+IBA0.1 mg·L-1+蔗糖30 g·L-1+卡拉胶6.5 g·L-1;最适合五指毛桃不定芽增殖的培养基为MS+6-BA 1.0 mg·L-1+IBA0.3 mg·L-1+ 蔗 糖30 g·L-1+ 卡拉胶6.5 g·L-1;最适合五指毛桃生根的培养基为1/4MS+IBA1.5 mg·L-1+NAA0.3 mg·L-1+ 蔗糖20 g·L-1+卡拉胶6.5 g·L-1+活性碳0.5 g·L-1;最适合五指毛桃组培苗移栽的基质为轻型基质。

表5 不同基质对五指毛桃移栽的影响Tab.5 The effect of different stroma on the transplant of Ficus hirta
本研究在五指毛桃芽增殖培养试验中,随着培养基中6-BA 浓度的增加,芽增殖倍数也随着升高,当6-BA 浓度增加至一定数值时,虽然芽增殖倍数是升高了,但会影响芽苗的正常生长,这与陈丽静等[12]和丁伟等[13]在植物组织培养过程中芽增殖培养的研究结果一致。在五指毛桃生根培养试验中,本试验以1/4MS 为基本培养基,加入IBA浓度为1.5 mg·L-1、NAA 浓度为0.3 mg·L-1时生根率最高,这与李林轩等[3]和陶瑜等[8]的试验结果稍有差异,李林轩等和陶瑜等的试验以1/2MS为基本培养基,在加入IBA 浓度为1.0 mg·L-1、 NAA 浓度为0.3 mg·L-1时生根率最高,两者间形成差异是否与所用基本培养基不同相关,或者是所用活性碳浓度不同相关,或者是其他因素如芽苗切割方法不同等相关,原因有待进一步研究 分析。
本研究在五指毛桃外植体灭菌过程中只使用了75%的酒精与1 g·L-1的升汞进行不同时长的灭菌试验,外植体灭菌成功率最高仅为35.53%,后续需进一步探索不同灭菌剂对五指毛桃外植体的灭菌效果,以提高五指毛桃外植体的灭菌成功率;在瓶苗移栽试验中,只采用了2 种基质进行对比试验,存在一定的局限性,有必要增加一些不同基质来完善试验。
