多途径介入手术与单纯抗凝治疗颅内静脉系统血栓
2020-03-02苏旭东姚冬静于江华刘增品周存河刘桂元
苏旭东,姚冬静,于江华,刘增品,周存河,刘桂元
(1.河北医科大学第二医院神经内科 河北省神经病学重点实验室,河北石家庄 050000;2.河北省人民医院儿科,河北 石家庄 050051;3.阜城县人民医院内科,河北 阜城 053799)
颅内静脉系统血栓(cerebral venous sinus thrombosis, CVST)是以颅内静脉回流受阻为特征的脑静脉系统疾病,可引起脑卒中,约占所有脑卒中的0.5%~1.0%[1],可在短期内进展为脑疝甚至导致患者死亡[2]。近年来各种介入治疗技术发展,CVST病死率已由30%~50%下降至4.3%~15.0%[3-5]。抗凝是CVST的基本治疗手段,但相关文献[6]报道抗凝治疗对约13.4%的CVST患者效果不佳。本研究与单纯抗凝治疗对比,观察包括微导管接触性溶栓术、NAVIEN导管接触性抽栓术、支架取栓术、脑静脉窦球囊碎栓术及脑静脉窦支架植入术在内的多途径复合介入手术治疗CVST的疗效,为临床决策提供参考。
1 资料与方法
1.1 一般资料 回顾性分析2014年5月—2018年2月河北医科大学第二医院收治的88例CVST患者,根据治疗方案分为手术治疗组(47例)和对照组(41例)。手术治疗组男16例,女31例,年龄18~50岁,平均(34.4±9.2)岁;对照组男14例,女27例,年龄21~49岁,平均(35.8±8.1)岁。纳入标准:①经MR静脉造影或全脑血管造影证实CVST;②格拉斯哥昏迷量表(Glasgow coma scale, GCS)评分≥13分;③美国国立卫生研究院卒中量表(National Institute of Health stroke scale, NIHSS)评分0~8分。排除标准:①未能明确诊断;②有其他严重神经系统疾病(如颅内肿瘤、动脉瘤、脑血管畸形等);③伴有严重心、肝、肾等重要脏器功能障碍;④伴有可能干扰临床预后的其他疾病(如恶性肿瘤等);⑤随访资料不完整。
1.2 治疗方法
1.2.1 手术治疗组 采用Siemens Artis Zee DSA机为介入引导设备,采用多途径复合介入手段,同时配合规范抗凝及脱水降颅压等药物治疗。
配合微导丝机械性碎栓的微导管接触性溶栓术:经股动脉入路,将6F导引导管置于颈静脉球部,以微导丝在微导管配合下进行机械性牵拉碎栓,然后留置微导管在血栓部位进行接触性溶栓,溶栓药物为尿激酶1~2万U/h。每12~24 h检测凝血功能,使凝血酶原时间维持在18~30 s、国际标准化比值(international normalized ratio, INR) 控制在1.5~2.5,纤维蛋白原>1 000 mg/L。每隔2日复查DSA,观察血栓溶解情况,并调整微导管位置。以静脉窦管腔通畅为结束“接触性溶栓”指征。见图1。
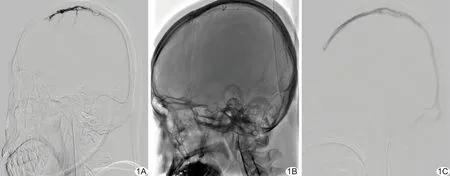
图1 患者男,32岁,上矢状窦血栓 A.造影示上矢状窦广泛血栓形成; B.应用微导丝进行机械性碎栓; C.接触性溶栓后上矢状窦通畅
NAVIEN导管接触性抽栓术:用于静脉窦内血栓阻塞范围超过1/2的部分患者。将8F导引导管置于颈静脉球部,建立通路;以NAVIEN导管(6F,135 cm)在微导管+微导丝系统辅助下进入静脉窦血栓部位,用20 ml注射器直接通过NAVIEN导管抽栓。抽栓后留置微导管,对残留血栓进行接触性溶栓。
支架取栓术:用于静脉窦内血栓阻塞范围超过1/2的部分患者。将8F导引导管置于颈静脉球部,建立通路;以NAVIEN导管(6F,135 cm)进入静脉窦腔,在REBAR微导管辅助下,送入Solitaire支架(6×20 mm)抵达血栓部位,并进行取栓,可多次重复取栓操作,同时配合抽栓。之后留置微导管对残留血栓进行接触性溶栓。

表1 2组CVST患者基线资料比较
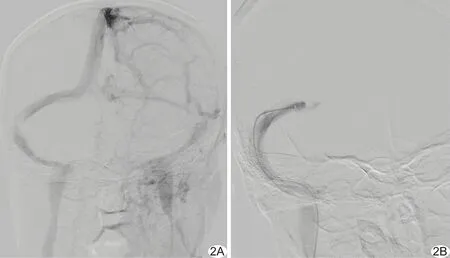
图2 患者女,25岁,右侧横窦乙状窦交界区狭窄 A.植入支架前,造影显示血管狭窄,对比剂充盈缺损; B.植入支架后血流通畅
脑静脉窦球囊碎栓术:用于静脉窦内血栓形成时间较长、负荷较重,接触性溶栓效果不佳者。采用球囊(4~5 mm×20 mm)对血栓负荷较重处进行扩张碎栓,同时配合微导丝碎栓及微导管接触性溶栓治疗。
脑静脉窦支架植入术:对于静脉窦局限性狭窄患者,首先以液面式测压管对狭窄远心端及近心端进行测压,按照中国颅内静脉系统血栓形成诊断和治疗指南国家卫生和计划生育委员会脑卒中防治工程委员会的相关要求,若压力梯度大于150 mmH2O,则植入支架。选择自膨式支架系统,根据狭窄部位的长度和直径选择支架型号,在NAVIEN导管的辅助下植入支架。见图2。
术后处理:将低分子肝素替换为华法林钠,将INR控制在2~3,持续治疗6个月以上。
1.2.2 对照组 给予低分子肝素4 100~5 000 U,2次/天,皮下注射,持续5~20天,结合甘露醇脱水降低颅压等常规药物治疗。病情稳定后,将低分子肝素替换为华法林钠,将INR控制在2~3,持续治疗6个月以上。
1.3 相关指标观察 常规于治疗前、出院日及出院3、6个月进行神经功能评估,包括改良Rankin量表(modified Rankin scale, mRS)评分及NIHSS评分;必要时行影像学检查。随访终点事件为静脉窦血栓复发、新发颅内出血或死亡。
1.4 统计学分析 采用SPSS 13.0统计分析软件。符合正态分布的计量资料以±s表示,非正态分布者以中位数(上下四分位数)表示。NIHSS评分组间比较采用t检验,组内比较采用重复测量数据的方差分析。mRS评分组间比较采取两独立样本秩和检验,组内比较采取多个相关样本的秩和检验。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
手术治疗组47例中,27例接受配合机械性碎栓的微导管接触性溶栓术,7例接受NAVIEN导管接触性抽栓术,支架取栓术1例,球囊扩张碎栓术9例,支架植入术3例。
2.1 mRS、NIHSS评分比较 治疗前手术治疗组mRS和NIHSS评分分别为2(1,3)和3.12±1.65,与对照组2(2,3)和3.47±1.84差异无统计学意义(P均>0.05),见表1。
2.2 随访情况 手术治疗组无终点事件发生。对照组随访期间1例复发,入院后经接触性溶栓治疗后康复出院,继续随访6个月未复发,无颅内新发出血及死亡病例。
分别于出院时及出院3、6个月对2组患者进行随访,收集并记录mRS和NIHSS评分。2组治疗后mRS和NIHSS评分较治疗前均下降(P均<0.05);手术治疗组出院时及出院3、6个月mRS和NIHSS评分均低于对照组(P均<0.05)。见表2、3。

表2 2组CVST患者mRS评分比较[中位数(上下四分位数)]
表3 2组CVST患者NIHSS评分比较(±s)
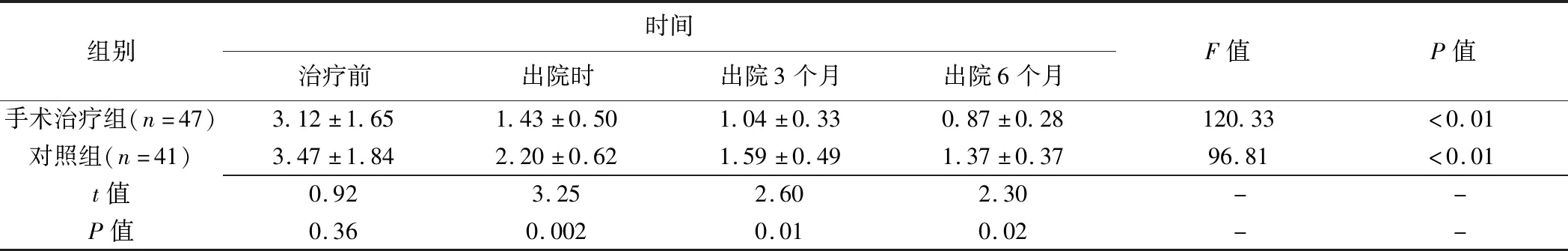
表3 2组CVST患者NIHSS评分比较(±s)
组别时间治疗前出院时出院3个月出院6个月F值P值手术治疗组(n=47)3.12±1.651.43±0.501.04±0.330.87±0.28120.33<0.01对照组(n=41)3.47±1.842.20±0.621.59±0.491.37±0.3796.81<0.01t值0.923.252.602.30--P值0.360.0020.010.02--
3 讨论
抗凝治疗对CVST的有效性已被业内认可[7],但在血栓形成时间较长、血栓负荷较重或伴有颅内出血者,单纯抗凝治疗后病死率仍高达50%[8-9]。近年来,随着脑血管介入器材的发展和更新,许多新的介入治疗手段显示出了优势[9-10],临床往往以复合多途径介入治疗CVST[9]。
CVST的病理机制是血栓阻塞脑静脉窦的静脉回流而造成脑血流瘀滞,脑循环时间延长,颅内压升高,淤血性梗死,出血等[11],因此治疗CVST的关键在于尽快实现静脉窦腔复通。传统抗凝治疗静脉窦腔内药物浓度较低,血栓溶解较慢[8],往往造成淤血区半暗带神经细胞凋亡,从而影响患者神经功能康复。
有针对性地选择治疗方式可以实现精准、高效治疗CVST,从而改善患者预后。不同介入术式治疗CVST各自具有其优势。对病程较短、血栓松软者更适合采用微导丝碎栓及接触性溶栓[11],而对血栓形成时间较长者更宜以球囊等器械进行碎栓[9],对范围较广的血栓则更适合抽栓或取栓[12-13],局限性狭窄者需要球囊扩张甚至植入支架[14]。CVST伴有颅内出血时,应该尽量减少溶栓药物的剂量,并尽快实现窦腔复通等[15]。
本研究治疗后2组mRS和NIHSS评分均改善,且终点事件发生率均较低,仅对照组出现了1例CVST复发,提示两种治疗方法均为安全、有效。手术治疗组出院时及出院3、6个月mRS和NIHSS评分均低于对照组(P均<0.05),说明多途径介入手术治疗CVST优于传统抗凝治疗。
本研究显示多途径介入手术治疗CVST优于传统的单纯抗凝治疗,可为临床上介入手术方案的选择提供参考。今后将进一步设计前瞻性对照研究来考证新兴介入术式的疗效。