吸附法消减真菌毒素的研究进展
2020-02-18,2,3,*,2,3,2,3,2,3
,2,3,*,2,3,2,3,2,3
(1.河南工业大学粮油食品学院,河南郑州 450001;2.小麦和玉米深加工国家工程实验室,河南郑州 450001;3.国家粮食局粮油食品工程技术研究中心,河南郑州 450001)
随着全球气候的变暖以及环境污染的日益加重,粮食作物等受到真菌污染的几率越来越高,由于污染而失去实用价值和营养价值的比例越来越大。真菌毒素对粮食作物及动物饲料的污染物直接影响着人类和动物的健康,在全球范围内成为一个严峻的问题[1]。全球每年约有25%的粮食作物受到不同程度的污染[2]。在粮食作物收获前后、加工过程中或者制品的储存期间都可能受到多种真菌毒素的污染,受到真菌毒素污染的食品和饲料在人类和动物体内可引起多种急性中毒和慢性中毒[3]。在谷物的贮藏期间,储存条件是真菌毒素生长的主要影响因素,其中贮存的水分和温度是决定谷物安全的重要因素。就高水分含量(16%~30%)的谷物而言,环境温度(25~32 ℃)和相对湿度80%~100%是导致谷物在储藏过程中霉菌生长和真菌毒素合成的主要原因[4]。
目前许多物理、化学和生物方法用于去除、破坏或减少真菌毒素。通常,物理方法包括吸附法、热灭活法、辐射和微波处理等[5-6]。化学方法通常使用酸、碱、氧化剂等与真菌毒素反应破坏其结构,将其转化为无毒或毒性较小的物质[7-8]。生物法则是利用生物降解技术,通过一些微生物菌株去除毒素或者降低其毒性[9-10]。综合来说,这些方法对于真菌毒素的消减均有效果,但在不同地实际应用中都有一些局限性。例如,化学法不仅要求有合适的反应设备,而且需要额外的处理[11]。此外化学反应较为复杂,可能会改变或破坏粮食及产品的营养价值,其反应过程中也可能生成一些有害的物质,甚至使最终产品中含有化学残留而影响产品的质量。生物法消减真菌毒素的效率高、专一性好,但是在当前实际应用中,其技术不够完善,通常反应所需条件较为苛刻,且成本相对较高,因此目前无法实现大规模的工业化应用[12]。吸附法因其简单、方便、快捷等优点在饲料及食用油等行业有较多应用。近年来,国内外学者对吸附法消减真菌毒素进行了较多的研究[13-15]。吸附法消减真菌毒素具有广阔的应用前景。
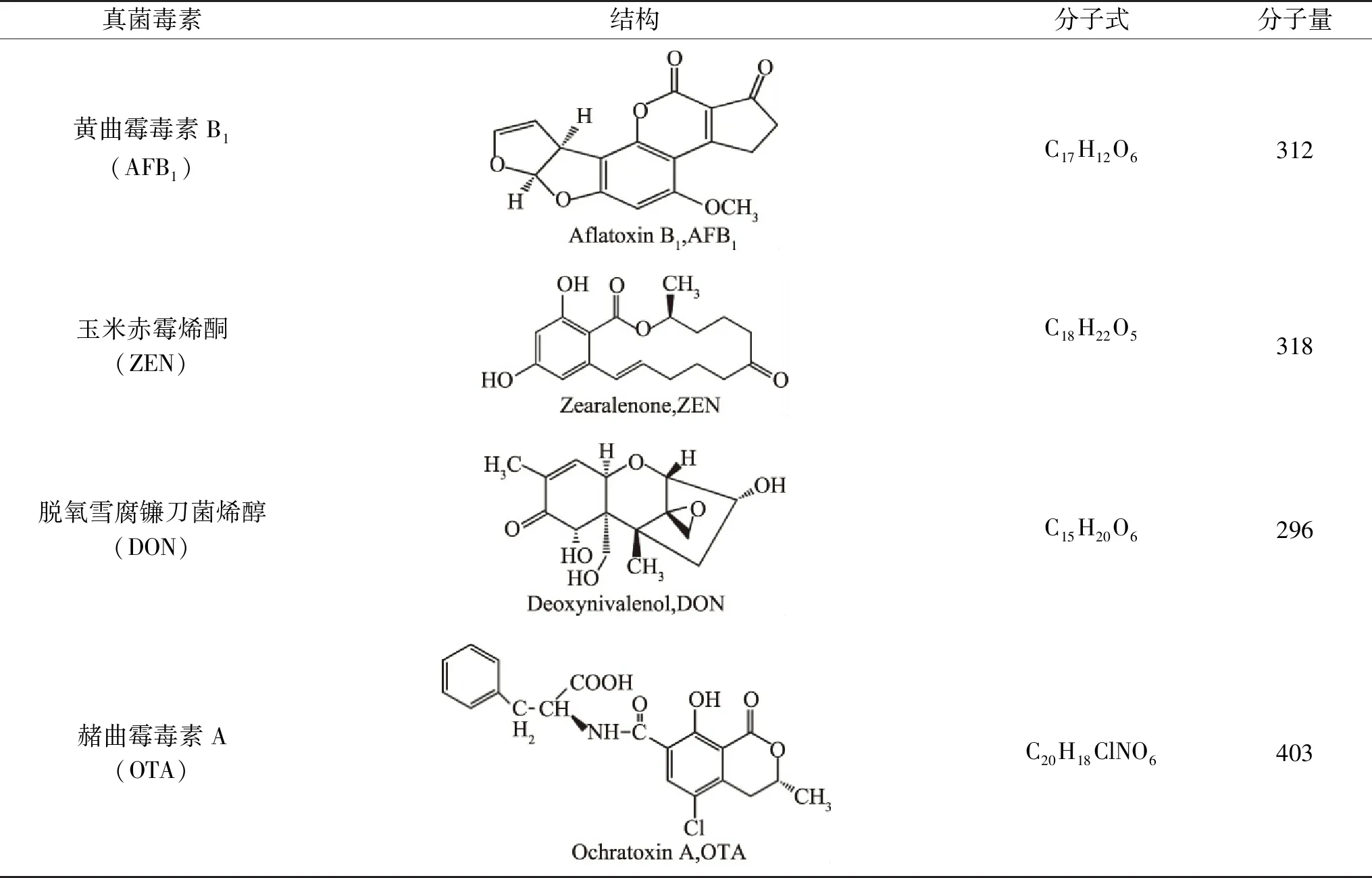
表1 主要真菌毒素Table 1 Major mycotoxins
本文对粮食及制品中常见的真菌毒素及其危害进行了简要的概述,着重综述了不同吸附剂如活性炭、硅铝酸盐及其改性产品吸附消减真菌毒素的最新研究进展,并讨论了一些吸附剂的吸附机理,以期为更好地研制高效的真菌毒素吸附剂提供一些参考。
1 真菌毒素的种类及危害
真菌毒素是一些真菌或霉菌产生的次级代谢产物,通常是由许多菌属产生,食品及饲料中最为常见的毒素是曲霉菌属产生的黄曲霉毒素,镰刀菌属产生的玉米赤霉烯酮,以及曲霉菌属和青霉属产生的赭曲霉毒素A[16]。到目前为止,大约400种真菌毒素已经被检测到。其中,玉米赤霉烯酮、脱氧雪腐镰刀菌烯醇和赭曲霉毒素因在饲料中的频繁检出及其对动物和人类的严重毒性作用而受到广泛关注(表1)[17-18]。
1.1 黄曲霉毒素
黄曲霉毒素(Aflatoxin,AFs)是一类二呋喃香豆素衍生物,其基本结构中都有双呋喃环和氧杂萘邻酮(香豆素),在紫外光照射下会发出荧光[19]。AFs主要包括黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)和黄曲霉毒素M1(AFM1),其中AFB1最常见且毒性最强,国际癌症组织将其列为I类致癌物质。AFs几乎不溶于水和正己烷,但在甲醇、乙腈、氯仿、丙酮等溶剂中溶解度较好[20]。因其含有大量环共轭体系,AFB1的热稳定性非常好,在268 ℃以上的条件下才开始分解且分解较慢。AFB1具有较强的耐酸性,可溶于碱性溶液,一些氧化剂如氯气、次氯酸、双氧水、二氧化硫等均可破坏AFB1的结构[21]。AFs的主要靶器官是肝脏,摄入含有过高含量毒素的食物后可以引发肝癌[22]。在饲喂猪的日粮中添加AFs,导致血清酶活性升高,肝脏酶活性降低,生长性能降低[23]。AFB1的口服半数致死量(LD50):猪为0.62 mg/kg,火鸡为0.5 mg/kg,雏鸭为0.3 mg/kg,绵羊为2.0 mg/kg[24]。
1.2 玉米赤霉烯酮
玉米赤霉烯酮(Zearalenone,ZEN)又称F-2毒素,是一类主要由禾谷镰刀菌(Fusariumgraminearum)、黄色镰刀菌(Fusariumculmorum)等多种镰刀菌产生的非甾体真菌毒素,对动物和人类产生激素影响[25]。其化学名为6-(10-羟基-6-氧基-反式-11-十一碳烯基)β雷羧酸μ-内酯[26]。此外,ZEN是一种弱极性分子,熔点为165 ℃,几乎不溶于水、四氯化碳等溶剂,但在碱性水溶液中溶解度良好,且在正己烷、苯、乙腈、二氯甲烷、甲醇、乙醇和丙酮中其溶解度依次增加[1]。ZEN是一种大环内酯结构的化合物,在碱性条件下ZEN的内酯键将部分打开[26-27]。研究表明ZEN具有类雌激素作用,对动物有一定的生殖毒性,还会产生细胞毒性和遗传毒性,造成肝肾器官损伤并降低免疫机能[28]。董双等[29]采用不同浓度的ZEN对雄性小鼠进行腹腔注射,ZEN明显地降低了小鼠的体重和精液品质。小鼠睾丸乳酸脱氢酶、碱性磷酸酶、酸性磷酸酶的活力随着ZEN剂量的增加而明显升高,同时血清睾酮和雌激素浓度明显下降,严重损伤了雄性小鼠生殖系统影响其生精功能。对小鼠连续3 d注射50 mg/kg剂量的ZEN,观察到肝细胞局灶性脂肪变性、肝脏坏死等。ZEN对小鼠的肝脏、肾脏有严重的损害作用,并且会造成肾功能紊乱[30]。相对AFB1而言ZEN的毒性较小,小鼠、大鼠和豚鼠的口服半数致死量(LD50)为2000~20000 mg/kg[31]。
1.3 脱氧雪腐镰刀菌烯醇
脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)又名呕吐毒素,主要由禾谷镰刀菌、尖孢镰刀菌、雪腐镰刀菌等在适宜条件下产生的次级代谢产物,主要存在于玉米、小麦、大麦及其副产品中[32]。化学名为3,7,15-三羟基-12,13-环氧单端孢霉-9-烯-8-酮,熔点为151 ℃,易溶于水,也可溶解于甲醇、乙醇、乙腈和丙酮等极性溶剂,不溶于正己烷、丁醇和石油醚[33]。DON可使动物食欲下降或拒绝采食,皮肤或皮下黏膜上皮发炎、红肿甚至坏死,破坏一系列生理机能[34]。与黄曲霉毒素不同,DON转移到动物源性食物中的可能性较小[35]。DON的口服半数致死量(LD50):小鼠46.8 mg/kg,1日龄雏鸡为140 mg/kg[36]。
1.4 赭曲霉毒素
赭曲霉毒素主要包括赭曲霉毒素A(Ochratoxin A,OTA),赭曲霉毒素B(OTB)和赭曲霉毒素C(OTC),是由曲霉属和青霉属的霉菌产生的高毒性代谢产物,并且存在于许多天然食品中,例如香料、咖啡、谷物、豆类和水果中[37]。赭曲霉毒素中OTA最常见且毒性最大,国际癌症研究所将其归为2B类致癌物[9]。OTA化学名为7-羧-5-氯-8-羟-3,4-二氢-3-R-甲基异香豆素-7-L-β-苯丙氨酸,是由氯化的异香豆素类似物和苯丙氨酸以酰胺键连接而成,是一种白色结晶化合物,熔点约168~173 ℃,在酸性和中性条件下OTA具有很高的热稳定性;微溶于水,可溶于碳酸氢钠水溶液,极易溶于醇、酮和氯仿等有机溶剂[38-39]。OTA已被证明对几种动物具有肾毒性、肝毒性、致畸性和免疫毒性,并在小鼠和大鼠中引起肾脏和肝脏肿瘤[40]。OTA的口服半数致死量(LD50)为:狗0.2 mg/kg,猪1.0 mg/kg,鸡为3.3 mg/kg,大鼠和小鼠的LD50增加至20~58 mg/kg[16]。
2 消减真菌毒素的吸附剂及效果
已有研究证明采用吸附的方法是解除真菌毒素更合适的选择。吸附剂脱毒的方法因其廉价、方便、操作简单等诸多优点而得到广泛应用。在饲料以及食用油中已经使用各种类型的吸附剂,如活性炭、粘土矿物等,以脱除或减少真菌毒素对粮食作物及家畜的有害影响。但是一些天然的矿物吸附剂并不能同时高效吸附多种真菌毒素,因此吸附剂的改性应运而生。一些吸附剂在改性后表现出优异的吸附性能,可同时吸附多种毒素[41-43]。
2.1 活性炭
活性炭是由木屑、蔗渣、谷壳、硬果壳等碳化后再经过化学或物理活化处理而成的[44]。因其具有空隙疏松、比表面积大、吸附容量高等优点在吸附方面应用较为广泛。活性炭吸附是去除水溶液中污染物最常用的方法之一[45]。在去除真菌毒方面,活性炭也具有一定的应用。邵建忠等[46]以猪为实验对象,对试验猪单独饲喂DON或与活性炭一同口服。在单独饲喂DON的猪血液中检测到高水平的DON,而同活性炭一同饲喂时在猪体内未能检测到该毒素。活性炭、黏土、硅藻土能够吸附培养基中85%的伏马毒素B1(200 μg/mL)[47]。
近年来,活性炭在饲料、油脂吸附脱毒的应用方面研究较多。刘玉兰等[48]对WY1活性炭、WY2活性炭、NORIT活性炭及普通活性炭在玉米毛油脱色过程中对ZEN的脱除进行了研究并优化了吸附过程。发现在油中添加2%的WY1活性炭,ZEN的脱除率达到48.25%,ZEN含量从8026.67 μg/kg降低至4153.77 μg/kg,具有一定的脱除效果,但仍高于欧盟400 μg/kg的限量。因此,该方法仅适用于初步减少ZEN的含量,要想达到限定标准还需进一步的精炼。陈金定等[49]研究了WY1活性炭、WY2活性炭及普通活性炭对玉米毛油中AFB1的脱除效果,发现添加量为油重的2%时,AFB1含量由39.28 μg/kg分别降至2.22、1.68、9.54 μg/kg,明显优于国家标准中规定的食用油中AFB1含量≤20 μg/kg的限量。就玉米胚芽油而言,AFB1及ZEN的含量相对较高,从研究结果来看,对两种毒素的同时去除还需进行深一步的研究。Edrington等[50]发现在含有黄曲霉毒素的鸡饲料中加入活性炭,能够减轻黄曲霉毒素的毒害作用。Kubena等[51]研究表明,在饲料中添加0.5%活性炭并不能缓解饲料中T-2毒素对肉仔鸡的毒性。活性炭对于去除毒素方面具有一定的效果,但是活性炭的选择吸附能力较差,实际应用中,吸附毒素的同时也会对营养物质等进行吸附,从而降低或者失去对毒素的吸附作用[52]。
2.2 硅铝酸盐类吸附剂
硅铝酸盐类吸附剂(Aluminosilicate,AS)是指含有Al2O3和SiO2的矿物质,常见的硅铝酸盐矿物有蒙脱土、沸石、高岭土、硅藻土等。因其具有较高的化学稳定性、比表面积、孔隙结构、以及离子吸附与交换能力,因此受到众多学者的广泛研究[53-54]。同时,硅铝酸盐类矿物结构中存在许多天然纳米微孔,层间带有大量可交换阳离子,能够产生同质取代的作用,因此可吸附带有极性基团的毒素(如AFB1),而那些低极性的真菌毒素(如ZEN和OTA)则不易被这些矿物所吸附[55]。有研究表明用长链有机阳离子(表面活性剂)代替矿物中的无机阳离子以增加其疏水性可实现对真菌毒素的良好吸附。
2.2.1 沸石 沸石是沸石族矿物的总称,是一种含水的碱或碱土金属硅铝酸盐矿物。因其具有较大的色散力和强静电力使得其具有很强的吸附能力,已经在饲料等领域得到了广泛的应用[54]。沸石随饲料一同被动物摄取后,会在体内吸水膨胀,增加食糜粘度,延长饲料在消化道内的停留,有利于动物对营养物质的消化吸收、降低粪便营养水平,同时可以吸附饲料中的毒素,从而提高动物的免疫力[56-57]。
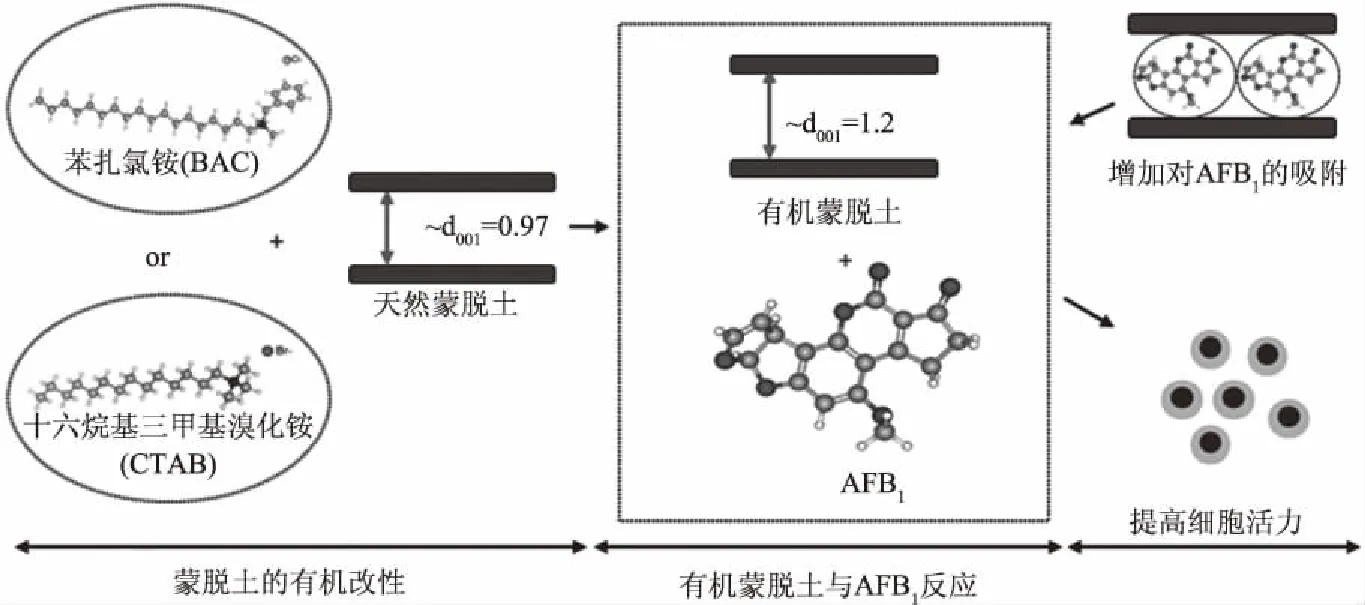
图1 改性蒙脱土对AFB1的吸附Fig.1 Adsorption of AFB1 by modified montmorillonite
天然蒙脱土对真菌毒素的吸附具有一定的效果,但同样存在着对弱极性ZEN吸附效果不佳的问题[17,71]。且天然蒙脱土含有较多的杂质,层间有许多无机离子从而表现出亲水性,不利于其在聚合物基体的分散。为了改变这种现状,许多研究人员对其进行有机改性处理,以降低层间亲水性,增加亲油性,从而增强对有机物的亲和性[72-73]。在层间插入高分子链,可增大夹层间距,从而提高蒙脱土的吸附性能[11]。Nones等[41]用苯扎氯铵(BAC)和十六烷基三甲基溴化铵(CTAB)作为蒙脱土改性剂制备的吸附剂对AFB1表现较好的吸附,最优条件下吸附率分别达到76.9%和55.2%,这两种吸附剂的使用可能保护神经嵴干细胞免于AFB1引起的损伤。如图1[41]所示,AFB1的高吸附容量是由层间空间的增加引起的,改性后层间距分别从0.97 nm增加到1.23 nm(BAC)和1.22 nm(CTAB),并且AFB1分子占据了蒙脱土的层间空间,从而与金属形成复合物。
张立阳等[72]对季铵盐及金属离子改性蒙脱土吸附AFB1、ZEN能力进行了研究,改性后吸附能力大大增强。马文文等[73]以6种有机季铵盐作为改性剂对钠基蒙脱土进行改性同时进行吸附条件的优化来吸附花生油中的AFB1,结果表明十八烷基三甲基氯化铵改性后的蒙脱土吸附效果最好,最优吸附条件为:吸附温度53.79 ℃、吸附剂添加量为3.13%、吸附时间为29.46 min,在此条件下脱除AFB1效率达到了84.69%。骆翼等[74]使用十八烷基三甲基氯化铵及双十八烷基二甲基氯化铵对天然蒙脱土进行了有机改性处理,研究了其对ZEN的吸附作用,季铵盐改性的蒙脱土层间结晶水明显减少,结构更为疏松,对ZEN的吸附效率更好,且随着所用改性剂浓度的增加吸附效率逐渐提高。
Wang等[75]采用非离子表面活性剂辛基酚聚氧乙烯醚(OP-10)改性蒙脱土作为真菌毒素吸附剂。改性后在模拟胃肠道环境下对AFB1和ZEN的单一吸附能力分别从0.51 mg/g和不吸附增加到了2.78和8.54 mg/g。通过对吸附过程的研究,Langmuir模型可以最好地描述改性蒙脱土对AFB1的吸附,ZEN的吸附实验结果与线性模型相吻合。作者指出,极性真菌毒素AFB1被可交换阳离子通过离子-偶极相互作用以及有机碳链通过疏水相互作用共同吸附,对弱极性真菌毒素ZEN的吸附为疏水相互作用,见图2[75]。
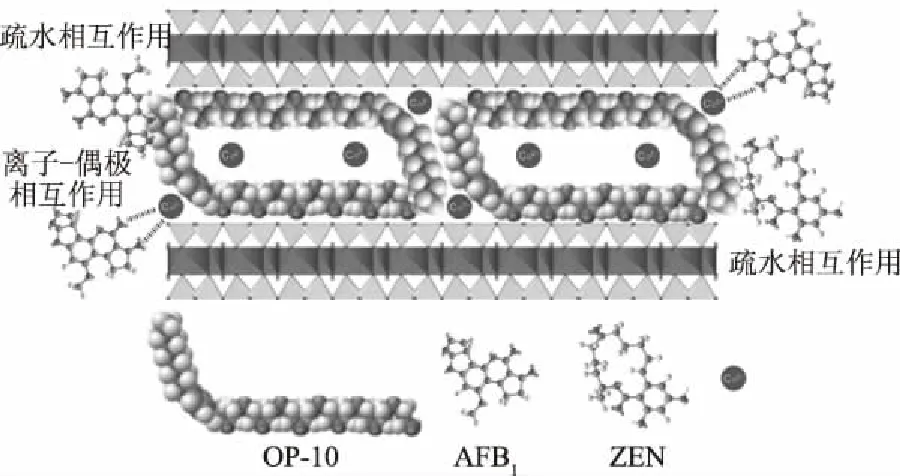
图2 有机蒙脱土对AFB1、ZEN的吸附机理Fig.2 Adsorption mechanism of organic montmorillonite on AFB1 and ZEN
2.3 其他吸附剂
其它的一些吸附剂,如硅藻土、凹凸棒石、石墨烯等对真菌毒素的吸附也有一定的效果。Sprynskyy等[77]在合成胃液和合成体液的环境下研究了硅藻土对ZEN的吸附能力,其吸附效率分别为53%和42%。梁晓维等[70]对凹凸棒石(ATP)在pH3、5、7时模拟胃肠道进行了吸附AFB1及ZEN的研究,在1 h吸附达到平衡,AFB1吸附率均>90%,但是解吸率很高,而对ZEN的吸附不足10%。因此并不适合在饲料中添加来进行解毒。Bai等[12]采用两亲分子二十二烷基二甲基溴化铵(DDAB)改性氧化石墨烯,研究了其在玉米油中对ZEN的吸附能力。在90 ℃时对ZEN的最大吸附量为23.75 mg/g,与其它碳质吸附剂相比其效果最好。通过对吸附过程的研究,发现在较低的温度(30 ℃)下,吸附过程与Freundlich模型相吻合,在较高温度下(50和60 ℃)与Langmiur模型更加吻合,表明ZEN的吸附是发生在表面与夹层之间同时进行的多重吸附过程。可能是由于作为电子受体的ZEN分子的官能团与改性后吸附剂的表面基团在体系中通过π-π键结合和氢键作用形成电子供体,从而实现对ZEN良好的化学吸附。
值得注意的是近年来许多研究表明,石墨烯由于其独特的晶体结构和单原子层的高比表面积使得其对于污水的净化,对重金属、含苯环类的有机物、农药等有害物质的吸附效果良好[78]。石墨烯作为一种极具潜力的吸附材料,更多的研究应致力于研究其对真菌毒素的吸附,以期开发出更加优异的真菌毒素吸附剂。
3 结论与展望
随着对真菌毒素研究的不断深入,为了降低真菌毒素的危害,诸多研究表明吸附剂具有广阔的应用前景。天然的吸附剂对于毒素的消减具有一定的效果,同时存在着吸附效果不理想、吸附选择性较差的问题。从研究结果来看,其改性产品表现出更加优异的性能,同时改性剂的成本以及是否会产生二次污染等问题都需要进一步研究论证。目前,吸附剂消减真菌毒素在饲料以及模拟环境中的研究较多,在油脂方面的研究较少,且更多的是对脱色过程中吸附效果的观察,却很少有对其机理的研究,相信随着对研究的不断深入,对吸附机理深度挖掘能更加有针对地高效解毒。同时更多的研究应充分考虑到实际应用的环境及影响因素,在模拟实验中探究对毒素及营养因子的影响,通过动物实验对其安全性做出评价,为工业化应用提供理论基础。
