蓝莓花青素微胶囊制备及其性质分析
2020-01-13郭娜朱桂兰刘兴运张方艳王子迎杨俊杰陈丽君
郭娜,朱桂兰,刘兴运,张方艳,王子迎,杨俊杰,陈丽君
(合肥师范学院 生命科学学院,安徽 合肥,230061)
花青素是一种黄酮类水溶性天然色素,具有抗氧化、延缓衰老等功能,在食品和化妆品等行业有巨大潜力,但其稳定性较差,易受温度、pH值、光照等条件影响,因而限制了其使用范围[1-3]。研究表明通过微胶囊技术包封、花青素酰基化和添加辅色剂等技术方法可以显著提高花青素的稳定性[4-7]。
GIUSTI[6]以海藻酸钠-果胶包裹紫玉米和蓝莓提取物,包埋处理明显降低了花青素色苷的光降解率。CHEN等[7]使用壳聚糖-硫酸软骨素包埋接骨木花青素,获得包埋率较高的微胶囊,并改善了花青素的抗氧化活性和贮藏稳定性。ELIF等[8]使用壳聚糖和明胶作为壁材,以黑胡萝卜提取物为芯材,制备微胶囊,并进行了体外释放实验,结果表明壳聚糖含量限制了黑胡萝卜花青素的释放[8]。陈虎等[9-13]研究了玫瑰花、黑米花青素的包埋,分别优化了其工艺条件,对微胶囊工艺优化和探索花青素微胶囊稳定性有重要意义。
微胶囊技术能够提高花青素的稳定性和控制其释放作用,是比较流行的一种包埋手段[5,7,14-19]。本论文采用锐孔法制备蓝莓花青素微胶囊,并进行体外模拟释放和贮藏稳定性研究,以期提高蓝莓花青素稳定性,为蓝莓花青素的应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
蓝莓果,合肥师范学院蓝莓基地;矢车菊素-3-葡萄糖苷标准品,合肥博美生物科技有限责任公司;海藻酸钠,青岛明月海藻集团有限公司;胃蛋白酶,上海聚源生物科技有限公司;CaCl2,天津博迪化工股份有限公司。
1.2 仪器与设备
UV-1800紫外可见分光光度计,岛津有限公司;S4800扫描电子显微镜,日本日立公司;LGJ-10真空冷冻干燥机,北京松源华兴科技发展有限公司;HH-4数显恒温水浴锅,金坛市杰瑞尔电器有限公司;DHZ-DA恒温振荡器,苏州市培英实验设备有限公司;PHS pH计,上海仪电科学仪器股份有限公司;SHZ-D3真空泵,上海鹏奕仪器有限公司。
1.3 实验方法
1.3.1 花青素含量测定
以矢车菊素-3-葡萄糖苷作为花青素标准品,测定其标准曲线[12]。
准确称取矢车菊素-3-葡萄糖苷,用V(HCl)∶V(甲醇)=1∶9,定容,得到质量浓度为5.0、10.0、15.0、20.0及25.0 μg/mL的标准溶液,然后在520 nm波长下测其吸光度。以吸光度(A)为纵坐标,矢车菊素-3-葡萄糖苷浓度(C)为标准曲线的横坐标,线性拟合得到标准曲线方程:
C=47.518A+1.352 7,R2=0.994 1
(1)
式中:A为520nm处吸光度;C为花青素质量浓度(μg/mL)。
1.3.2 蓝莓花青素微胶囊制备
蓝莓果经粉碎,过60目筛,在体积分数70%乙醇提取2 h,过滤并40 ℃旋转蒸发浓缩,浓缩液经冷冻干燥获得蓝莓花青素冻干粉,4 ℃保存。
芯材:使用蓝莓花青素冻干粉配制成质量浓度0.73 g/L的溶液。
壁材:分别称取不同质量的海藻酸钠,加水溶解,60 ℃下水浴并搅拌至完全溶解,冷却至室温后定容,配制成1.0、1.5、2.0、2.5、3.0 g/100 mL质量浓度的海藻酸钠溶液。
按照芯材溶液和壁材溶液体积比为1∶1、1∶2、1∶3、1∶4、1∶5、1∶6混合均匀,避光静置消泡,得到芯壁材混合溶液。
用不同针头孔径的无菌注射器进行造粒制珠,将芯壁材混合溶液缓慢滴入到一定质量浓度的CaCl2溶液中,形成圆形微胶囊颗粒[13]。
微胶囊颗粒经过循环式真空泵抽滤至无水滴落,用蒸馏水洗涤3次并进行抽滤。在520 nm波长下测量滤液的吸光度,并根据花青素的标准曲线计算出滤液中花青素含量,按公式(2)计算出蓝莓花青素微胶囊化的包埋率。以矢车菊素-3-葡萄糖苷作为花青素标准品,测定其标准曲线[12]。
(2)
式中:W,蓝莓花青素包埋率,%;C1,原液花青素质量浓度,g/L;V1,原液体积,mL;C2,滤液花青素质量浓度,mg/mL;V2,滤液体积,mL。
1.3.3 蓝莓花青素微胶囊体外模拟试验
准确移取制备的蓝莓花青素微胶囊,分别加入到60 mL胃模拟液和60 mL小肠模拟液中[5,18]。在水浴恒温振荡器中37 ℃,65 r/min条件下反应,每隔0.5 h测1次吸光度,按公式(3)计算花青素释放率。
(3)
式中:δ,蓝莓花青素释放率,%;C3,原液花青素的质量浓度,g/L;V3,原液体积,mL;C4,模拟液花青素质量浓度,mg/mL;V4,模拟液体积,mL;W,蓝莓花青素包埋率,%。
1.3.4 蓝莓花青素微胶囊稳定性试验
1.3.4.1 pH对蓝莓花青素微胶囊影响
准确称取负载有等量花青素的微胶囊与花青素粉末,分别置于20 mL不同pH值的缓冲液中,记录溶液随时间的颜色变化,并分析2 d后的花青素保存率。花青素保存率按照公式(4)计算:
(4)
式中:η,蓝莓花青素保存率,%;A0,处理前吸光度;A1,处理后吸光度。
1.3.4.2 温度对蓝莓花青素微胶囊影响
准确称取负载有等量蓝莓花青素的微胶囊,分别置于pH值为3.0的缓冲液中,缓冲液体积为60 mL,分别置于10、20、40、70、95 ℃条件下,每隔30 min测定花青素含量,按公式(4)计算花青素保存率。
1.3.5 蓝莓花青素微胶囊电镜分析
取适量负载蓝莓花青素微胶囊固定并喷金处理,观察其放大800倍的表面结构。
1.3.6 数据统计与分析
采用软件Origin 8.5和SPSS 24进行分析,结果用平均值±标准差来表示,每组试验平行3次。
2 结果与分析
2.1 蓝莓花青素微胶囊制备
2.1.1 芯壁材比例与海藻酸钠对微胶囊包埋率的影响
芯壁材比例(V∶V)与海藻酸钠质量浓度对蓝莓花青素微胶囊化包埋率影响如图1所示。

图1 芯壁材比例和海藻酸钠浓度对微胶囊化包埋率影响Fig.1 Effect of ratio of core material to wall material and sodium alginate on the encapsulation rate of microcapsules
由图1分析可知,芯壁材比例和海藻酸钠浓度对蓝莓花青素微胶囊化的包埋率影响显著(P<0.05)。花青素微胶囊化包埋率随芯壁材比例增大先升高后下降,且芯壁材体积比为1∶2时,蓝莓花青素微胶囊包埋的效率达到最高值84.00%。这可能是芯壁材比例较大时,混合溶液较稀,制备的微胶囊呈扁圆形、质地松软,包埋花青素效率低;芯壁材比例较小时,溶液较黏稠,所需固化时间长,使得蓝莓花青素溶于固化液,蓝莓花青素的包埋率较低,且成型效果差,微胶囊易拖尾。因而蓝莓花青素的微胶囊化宜选择的芯壁材最佳比例为1∶2。
随着海藻酸钠质量浓度增大,蓝莓花青素微胶囊化包埋率升高。当海藻酸钠质量浓度为1.5 g/100 mL时,蓝莓花青素微胶囊化包埋率达到峰值,为87.00%,微胶囊颗粒均匀,整体外观为球状。海藻酸钠质量浓度超过1.5 g/100 mL时,蓝莓花青素微胶囊化包埋率下降显著,可能是海藻酸钠浓度较高导致其溶液黏度大,流动性变差,制备难度增加,微胶囊拖尾现象明显,影响微胶囊的成型,从而使得蓝莓花青素包埋率下降,这一结果与杨艳等[16]制备的微胶囊的针头孔径影响规律基本一致。
2.1.2 CaCl2与针孔尺寸对微胶囊包埋率影响
CaCl2与针孔尺寸对蓝莓花青素微胶囊化的包埋率影响均显著(P<0.05),其结果如图2所示。蓝莓花青素微胶囊化的包埋率随CaCl2浓度的增加而提高,当CaCl2为1.5 g/100 mL时,蓝莓花青素的包埋率达到最大值为89.37%;继续增大浓度后,蓝莓花青素微胶囊化包埋率反而降低。这可能是由于CaCl2浓度影响微胶囊成型效果,CaCl2浓度较低时制备的微胶囊产品质地松软,极易破碎,而浓度较高时,形成海藻酸钙层结构较为致密,但内部网络结构分布不均匀[10],也不利于微胶囊产品的干燥加工。
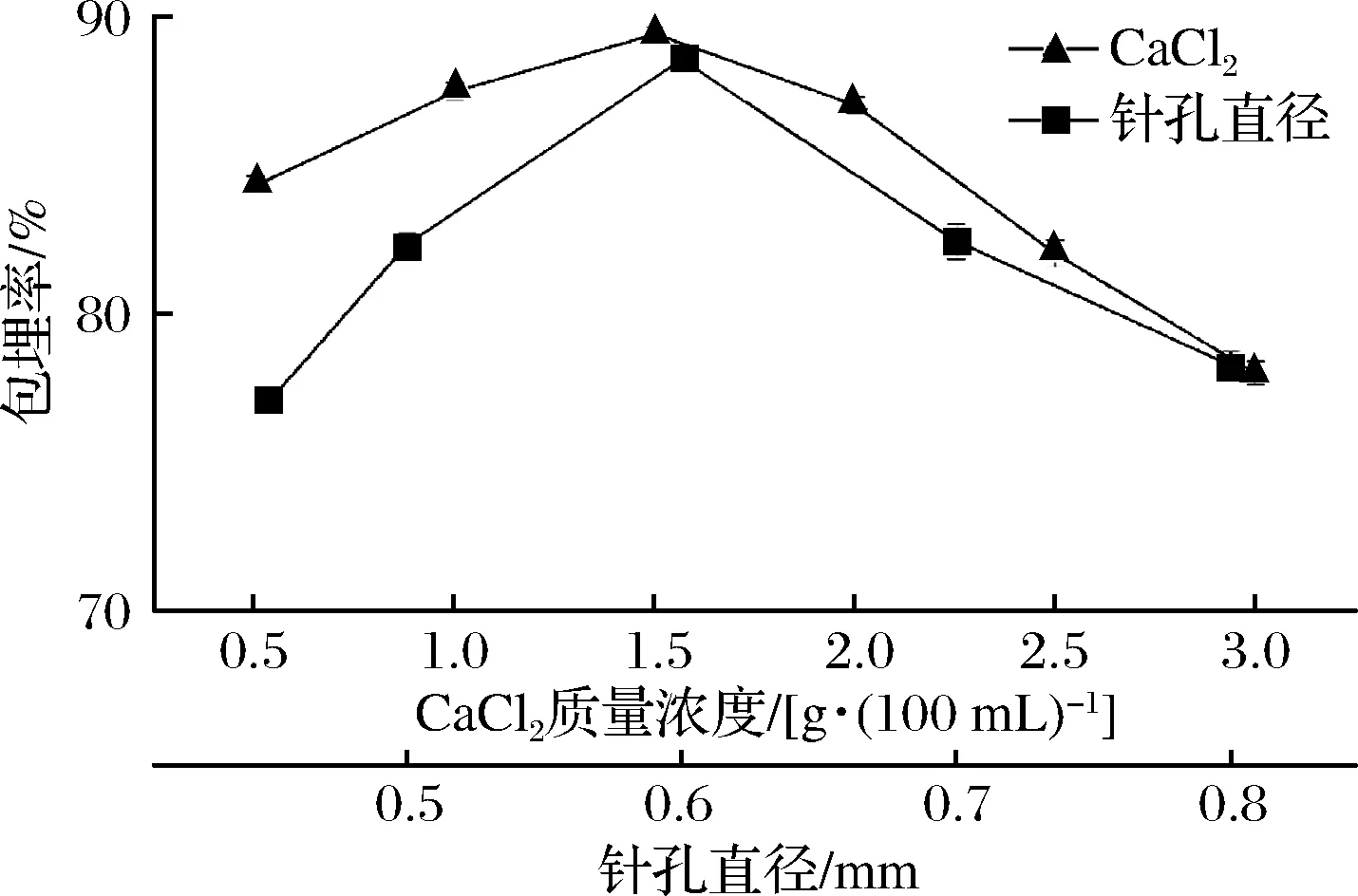
图2 CaCl2与针孔尺寸对微胶囊化包埋率影响Fig.2 Effect of CaCl2 and needle diameter on the encapsulation rate of microcapsules
针头孔径影响制备的微胶囊直径大小,也直接影响微胶囊的包埋率。随着针头孔径增大,蓝莓花青素微胶囊化的包埋率增加,针头孔径为0.60 mm时,蓝莓花青素微胶囊包埋率达到最大值88.58%;针头孔径继续增大时,蓝莓花青素微胶囊化的包埋率反而下降,这可能是由于针头孔径增大使微胶囊表面积增大,从而可以容纳更多的花青素,但微胶囊在CaCl2溶液中固化时间增长,蓝莓花青素溢出的量增加,从而降低了包埋率。综上分析可知,最佳制备蓝莓花青素微胶囊的注射器针头孔径为0.60 mm。
综上可知,蓝莓花青素微胶囊最佳试验组合方案为芯材和壁材比例为1∶2、海藻酸钠质量浓度1.5 g/100 mL、CaCl2浓度1.5 g/100 mL、针头孔径0.60 mm。对最佳条件进行验证,结果表明该试验条件下蓝莓花青素微胶囊包埋率达到90.17%。
2.2 花青素微胶囊扫描电镜
由图3扫描电镜图可知,蓝莓花青素微胶囊外观呈球状,微胶囊外观除部分凹凸不平和塌陷外,整体饱满充实完整,其表面光滑连续性好,无破裂现象和裂痕出现,表明海藻酸钠用作包埋蓝莓花青素的壁材,可以起到很好的支撑作用。

图3 花青素微胶囊微观结构Fig.3 SEM of the anthocyanin microcapsule
2.3 蓝莓花青素体外模拟试验
由图4可知,蓝莓花青素微胶囊在模拟胃液环境中性质稳定,并且蓝莓花青素释放率低。蓝莓花青素微胶囊在胃模拟液中的花青素在0~2 h时释放率升高,2 h以后,花青素的释放率保持平缓,释放率达到最高值25.17%。在小肠液体外模拟试验中,花青素释放率在4 h时,花青素基本完全释放,继续延长时间,花青素释放率趋于平稳,微胶囊花青素的释放率最高89.26%。

图4 蓝莓花青素微胶囊产品体外模拟释放试验Fig.4 Release curve of the anthocyanin microcapsule in vitro
综上分析可知,海藻酸钠作为1种肠溶性壁材,有较好的耐酸性和肠溶性,可以起到控制花青素缓释的作用。这一结果也与玫瑰茄花色苷微胶囊的释放性规律一致[19]。
2.4 蓝莓花青素微胶囊稳定性试验
2.4.1 pH值对蓝莓花青素微胶囊影响
pH值对蓝莓花青素微胶囊和稳定性影响如图5和图6所示。

a-花青素微胶囊;b-花青素粉末;上排为初始,下排为2 d后图5 pH值对蓝莓花青素贮藏前后色泽的影响Fig.5 Effect of pH on color of blueberry anthocyanin before and after storage

图6 pH值对蓝莓花青素的贮藏稳定性影响Fig.6 Effect of pH on storage stability of blueberry anthocyanin
由图5可知,在pH值为3~12的缓冲液中,蓝莓花青素微胶囊溶液颜色差异显著(P<0.05),这是由于蓝莓花青素分子在不同pH值条件下结构发生改变,从而使溶液色泽发生变化。在pH值为3~6时,以红色的黄烊盐阳离子形式存在,随着pH值增大逐步转变成无色的假碱和查尔酮形式存在,pH>7后花青素以蓝色醌型碱形式存在[20],因而花青素在不同溶液中色泽不同,且其吸光度呈现先下降后上升的趋势。常温贮藏2 d后,不同pH值条件下的微胶囊和粉末的花青素稳定性如图6所示。在pH值为3和8时,花青素微胶囊和花青素粉末状保存率较高,且微胶囊后的花青素保存率高于粉末状组,由此可知,花青素经胶囊处理可以提高其稳定性。花青素粉末在pH>8后,保存率下降,可能是花青素在强碱条件下发生降解所致。微胶囊化的花青素在pH值为9时仍有较高保存率,也说明了经过微胶囊化处理可以提高花青素的稳定性范围。
2.4.2 温度对蓝莓花青素微胶囊的影响
如图7所示,不同温度下的花青素微胶囊稳定性显著不同(P<0.05)。在环境温度低于20 ℃时,蓝莓花青素较稳定,随着时间延长,蓝莓花青素微胶囊的保存率基本保持不变;当温度高于20 ℃时,微胶囊中蓝莓花青素发生降解,花青素的保存率明显下降;温度越高,蓝莓花青素降解速度越快,花青素的保存率越低。在温度达到95 ℃,加热3.0 h后,微胶囊中花青素的保存率下降到17.91%,同时对比未包埋组的花青素,可以看出花青素经微胶囊处理后的保存率高于粉末状花青素组数据,说明蓝莓花青素经微胶囊处理后对热的稳定性有所提高。

图7 温度对蓝莓花青素贮藏稳定性影响Fig.7 Effect of temperature on storage stability of anthocyanin
3 结论
蓝莓花青素微胶囊的制备以花青素微胶囊化包埋率为指标,通过单因素试验,确定蓝莓花青素微胶囊制备最佳工艺条件为:芯材与壁材体积比为1∶2、海藻酸钠质量浓度1.5 g/100 mL、CaCl2质量浓度1.5 g/100 mL、针头孔径0.60 mm,此条件下制备的蓝莓花青素微胶囊包埋率最高。扫描电镜显示蓝莓花青素微胶囊,其表面光滑完整,整体呈球状结构,微胶囊大小均匀。
蓝莓花青素微胶囊体外模拟结果表明,以海藻酸钠为壁材制备的蓝莓花青素微胶囊有控制缓释的作用,具有良好的耐酸性和肠溶性。在模拟胃液环境中,花青素的释放率低,持续释放2 h达到稳定,释放率达到25.17%;在模拟小肠液环境中,4 h内花青素持续释放,释放率达到89.26%。
稳定性试验表明经微胶囊处理后的花青素对pH值和温度稳定性均有提高。
