水稻半外卷叶突变体sol1的表型分析与基因定位
2020-01-02谢园华李凤菲马晓慧夏赛赛桑贤春杨正林凌英华
谢园华 李凤菲 马晓慧 谭 佳 夏赛赛 桑贤春 杨正林 凌英华
水稻半外卷叶突变体的表型分析与基因定位
谢园华**李凤菲**马晓慧 谭 佳 夏赛赛 桑贤春 杨正林 凌英华*
西南大学水稻研究所 / 转基因植物与安全控制重庆市重点实验室, 重庆 400715
适度卷曲有利于提高水稻叶片的光合效率, 增加植株光合产物的有效积累量。我们利用甲基磺酸乙酯(EMS)处理籼型水稻保持系西农1B, 获得一个稳定遗传的水稻半外卷叶突变体。该突变体从十叶期开始各叶片逐渐向外卷曲直至半卷状, 并伴随茎秆半矮化和叶片披垂, 暂被命名为()。与野生型(WT)相比,的叶片卷曲指数均达到30%以上(<0.01); 倒一、倒二、倒三、倒四节节间长度和穗长极显著缩短, 倒一、倒二、倒三叶的叶夹角显著或极显著增加; 有效穗数、千粒重、每穗实粒数、结实率显著或极显著下降, 一次枝梗数则增加11.3% (<0.05)。的蒸腾速率、胞间CO2浓度、气孔导度显著高于野生型。石蜡切片显示,倒一叶的泡状细胞体积变小, 数量显著增多, 表皮细胞体积略微增大。遗传分析表明,的半外卷叶性状受1对隐性核基因调控, 定位于6号染色体标记JY6-3和JY6-10之间165 kb的物理范围内, 共含15个注释基因。qRT-PCR结果表明, 与泡状细胞相关的内卷基因和外卷叶基因在突变体中呈不同程度的上调,、、、、则呈不同程度的下调。研究结果为基因的克隆和功能研究奠定了基础。
水稻(L.); 半外卷突变体; 表型鉴定; 基因定位; 泡状细胞
水稻株型改良对水稻理想株型的形态建成以及提高水稻产量表现具有重要作用[1]。叶型为株型改良性状的重要组成部分, 在水稻植株营养生长的中后阶段, 叶片的适度卷曲可降低群体消光系数, 提高植株的光能利用率, 促进光合产物的积累, 从而增加稻谷产量[2]。
在叶的形态建成中, 叶原基从顶端分生组织中的周边区分化发育后, 进一步沿3个不同的方向极性分化, 即基-顶轴分化(proximo-distal axis polarization), 中-边轴分化(centrol-lateral axis polarization), 近-远轴分化(adaxial-abaxial axis polarization), 从而构成叶片三维体轴, 其中对叶片近-远轴分化发育相关的基因报道很多[3]。水稻叶片卷曲是一个复杂的生物学过程, 受多基因调控, 包括-家族成员、家族成员等。()基因家族编码由同源异型框-亮氨酸拉链所组成的一典型转录因子家族, 水稻中有、、、、[4]水稻中的()基因家族成员——基因通过调控细胞程序性死亡(PCD)过程进而影响近-远轴面的发育, 编码一类MYB类家族转录因子, 属于GARP蛋白家族[2]。基因家族与在侧生器官近远轴面极性建立方面起重要协调作用, 主要是通过miRNA来构成相互抑制的调控网络[5]。
目前在水稻中已定位或克隆的卷叶基因超过30个, 在12条染色体上均有分布, 其中经典的卷叶基因有、、、、、等[6]。已报道基因如[7-8]、[9]、[10]、[11][12]、[13]等的研究结果显示, 泡状细胞是造成叶片卷曲的重要原因。此外, 其他因素如叶肉细胞的排布及角质层的形成等也会引起叶片卷曲。如基因通过影响厚壁组织和叶肉细胞调控远轴面的发育, 进而改变叶型[2]。内卷突变体是60Coγ射线诱变中花11粳稻品种导致正常株厚壁细胞的位置被占据并影响叶绿体片层基粒排布而形成的[14]。基因是通过抑制角质层发育的关键基因和的表达, 导致突变体中叶片角质层发育受到影响, 叶片表现卷曲[15]。
本研究从籼型水稻保持系西农1B的EMS突变体库中, 鉴定到一个半外卷叶突变体(-)。初步表型鉴定表明,从十叶期至成熟期, 叶片向远轴面逐渐卷曲, 且各叶片出现不同程度的披垂。本研究对的表型鉴定、光合特性分析、细胞学分析、遗传特性分析和基因精细定位等, 为后续基因的克隆和功能研究奠定了良好基础。
1 材料与方法
1.1 研究材料
经EMS诱变自育籼型保持系西农1B, 构建了相应的突变体库。通过筛选和连续多代自交, 从该突变体库中鉴定到性状稳定遗传的水稻半外卷叶突变体。将实验室自育恢复系缙恢10号与杂交, 利用F1和F2群体进行遗传分析, 明确目标性状的遗传特性; 并利用F2群体进行目标基因的精细定位。
1.2 表型分析
大田种植和西农1B (WT), 鉴定其全生育期植株表型。于成熟期, 随机选取长势一致的与WT 各10株, 考察其叶长、叶宽、有效穗数、一次枝梗、二次枝梗、千粒重、每穗粒数、倒一、倒二、倒三、倒四节节间长度、穗长等性状。
于拔节期, 随机选取长势一致的和WT各10株, 分别测其倒一(the 1st leaf from the top, Top 1)、倒二(the 2nd leaf from the top, Top 2)、倒三(the 3rd leaf from the top, Top 3)叶的叶夹角(茎秆与主叶脉之间的角度), 以及倒一、倒二、倒三叶叶片最宽处卷曲时的宽度(n)和展开后的宽度(w), 计算卷曲指数[LRI = (w–n)/w× 100%][16]。
1.3 细胞学分析
随机选抽穗期和WT各10株, 分别取其倒一叶片相同部位, 于FAA固定液(50%乙醇∶0.9 mol L–1冰乙酸∶甲醛 = 90∶5∶5)中固定, 依次经乙醇脱水, 二甲苯透明, 石蜡包埋, 切片, 番红-固绿对染, 最后在NIKON E6000显微镜下照相观察[17]。
1.4 光合效率分析
大田期间, 于乳熟期随机选取与WT各3株, 用Li-6400型便携式光合测定仪测定净光合速率(n, μmol m–2s–1)、蒸腾速率(r, mmol m–2s–1)、胞间CO2浓度(i, μmol mol–1)与气孔导度(s, mmol m–2s–1)等光合参数, 分析与WT植株的光合效率。
1.5 基因定位
参照Michelmore等[18]的BSA法筛选连锁标记, 从F2植株中分别选取10株正常株和10株突变株剪取等量叶片, 构建正常基因池和突变基因池, 采用改良的CTAB法分别提取亲本和F2群体的基因组DNA, 利用本实验室筛选的均匀分布于水稻12条染色体上的SSR和InDel分子标记, 同时结合数据库(http://www.gramene.org/microsat)和Vector NTI Advance 10 软件开发新的SSR和InDel分子标记, 进行目标基因定位。
1.6 RNA提取与qRT-PCR分析
选取长势一致的野生型和突变体各3株, 提取植株叶片的总RNA (RNA prep pure Plant Kit, Tiangen Co. Ltd., China), 并以之为模板反转录为cDNA (Prime Script 1st Strand cDNA Synthesis Kit, TaKaRa)。采用quantitative Real-time PCR (qRT-PCR)方法测量泡状细胞相关的内卷基因和外卷相关基因在野生型和突变体植株中的表达情况。
2 结果与分析
2.1 表型鉴定
与WT相比,从十叶期开始叶片表现出轻微的向外卷曲, 随着生育进程其叶片外卷逐渐明显, 且在叶片未完全抽出时叶片基部就表现向远轴面卷曲和褶皱, 叶中上部位则只表现向外卷曲, 同时从苗期至成熟期出现叶片披垂和茎秆半矮化(图1-A~H)。拔节期倒一、倒二、倒三叶的卷曲指数分别为34.83%、40.66%、31.75%, 均极显著高于野生型(5%~6%) (图1-I)。成熟期的倒一、倒二、倒三、倒四节的节间长度和穗长较WT分别缩短13.68%、25.82%、34.00%、29.77%和30.77% (<0.01)(图1-J, K)。拔节期的倒一、倒二、倒三叶的叶夹角较WT分别增大了74.82%、19.20%、39.86% (图1-L)。
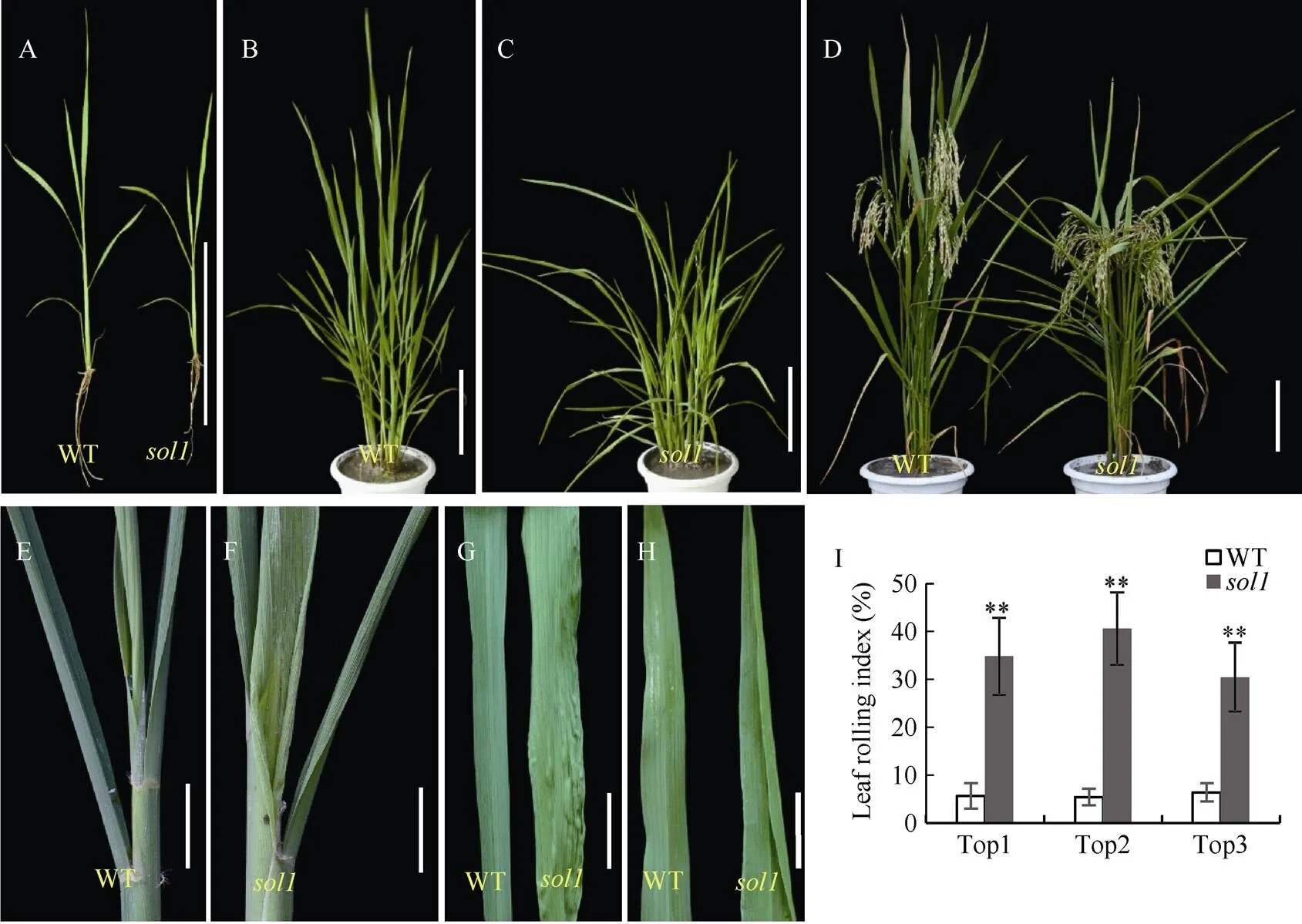
(图1)
A、B、C、D: 分别代表WT与的五至六叶期、分蘖期、成熟期表型; E、F: 分别为WT与未完全抽出时的叶基部; G: WT与倒一叶近轴面基部; H: WT与倒一叶远轴面叶尖; I: WT与拔节期叶片卷曲指数; J: WT与穗长及各节间长; K: 成熟期WT与的各节间比较; L: WT与拔节期叶夹角。图A、B、C、D、J中, Bar = 10 cm; 图E、F、G、H中, Bar = 2 cm。Top 1: 叶片顶端往下第一片叶; Top 2: 叶片顶端往下第二片叶; Top 3: 叶片顶端往下第三片叶。*: 在0.01 ≤< 0.05区间差异显著, **:< 0.01差异极显著。
A, B, C, D: plant phenotypes of WT andat the 5-6 leaf stage, the tillering stage and the mature stage, respectively; E and F: incompletely extracted leaf base of WT and, respectively; G: bases of the abaxial top 1 of WT and; H: tips of the adaxial top 1 of WT and; I: leaf curl indexes of WT andat jointing stage; J: lengths of the spike and internodes of WT and; K: comparison of the internodes of WT andat mature period; L: leaf angles of WT andat the shooting period. Bar = 10 cm, in A, B, C, D, J diagrams; Bar = 2 cm, in E, F, G, H diagrams. Top1: the 1st leaf from the top; Top2: the 2nd leaf from the top; Top3: the 3rd leaf from the top. * means significant difference at 0.01 ≤< 0.05 by-test; ** means significant difference at< 0.01 by-test.
与WT相比, 孕穗期突变体倒一叶叶长无明显变化、叶宽较WT显著增加7.27%; 倒二叶叶宽无变化, 叶长显著缩短9.17%; 而倒三叶的叶长、叶宽则显著或极显著变短、变窄, 较WT分别降低35.76%和11.56% (图2-A, B)。与WT相比, 突变体除每穗粒数、二次枝梗数无显著差异外, 其有效穗数、千粒重、结实率均显著或极显著减少, 一次枝梗数则显著增多(图2-C~H)。
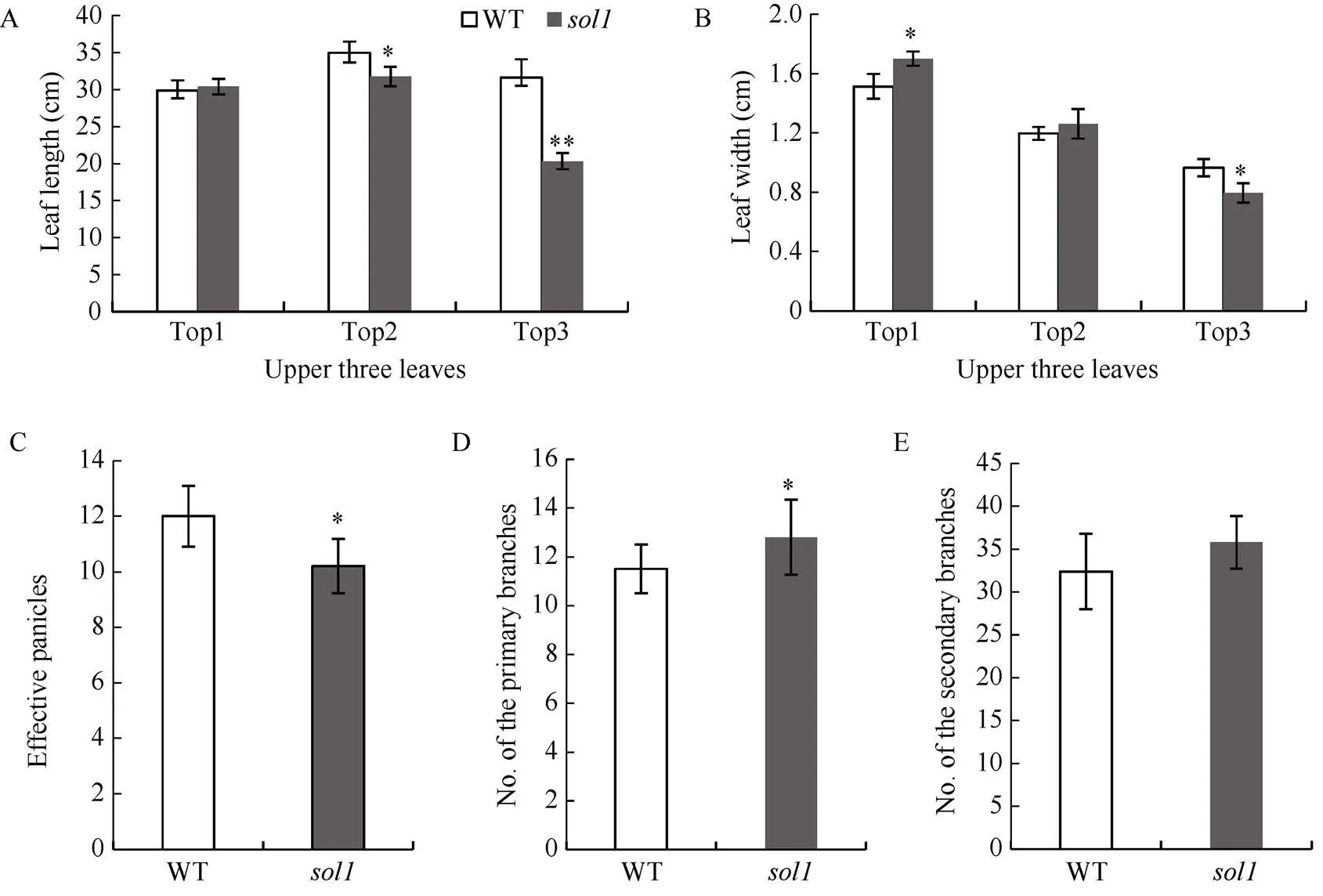
(图2)
A、B: 孕穗期倒一、倒二、倒三叶叶长及叶宽(cm); C: 有效穗数; D: 一次枝梗; E: 二次枝梗; F: 千粒重(g); G: 每穗实粒数; H: 结实率(%)。倒一叶: 叶片顶端往下第一片叶; 倒二叶: 叶片顶端往下第二片叶; 倒三叶: 叶片顶端往下第三片叶。*: 在0.01 ≤< 0.05区间差异显著, **:<0.01差异极显著。
A, B: length and width of tops 1, 2, 3 at booting stage (cm); C: numbers of effective panicles; D: primary branches; E: secondary branches; F: 1000-grain weights (g); G: filled grain numbers per panicle; H: Seed setting rate (%); Top 1:the 1st leaf from the top; Top 2: the 2nd leaf from the top; Top 3: the 3rd leaf from the top. * means significant difference at 0.01 ≤< 0.05 by-test; ** means significant difference at< 0.01 by-test.
2.2 sol1的光合效率分析
突变体的净光合速率除倒二叶与野生型的差异无统计学意义外, 倒一、倒三叶均极显著下降;的蒸腾速率、胞间CO2浓度、气孔导度均显著或极显著高于野生型。r较WT分别增加了161.52%、211.12%、82.08%, 差异均达到极显著水平;i均极显著上升; 倒一、倒二、倒三叶叶尖、叶基部s均极显著或显著增加(图3-A~D)。由此说明可能是上三叶叶型的改变引起光合特性参数的变化, 进而影响光能利用率和光合作用效率。
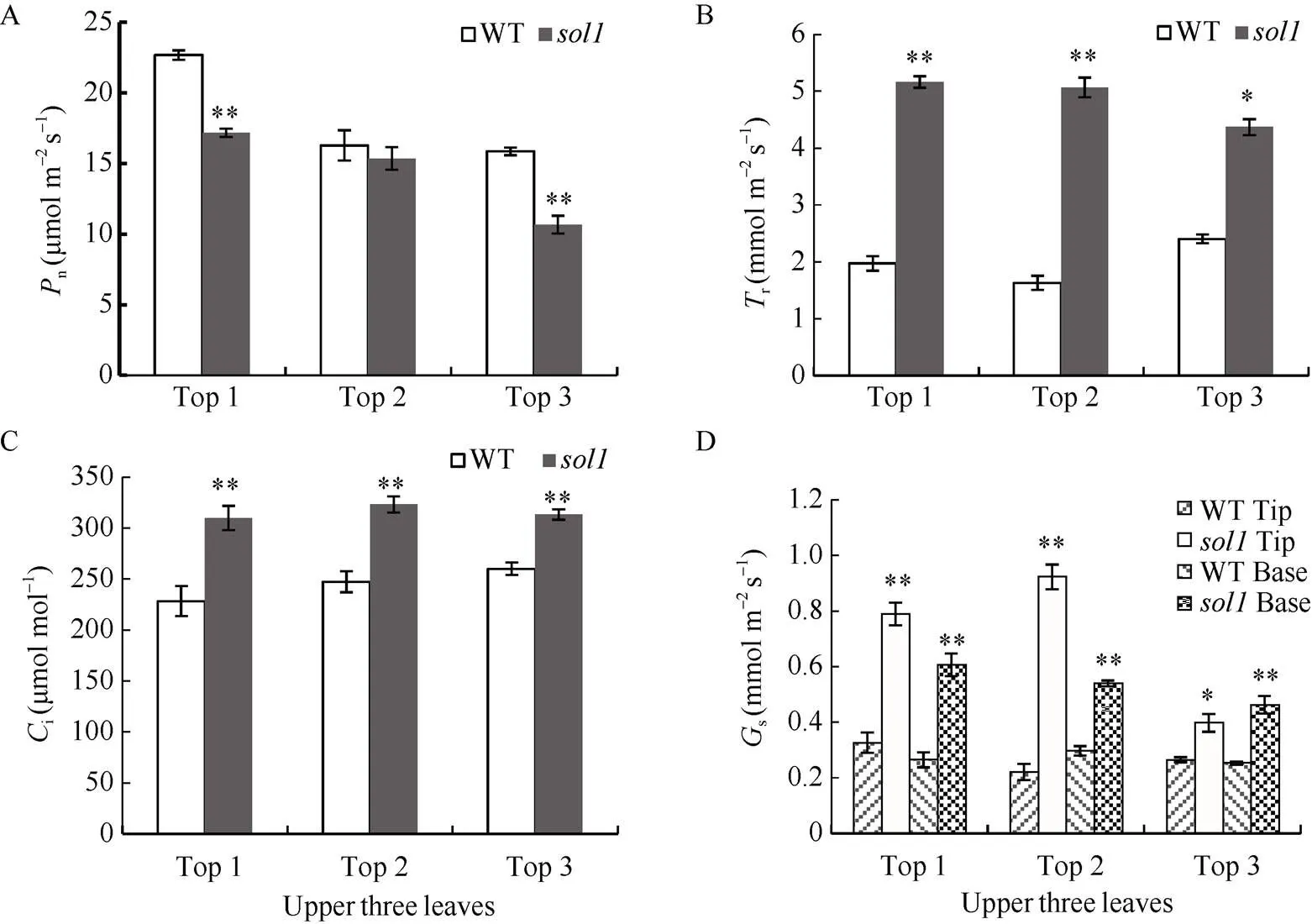
图3 乳熟期野生型(WT)与突变体sol1叶片光合效率分析
A: 倒一、倒二、倒三叶净光合速率(n); B: 倒一、倒二、倒三叶蒸腾速率(r); C: 倒一、倒二、倒三叶胞间CO2浓度(i); D: 倒一、倒二、倒三叶叶尖、叶基气孔导度(s)。Top 1: 叶片顶端往下第一片叶; Top 2: 叶片顶端往下第二片叶; Top 3: 叶片顶端往下第三片叶。*: 在< 0.05水平上差异显著, **: 在< 0.01水平上差异显著。
A: net photosynthetic rate (n) of tops 1, 2, 3; B: transpiration rate (r) of tops 1, 2, 3; C: intercellular CO2concentration (i) of tops 1, 2, 3; D: stomatal conductance (s) of the tip and base of tops 1, 2, 3. Top 1:the 1st leaf from the top; Top 2: the 2nd leaf from the top; Top 3: the 3rd leaf from the top. * significant difference at< 0.05; ** significant difference at< 0.01.
2.3 sol1叶片的细胞学分析
石蜡切片观察抽穗期倒一叶横切面, 发现叶片向远轴面呈不对称卷曲, 而WT则基本平直展开(图4-A, B)。进一步放大观察, 发现相邻维管束之间的泡状细胞向内凹陷并变小, 其数量和总面积较WT分别增加了38.88%和34.83%, 差异达显著水平(图4-C~H)。此外, 叶片上下表皮细胞略微增大, 泡状细胞下的叶肉细胞厚度略变薄。因此, 突变体叶片外卷可能是其表皮泡状细胞异常所致。
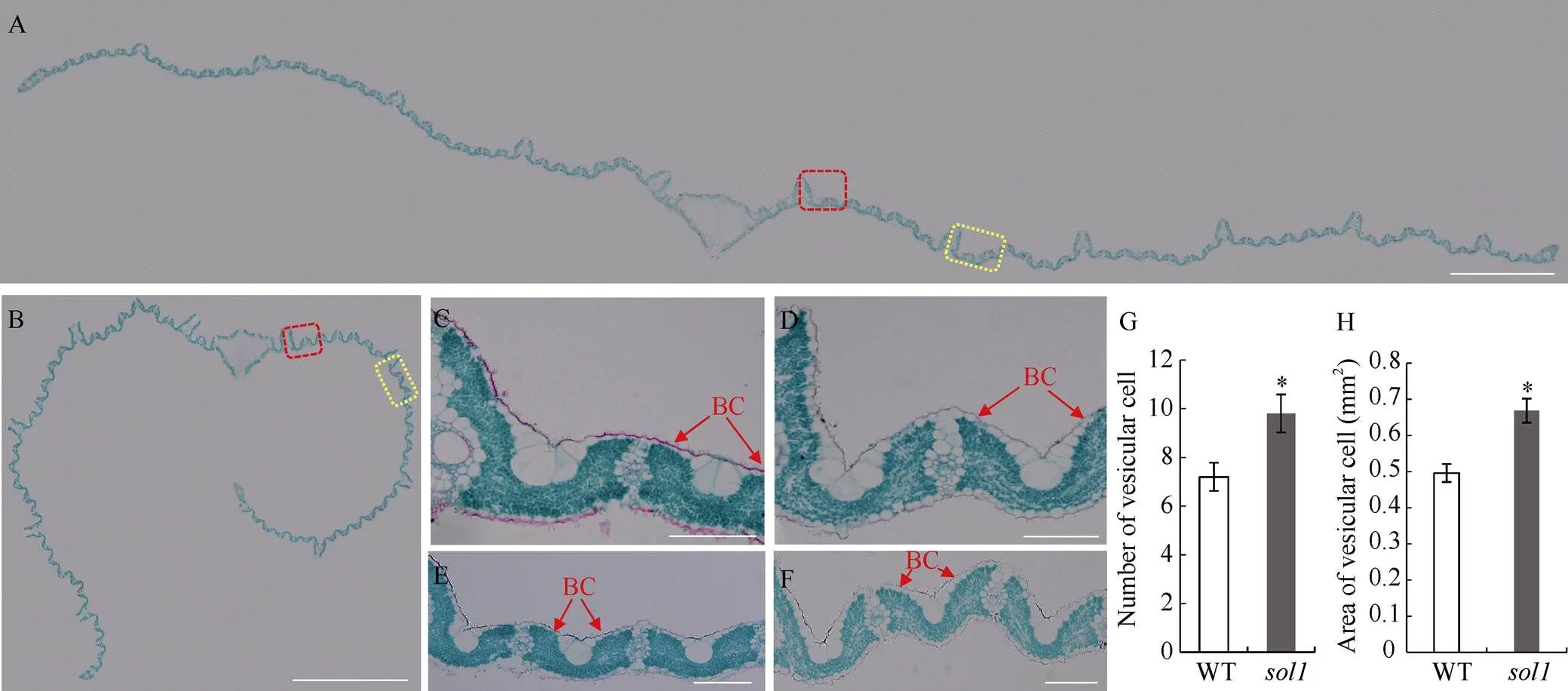
图4 叶片横切面石蜡切片分析
A、B: 分别为抽穗期WT和倒一叶横切图, Bar = 1 mm; C、D: 分别为A、B图中红色线框的放大图; E、F: 分别为A、B图中黄色线框的放大图, Bar = 0.1 mm; G: 两小维管束之间的泡状细胞数量; H: 两小维管束之间的泡状细胞面积。BC: 泡状细胞, *: 在0.01 ≤< 0.05区间差异显著。
A, B: cross cutting diagrams of top 1 of WT andat the heading stage, respectively, Bar = 1 mm; C, D: magnified diagrams of a red box in picture A and B, respectively; E, F: magnified diagrams of a yellow box in picture A and B, respectively, Bar = 0.1 mm; G: number of bulliform cells between two small vein; H:area of bulliform cells between two small vein. BC: bulliform cell. * means significant difference at 0.01 ≤< 0.05 by-test.
2.4 遗传分析
以缙恢10号为父本,为母本, 杂交后F1代表型正常; F2单株则出现正常表型和半外卷表型。在调查的4251个F2单株中, 正常表型3226株, 突变表型1025株。χ2检验结果显示, 该F2群体中正常株与突变株分离比为3.25, 符合3﹕1的理论比例(χ2= 1.74<χ20.05, 1= 3.84), 因此可以推断出的目标性状受1对隐性核基因控制。
2.5 基因定位
利用本实验室筛选的、均匀分布在水稻12条染色体上的400多个SSR标记和98个InDel标记, 筛选西农1B和缙恢10号的多态性。筛选出96个多态性标记用于扩增亲本及正常表型基因池和突变表型基因池, 发现6号染色体短臂上的RM204标记在这2个基因池之间存在稳定差异, 预测该标记可能与基因连锁。进一步利用F2单株验证, 确定了RM204与的连锁。在RM204附近查找并开发新标记, 最终将基因初步定位在RM204和ZTQ54之间, 遗传距离分别为13.07 cM和19.28 cM (图5)。
进一步开发初步定位区间的InDel标记, 筛选出ZZC6-6、JY6-7、JY6-4、JY6-3、JY6-10等标记(表1)在与缙恢10号之间存在多态性。利用这些新开发的多态性标记对F2突变单株进行基因型鉴定, 结果显示ZZC6-6、JY6-7、JY6-4、JY6-3、JY6-10这5个标记在490个随机选取的F2单株中, 前4个标记分别检测到9、5、3、2个交换单株, 后1个标记检测到4个交换单株, 且两侧的交换单株不同, 从而最终将基因定位在JY6-3和JY6-10之间165 kb的物理距离内(图5)。
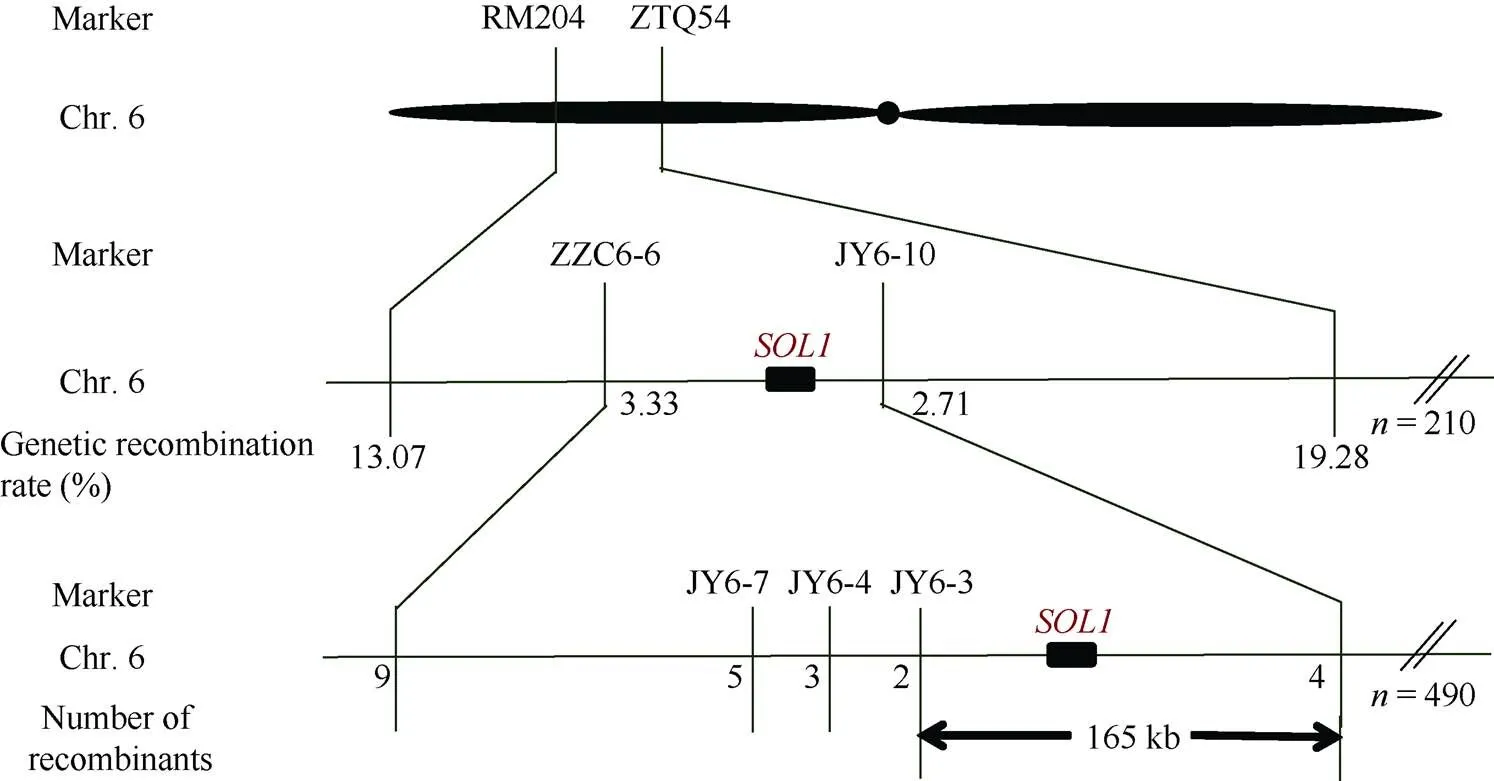
图5 SOL1候选基因定位

表1 第6号染色体上新开发的连锁标记引物
检索结果显示, 精细定位区间内共含有15个注释基因。其中7个编码表达蛋白, 其余8个编码反转录转座子蛋白、叶片衰老相关蛋白、环核苷酸门控离子通道、同源异型结构域和START结构域、转录延伸因子复合物SPT5、LysM-GPI锚定蛋白前体、天冬氨酸蛋白酶的猪笼草蛋白前体(表2)。
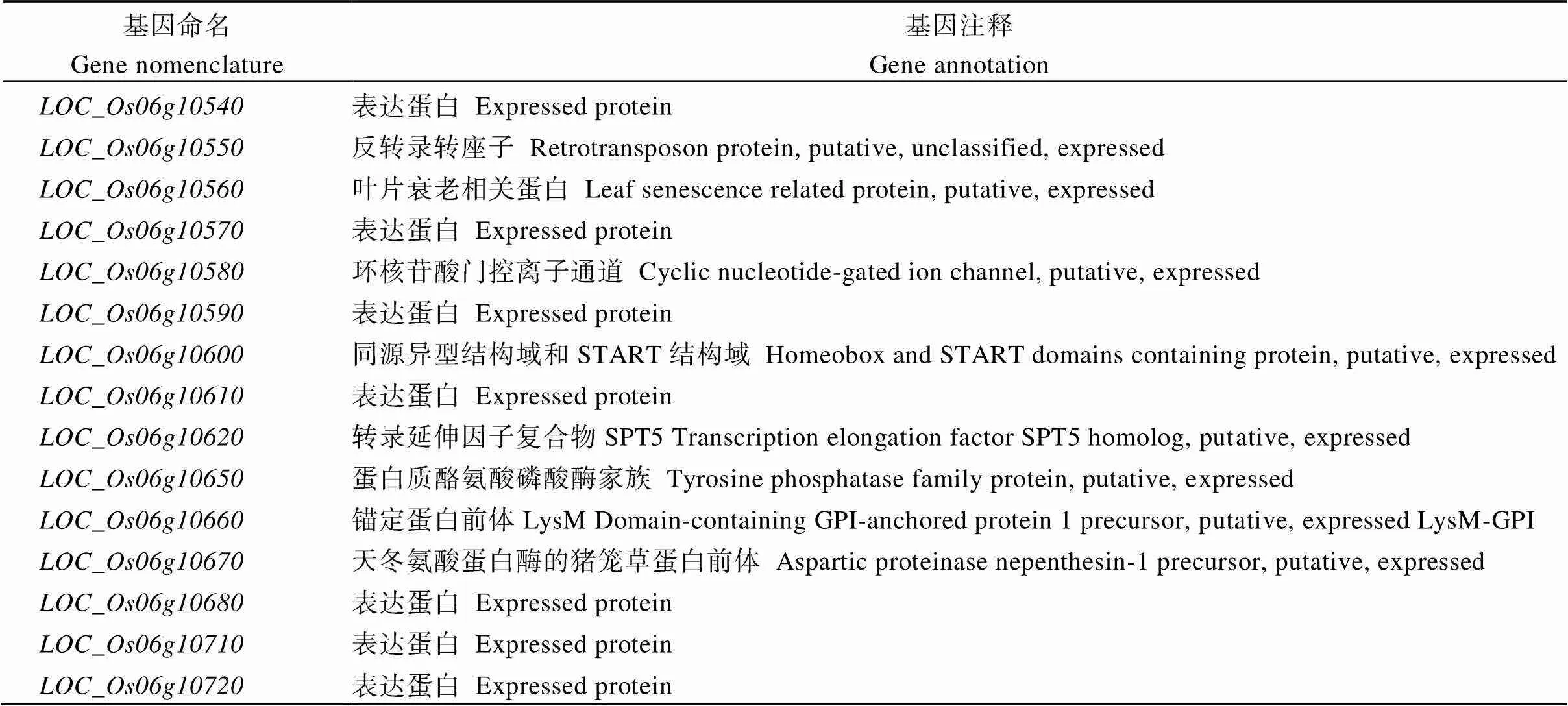
表2 定位区间内的候选基因注解
2.6 相关基因表达量分析
突变体叶片的细胞学结果表明, 叶片外卷表型主要由泡状细胞的变化引起, 因此选取了水稻中与泡状细胞相关的内卷基因和外卷相关基因进行qRT-PCR分析。结果发现, 与WT相比, 在突变体中的表达量呈不同程度的上调, 而、、、、则呈不同程度的下调(图6), 表明泡状细胞相关的内卷基因和外卷相关基因可能共同参与调控基因的外卷表型。
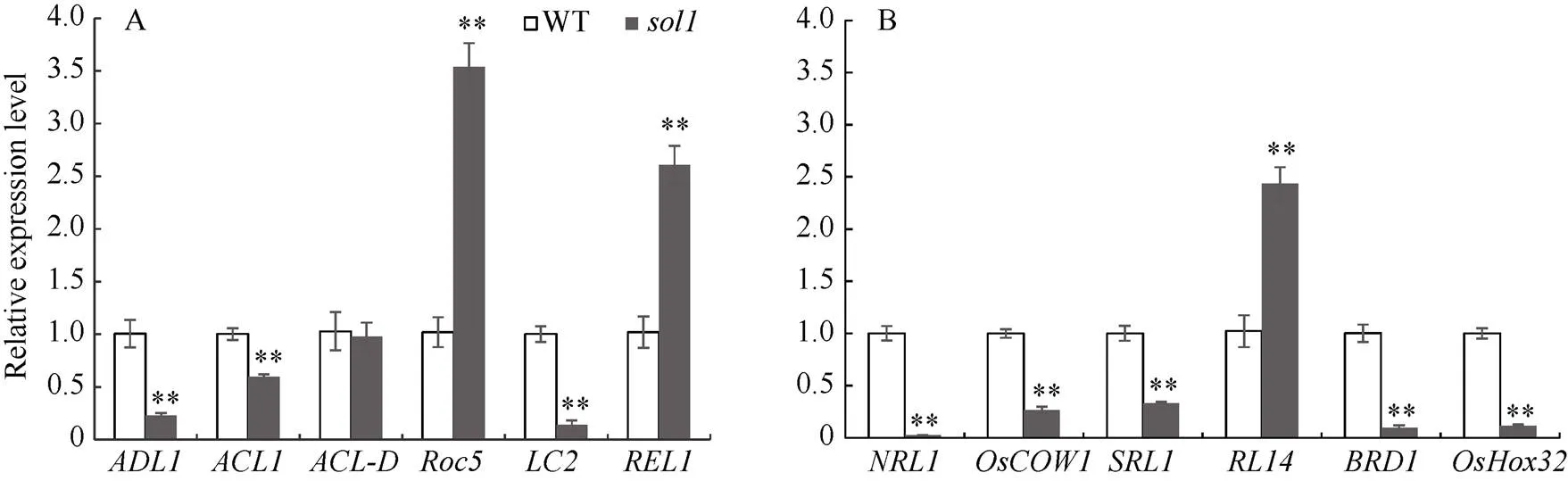
图6 叶片卷曲相关基因的qRT-PCR
A: 泡状细胞发育相关的卷叶基因; B: 远轴面卷曲的相关基因。
A: some genes in bulliform cell development-related rolling leaf; B: genes about some abaxially curled leaf.
3 讨论
叶片是水稻进行光合作用以及气体和水分交换的重要器官, 是塑造理想株型的重要性状之一。水稻叶片的适度卷曲, 有利于保持叶片挺立状态, 改善植株上层叶片的光合速率, 整体提升其光合产物总量的积累[2]。利用突变体研究水稻叶片的形态发育机制, 有助于丰富水稻卷叶基因的遗传资源, 对理想高产株型的改良有重要意义[19]。
在水稻叶片的近轴面一般含有4~5个左右泡状细胞, 并呈中间大两头小类似扇形的结构。泡状细胞是一种特化的表皮细胞, 也是调节水分的高度液泡化的薄壁细胞[20]。一般而言, 泡状细胞失水时叶片易向近轴面卷曲, 吸水后易向远轴面卷曲[21]。研究发现, 泡状细胞数量或体积是水稻叶片形态的关键调控因素之一, 如等。编码类纤维素合成蛋白酶, 其突变体的叶片近轴面泡状细胞变小, 导致叶片卷曲[7-8]与过表达时叶片内卷并变窄, 其泡状细胞数量减少[9,13]。定位在2号染色体上, 其突变体叶片远轴面表皮细胞近轴化, 即在远轴面出现泡状细胞[10]。突变体叶片因泡状细胞数目增加及排列异常而造成外卷并下垂[11], 其蛋白OsZHD1能结合启动子[22]。基因突变后表现叶片外卷, 是由其泡状细胞变大和数目增加及表皮细胞扩大所引起[23]。负向调控泡状细胞的发育, 过表达时, 泡状细胞数量和大小都减少, 造成叶片内卷[24]。编码2OG-Fe(II)氧化酶, 其突变体次生细胞壁组分减少, 从导管到叶片的水分运输速率降低, 导致泡状细胞失水, 表现出内卷[25]。基因除影响泡状细胞的数量外, 还影响叶片的其他细胞结构, 导致其突变体植株矮化且叶片严重卷曲[26]。通过油菜素内酯信号的传导, 使叶片泡状细胞数目和大小改变, 进而调控叶片形态[27]。编码糖基磷脂酰肌醇蛋白, 能够特异性调控液泡H+-焦磷酸酶和H+-ATPase亚基编码基因的表达, 抑制液泡形成, 使泡状细胞数量减少; 其突变体泡状细胞数目增加, 致使叶片半卷[28]。前人报道结果与RT-PCR中基因表达量趋势一致,叶片的泡状细胞体积略微减小, 数量显著增加, 泡状细胞下的叶肉细胞厚度略微变薄, 同时叶片气孔导度增大, 蒸腾速率升高, 这可能是叶片卷曲的主要因素之一。
基因被定位于6号染色体标记JY6-3和JY6-10之间165 kb的区间内。此前在6号染色体上已经报道了2个与水稻卷叶相关的基因与, 其中调控的突变体是由辐射诱变粳稻9522所获得, 其主要表型为植株矮化, 其次还伴随叶片短且微卷。目标基因位于水稻6号染色体PAC克隆AP003490与AP005619上118 kb的物理范围内[29]。与相似,同样位于水稻6号染色体短臂SSR标记RM276附近。研究结果表明,突变体叶绿素含量显著高于野生型, 叶肉细胞层数变薄; 并且在野生型细胞内的一个较大的泡状细胞, 在细胞内有2个大小相近的泡状细胞, 而该突变有可能是导致叶片筒状卷曲的主要原因[30]。从的表型鉴定结果来看, 与表现出一定的相似性, 叶肉细胞厚度变薄、泡状细胞变小等。但是与也存在显著不同, 即的突出表型为叶片外卷(图1-H, 图4-B), 而则表现为内卷; 此外,细胞内较大的泡状细胞与WT相似(图4-C~F), 其外卷的原因有可能是因为表皮泡状细胞的显著增多, 也明显不同于。从比较结果来看,明显不同于与, 且其定位结果与这2个已经报道的卷叶相关基因不一致, 是一个新的调控水稻叶片卷曲的基因。对该基因的后续深入研究, 包括目标基因分离、功能验证、机制解析等, 有可能为水稻叶片发育等相关研究提供新的参考。
4 结论
通过EMS诱变籼稻西农1B获得半外卷突变体从十叶期开始功能叶片呈现出轻微的卷曲, 且随生育进程卷曲程度加深, 叶片半外卷和披垂, 茎秆半矮化, 叶夹角显著大于野生型。叶片的泡状细胞略微减小但数量较野生型显著增加。的蒸腾速率、胞间CO2浓度、气孔导度显著或极显著高于野生型。该性状受1对隐性核基因控制,为一新的基因, 被定位在6号染色体短臂165 kb区间内。
[1] Wang B, Smith S M, Li J. Genetic regulation of shoot architecture., 2018, 69: 437–468.
[2] Zhang G H, Xu Q, Zhu X D, Qian Q, Xue H W. SHALLOT-LIKE1 is atranscription factor that modulates rice leaf rolling by regulating leaf abaxial cell development., 2009, 21: 719–735.
[3] Ma L, Sang X C, Zhang T, Yu Z Y, Li Y F, Zhao F M, Wang Z W, Wang Y T, Yu P, Wang N, Zhang C W, Ling Y H, Yang Z L, He G H.regulates cell proliferation and procambium cell establishment during aerial organ development in rice., 2017, 213: 275–286.
[4] Itoh J I, Hibara K I, Sato Y, Nagato Y. Developmental role and auxin responsiveness ofgene family members in rice., 2008, 147: 1960–1975.
[5] Izhaki A, Bowman J L.andgenefamilies regulate embryo patterning and modulate auxin flow during embryogenesis in., 2007, 19: 495–508.
[6] Shi Z Y, Wang J, Wan X, Shen G, Wang X, Zhang J. Over-expression of ricegene induces upward curling of the leaf blade that enhanced erect-leaf habit., 2007, 226: 99–108.
[7] Hu J, Zhu L, Zeng D L, Gao Z Y, Guo L B, Fang Y X, Zhang G H, Dong G J, Yan M X, Liu J, Qian Q. Identification and characterization of, a novel gene regulating leaf morphology and plant architecture in rice., 2010, 73: 283–292.
[8] Wu C, Fu Y, Hu G, Si H, Cheng S, Liu W. Isolation and characterization of a rice mutant with narrow and rolled leaves., 2010, 232: 313–324.
[9] Li Y Y, Shen A, Xiong W, Sun Q L, Luo Q, Song T, Li Z L, Luan W J. Over-expression ofresults in pleiotropic effects on plant type architecture and leaf development in Rice., 2016, 9: 46.
[10] Hibara K, Obara M, Hayashida E, Abe M, Ishimaru T, Satoh H, Itoh J, Nagato Y. Thegene functions in leaf and embryonic pattern formation in rice., 2009, 334: 345–354.
[11] Xu Y, Wang Y H, Long Q Z, Huang J X, Wang Y L, Zhou K N, Zheng M, Sun J, Chen H, Chen S H, Jiang L, Wang C M, Wan J M. Overexpression of, a zinc finger homeodomain class homeobox transcription factor, induces abaxially curled and drooping leaf in rice., 2014, 239: 803–816.
[12] Wang L, Xu J, Nian J Q, Shen N W, Lai K K, Hu J, Zeng D L, Ge C W, Fang Y X, Zhu L, Qian Q, Zhang G H. Characterization and fine mapping of the rice generegulating leaf morphology and leaf vein development., 2016, 78: 345–356.
[13] Li C, Zou X H, Zhang C Y, Shao Q H, Liu J, Liu B, Li H Y, Zhao T.overexpression induced adaxially rolled leaves in rice., 2016, 11: e0156413.
[14] Yan S, Yan C J, Zeng X H, Yang Y C, Fang Y W, Tian C Y, Sun Y W, Cheng Z K, Gu M H, encoding a GARP protein, regulates the leaf abaxial cell fate in rice., 2008, 68: 239–250.
[15] Wu R, Li S, He S, Wassmann F, Yu C, Qin G, Schreiber L, Qu L J, Gu H., a WW domain protein, regulates cuticle development by modulating the function of HDG1, a class IV homeodomain transcription factor, in rice and., 2011, 23: 3392–3411.
[16] 高艳红, 吕川根, 王茂青, 王彭, 闫晓燕, 谢坤, 万建民. 水稻卷叶性状QTL的初步定位. 江苏农业学报, 2007, 23: 5–10. Gao Y H, Lyu C G, Wang M Q, Wang P, Yan X Y, Xie K, Wan J M. QTL mapping for rolled leaf gene in rice., 2007, 23: 5–10 (in Chinese with English abstract).
[17] Sang X C, Li Y F, Luo Z K, Wang N, Ling Y H, Zhao F M, Yang Z L, Luo H F, Liu Y S, He G H., encoding a monocot-specific MADS box protein, regulates floral organ identity in rice., 2012, 160: 788–807.
[18] Michelmore R W, Paran I, Kesseli R V. Identification of markers linked to disease-resistance genes by bulked segregantion analysis: a rapid method to detect markers in specific genomic regions by using segregating populations., 1991, 88: 9828–9832.
[19] Mori M, Nomura T, Ooka H, Ishizaka M, Yokota T, Sugimoto K, Okabe K, Kajiwara H, Satoh K, Yamamoto K, Hirochika H, Kikuchi S. Isolation and characterization of a rice dwarf mutant with a defect in brassinosteroid biosynthesis., 2002, 130: 1152–1161.
[20] Martin C, Glover B J. Functional aspects of cell patterning in aerial epidermis., 2007, 10: 70–82.
[21] 徐静, 王莉, 钱前, 张光恒. 水稻叶片形态建成分子调控机制研究进展. 作物学报, 2013, 39: 767–774. Xu J, Wang L, Qian Q, Zhang G H. Research advance in molecule regulation mechanism of leaf morphogenesisin rice (L.)., 2013, 39: 767–774 (in Chinese with English abstract).
[22] Figueiredo D D, Barros P M, Cordeiro A M, Serra T S, Lourenço T, Chander S, Oliveira M M, Saibo N J M. Seven zinc-finger transcription factors are novel regulators of the stress responsive gene., 2012, 63: 3643–3656.
[23] Li L, Shi Z Y, Li L, Shen G Z, Wang X Q, An L S, Zhang J L. Overexpression of() increased bulliform cells and induced abaxial curling of leaf blades in rice., 2010, 3: 807–817.
[24] Zou L P, Sun X H, Zhang Z G, Liu P, Wu J X, Tian C J, Qiu J L, Lu T G. Leaf rolling controlled by the homeodomain leucine zipper class IV gene, 2011, 156: 1589–1602.
[25] Fang L, Zhao F, Cong Y, Sang X, Du Q, Wang D, Li Y, Ling Y, Yang Z, He G.is a 2OG-Fe (II) oxygenase family protein that modulates rice leaf rolling by affecting secondary cell wall formation in leaves., 2012, 10: 524–532.
[26] Hong Z, Ueguchi-Tanaka M, Shimizu-Sato S, Inukai Y, Fujioka S, Shimada Y, Takatsuto S, Agetsuma M, Yoshida S, Watanabe Y, Uozu S, Kitano H, Ashikari M, Matsuoka M. Loss-of-function of a rice brassinosteroid biosynthetic enzyme, C-6 oxidase, prevents the organized arrangement and polar elongation of cells in the leaves and stem., 2002, 32: 495–508.
[27] Chen Q L, Xie Q J, Gao J, Wang W Y, Sun B, Liu B H, Zhu H T, Peng H F, Zhao H B, Liu C H, Wang J, Zhang J L, Zhang G Q, Zhang Z M. Characterization of, 2015, 66: 6047–6058.
[28] Xiang J J, Zhang G H, Qian Q, Xue H W.encodes a putative glycosyl phosphatidylinositol-anchored proteinand modulates rice leaf rolling by regulating the formation ofbulliform cells., 2012, 159: 1488–1500.
[29] 夏令, 陈亮, 郭迟鸣, 张红心, 赵政, 沈明山, 陈亮. 一个新的水稻矮秆突变体的遗传与基因定位研究. 厦门大学学报(自然科学版), 2007, 46: 847–851. Xia L, Chen L, Guo C M, Zhang H X, Zhao Z, Shen M S, Chen L. Heredity and gene mapping of a new dwarf mutantin rice., 2007, 46: 847–851 (in Chinese with English abstract).
[30] 田晓庆, 桑贤春, 赵芳明, 李云峰, 凌英华, 杨正林, 何光华. 水稻卷叶基的遗传分析和分子定位. 作物学报, 2012, 38: 423–428.Tian X Q, Sang X C, Zhao F M, Li Y F, Ling Y H, Yang Z L, He G H. Genetic analysis and molecular mapping of a rolled leaf genein rice (L.)., 2012, 38: 423–428(in Chinese with English abstract).
Phenotype characterization and gene mapping of the semi-outcurved leaf mutantL.)
XIE Yuan-Hua**, LI Feng-Fei**, MA Xiao-Hui, TAN Jia, XIA Sai-Sai, SANG Xian-Chun, YANG Zheng-Lin, and LING Ying-Hua*
Rice Research Institute of Southwest University / Chongqing Key Laboratory of Application and Safety Control of Genetically Modified Crops, Chongqing 400715, China
Moderate curling of leaves helps to improve the photosynthetic efficiency, and increase the overall effective accumulation of photosynthate. We identified a stable mutant from the library constructed by treatingmaintainer line Xinong 1B with ethyl methane sulfonate (EMS). Leaves of the mutant gradually curled outwards into a semi-coiled shape, accompanied by semi-dwarfing of the culm and leaf drooping from the 10-leaf stage, the mutant was temporarily named as(). The calculated leaf curl index ofwas 30%, statistically higher than that of wild type (WT,< 0.01). Panicle length and internode length of Top 1 (the 1st leaf from top), Top 2 (the 2nd leaf from top), Top 3 (the 3rd leaf from top), and Top 4 (the 4th leaf from top) were very significantly decreased. The leaf angles of Top 1, Top 2, and Top 3 were significantly or very significantly increased. The number of effective panicles, 1000-grain weight, filled grain number per panicle, and seed setting rate of the mutantwere significantly or very significantly decreased, while primary branch number increased by 11.3%, statistically higher than that of WT (< 0.05). The transpiration rate, intercellular CO2concentration and stomatal conductance ofwere significantly higher than those of wild type. The results of paraffin section showed that the bulliform cells of the Top1 ofexhibited smaller, but their number increased significantly, and the volume of epidermal cells increased slightly. Genetic analysis indicated thatwas controlled by a recessive nuclear gene.was precisely located in the physical distance of 165 kb between the markers of JY6-3 and JY6-10 on the short arm of chromosome 6, with 15 annotated genes. The results of qRT-PCR showed that,,andrelated to bulliform cells were up- regulated in mutant, while,,,,down-regulated. The results of the present study provide a basis forcloning, and functional dissection as well.
rice (L.); semi-outcurvedleaf mutant; phenotype characterization; gene mapping; bulliform cell
本研究由国家重点研发计划项目(2017YFD0100201), 重庆市社会事业与民生保障科技创新专项项目(cstc2016shms-ztcx80012)和中央高校基本科研业务费专项(XDJK2016A013)资助。
This study was supported by the National Key R&D Program of China (2017YFD0100201), the Special Project on Science and Technology Innovation for Social Undertakings and Livelihood Security in Chongqing (cstc2016shms-ztcx80012), and the Fundamental Research Funds for the Central Universities (XDJK2016A013).
10.3724/SP.J.1006.2020.92020
凌英华, E-mail: lingyh003@126.com
**同等贡献(Contributed equally to this work)
谢园华, E-mail:402307420@qq.com; 李凤菲, E-mail: 1071655475@qq.com
2019-04-09;
2019-08-09;
2019-09-03.
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20190903.0934.002.html
