甘蔗热带种金属硫蛋白家族基因的克隆及响应重金属胁迫的表达分析
2020-01-02高世武傅志伟林兆里许莉萍郭晋隆
高世武 傅志伟 陈 云 林兆里 许莉萍 郭晋隆,
甘蔗热带种金属硫蛋白家族基因的克隆及响应重金属胁迫的表达分析
高世武1傅志伟1陈 云1林兆里2许莉萍1郭晋隆1,*
1福建农林大学 / 农业农村部福建甘蔗生物学与遗传育种重点实验室, 福建福州 350002;2福建农林大学 / 农业农村部甘蔗及制品质量监督检验测试中心, 福建福州 350002
金属硫蛋白是一类富含巯基的低分子量蛋白, 在植物的重金属解毒及细胞氧化还原调控等方面起重要的作用。本研究以甘蔗热带种Badila组培苗为材料, 分别测定了其在CdCl2、ZnSO4和CuCl2水溶液培养条件下地上部和地下部的重金属含量, 结果显示其对上述3种重金属有较强的耐受与富集能力。继而克隆了1 (登录号为KJ504373)、2-1-5 (登录号为MH191346)和3 (登录号为KJ5043704) 3个金属硫蛋白家族基因, 它们分别属于植物MT亚家族中的MT1、MT2和MT3型基因。1含有1个内含子和2个外显子, 开放阅读框(Open Reading Frame, ORF)长228 bp, 编码75个氨基酸;2-1-5含有2个内含子和3个外显子, ORF长246 bp, 编码81个氨基酸;3含有1个内含子和2个外显子, ORF长198 bp, 编码65个氨基酸。RT-qPCR显示, Cd2+胁迫下, 在甘蔗地上部和地下部,2-1-5均连续显著上调表达, 而1的上调应答出现延迟。3在地上部的上调应答出现延迟, 在地下部呈“扬–抑”趋势, 提示甘蔗响应Cd2+胁迫过程中2-1-5起更积极的作用,1参与胁迫后期的分子响应, 而3不起主导作用。Cu2+胁迫下, 地上部1连续显著上调表达,2-1-5和3呈总体上调的表达趋势; 地下部,1和2-1-5的上调表答均出现延迟, 仅在胁迫后期显著上调表达, 而3仅在胁迫前期显著上调表达。该结果提示了1、2-1-5和3在Cu2+胁迫响应过程中的协作关系, 三者共同参与了地上部的胁迫响应, 其中1起更积极的作用; 此外三者还先后参与了地下部对Cu2+胁迫的分子响应。Zn2+胁迫下,1和3分别仅在地上部和地下部显著上调表达;2-1-5在地上部和地下部均呈“扬–抑”的应答趋势; 提示了在甘蔗响应Cd2+胁迫应答过程中1和3分别在地上部和地下部起主要作用,2-1-5参与了胁迫前期的分子响应。1、2-1-5和3在甘蔗不同组织中及在重金属(Cd2+、Zn2+或Cu2+)不同累积水平下呈现出相似或互补的应答特性, 提示上述甘蔗MT家族不同成员在重金属解毒及细胞氧化还原调控等方面产生了功能分化, 且三者在应对过量Cd2+、Zn2+或Cu2+对甘蔗组织造成伤害的过程中存在时空上的协同作用。该研究为深入理解多倍体植物甘蔗中MT家族各成员基因在重金属耐受过程中的协同作用机制奠定了基础。
甘蔗; 金属硫蛋白; 重金属; 实时荧光定量PCR
金属硫蛋白(metallothionein, MT)是广泛存在于生物中的一类富含半胱氨酸(cysteine, Cys)的低分子量蛋白[1]。自1957年被首次报道以来, 已在动物、植物、以及微生物中发现含有MT[2]。由于MT的Cys富集结构域含有的巯基具有螯合金属离子的能力, 其在参与细胞金属离子代谢、调节金属离子的定向运输以及螯合解除重金属离子毒害等方面起重要作用, 而引发研究者的广泛关注[3-4]。植物中MT基因以基因家族的形式出现, 在植物体内主要参与金属离子运输、维持氧化还原平衡和调控基因表达等[1], 而且还参与一系列的植物生理调节过程, 包括通过结合重金属离子而间接调控细胞内活性氧水平[5-6]、调控细胞生长与增殖、调节酶和转录因子的活性[7], 参与细胞凋亡过程甚至可能扮演细胞氧化还原传感器的角色[8-9]。
根据MT中Cys残基的位置及排列方式, 前人将植物MT分为MT1、MT2、MT3和MT4四个类型[1,10]。其中, MT1型金属硫蛋白在肽链的N端和C端分别含有3个保守的Cys-Xaa-Cys排列结构(Cys代表半胱氨酸, Xaa代表其他氨基酸), 被一个不含Cys的中间区域分开; 肽链的两端富含Cys, 不含芳香族氨基酸和疏水性氨基酸, 氨基酸个数大约在10~15; 而中间区域往往含有芳香族氨基酸和疏水性氨基酸而且保守性低, 氨基酸个数大约在30~45[10]。MT2型金属硫蛋白氨基酸的排列方式与MT1型类似, N端和C端富含Cys且被一个含有大约40个氨基酸的中间区域分开; 但与MT1型不同的是, 在MT2型MT的前4个氨基酸位置具有其特有的Cys-Cys排列方式[10]。MT3型金属硫蛋白在肽链的N端只含有4个Cys, 且前3个Cys按照保守的结构Cys-Gly-Asn-Cys-Asp-Cys排列, C端一般含有6个Cys, 且都是以Cys-Xaa-Cys的排列方式存在[10]。上述3类MT在结构上具有很高的相似性: 在氨基酸序列的N端和C端各存在一个富含Cys的结构域, 即α和β结构域; 这2个结构域被一条不含Cys的中间区域分开。与其他3种类型的MT不同, MT4型MT含有3个富含Cys的结构域, 平均散布在整条肽链中, 由2条含10~15个氨基酸残基的中间区域隔开, 每个结构域中含有大约5~6个Cys[10]。金属绑定结构域(Cys富集区)的排列方式变化多样, 表明了MT家族各成员功能的多样性[11]。
研究者已相继从多种植物中分离鉴定出植物MT家族成员基因[12]。目前, 已从大麦(L.)中分离到10个MT成员基因[13]; 从拟南芥(L.)中分离到8个MT成员基因(不计剪接变体), 其中有3个MT1型基因 (1a、1b和1c)、2个MT2型基因(2a和2b)、1个MT3型基因(3-1)和2个MT4型基因(4a-1和4b-1)(http://www. arabidopsis.org/index.jsp)。此外, 前人还基于全基因组分析, 表明水稻(L. subsp.)中共有13个MT基因编码15个蛋白, 包括7个MT1型基因(、、、、、和)、4个MT2型基因(、、和)、1个MT3型基因和1个MT4型基因[14]。甘蔗(spphybrid)和拟南芥(L.)、水稻(L.)是迄今少数几个含有4种类型MT的植物[1]。基于DNA凝胶杂交技术[15]和甘蔗EST数据库分析[16]表明, 多倍体作物甘蔗基因组中含有典型的MT1型、MT2型和MT3型基因各8个, 含有MT4型基因1个, 但有核酸序列报道的目前仅有1个MT1型基因(1)[15]、4个MT2型基因(2-1-1、2-1-2、2-1-3和2-1-4)[15-18]和1个MT3型基因(3)[15]。研究者对植物MT家族基因各成员在基因结构的差异和重金属结合等功能上有一定的认识, 但对同一物种MT家族各成员基因相互间的进化关系、在植物应答重金属等逆境胁迫中的协同作用及调控机理等研究鲜见报道。
甘蔗既是世界上最重要的糖料作物, 也是重要的生物能源作物, 具有重要的经济地位[17,19]。同时, 甘蔗作为大田栽培的高生物量C4禾本科作物, 具有适应性广、抗逆性强、耐连作以及对镉等重金属具有良好的耐受和超富集能力, 是潜在的土壤重金属污染的植物修复物种[15]。分离鉴定甘蔗应答重金属胁迫的关键基因是解析其功能并进一步利用的基础, 对筛选、培育和利用植物修复物种具有重要的现实和理论意义。现代甘蔗栽培种是异源多倍体和非整倍体作物, 遗传背景高度杂合[20-21]。为了明确甘蔗MT基因家族各成员的组成, 深入研究和阐明MT各成员在应答重金属胁迫过程中的功能奠定基础, 本研究以染色体的倍性相对明确、栽培面积最大的甘蔗热带原种Badila (L. cv. Badila) (2= 80)[22]为材料, 克隆了MT1、MT2和MT3三个类型的金属硫蛋白基因, 分析了3类MT基因对CuCl2、ZnSO4或CdCl2胁迫的响应特点, 结合不同重金属离子胁迫下甘蔗的表型、地上部和地下部富集重金属离子的水平, 初步探讨了甘蔗不同类型MT基因在甘蔗应答重金属胁迫中的功能。
1 材料与方法
1.1 植物材料处理
供试甘蔗材料为热带种原种Badila。挑选长势一致的组培苗, 按单株置72孔穴盘中, 28℃, 光12 h/暗12 h培养4周。用1/10 Hongland营养液培养, 每隔2 d更换一次培养液。待植株长至4~5片完全展开叶后, 开始胁迫试验。将组培苗分为9组, 其中6组为处理组, 分别采用含有250mmol L-1CdCl2、250mmol L-1CuCl2和1000mmol L-1ZnSO4的1/10 Hongland营养液培养6 h和48 h; 另外3组为对照组, 以1/10 Hongland营养液分别培养0、6和48 h。将上述处理后的甘蔗组培苗全株洗净, 分为地上部(根以上部分)和地下部(根部)取样, 转入下一步处理(重金属含量检测)或放置于液氮中速冻后转到-80℃冰箱保存备用(RNA提取)。实验设置3次生物学重复, 每个重复3株。
1.2 重金属含量检测
用双蒸水反复冲洗整个植株表面3~5次, 然后将各植株的地下部分别浸没在装有1.0 mmol L-1EDTA溶液的烧杯中, 室温条件下浸泡2 h, 以去除植物根部表面残留的重金属离子, 再用双蒸水冲洗甘蔗植株, 用滤纸把植株表面的水吸干, 分为地上部和地下部取样。用锡箔纸包好样品后在105℃杀青30 min, 在90℃下烘干至恒重, 称量其干物质量, 最后将所有处理过的样品放入干燥罐中保存备用。依据国家标准GB/T 5009.13-2003和GB/T 5009.14-2003, 采用火焰法测定铜和锌含量; 依据国家标准GB/T 5009.15-2003, 采用石墨炉法测定镉含量。
1.3 ScMTs基因的克隆与生物信息学分析
分别以已报道的甘蔗及其同源物种的MT1、MT2和MT3基因作为出发序列, 利用NCBI (http:// www.ncbi.nlm.nih.gov/)中的blastn工具搜索甘蔗EST数据库, 得到分别以甘蔗EST序列cf575433、ca231193和ca109790为代表的3个EST拼接群(Contig)。以上述EST拼接群的同源区段为模板, 应用Primer Premier 5.0软件分别设计克隆1、2-1-5和3基因所用的特异性引物(表1)。
应用ORF Finder在线工具进行核酸及氨基酸序列组成分析、开放阅读框(open reading frame, ORF)的查找和翻译; 用DNAMAN5.2软件进行多序列比对分析; 用Clustal W软件对不同植物的金属硫蛋白的氨基酸序列进行多序列比对后, 借助Mega 7.0软件的邻接法(Neighbor-joining Method)构建系统进化树。应用IBS (illustrator for Biological Sequences) 1.0.3软件绘制基因结构; 氨基酸比对的序列分别来源于拟南芥(L.)、水稻(L.)和甘蔗(spphybrid)的MT1、MT2和MT3亚家族成员, 其中拟南芥(L.) 5个MT亚家族成员的名称/登录号信息为AtMT1A/AT1G07600.1、AtMT1C/ AT1G07610.1、AtMT2A/AT3G09390.1、AtMT2B/ AT5G02380.1和AtMT3-1/AT3G15353.1, 水稻(L.) 6个MT亚家族成员的名称/登录号信息为OsMT1A /XP_015617237.1、OsMT1B/XP_015628821.1、OsMT2A/ XP_015645105.1、OsMT2B/XP_015619130.1、OsMT2C/XP_015638726.1、OsMT3A/Os01g0200700, 甘蔗(spphybrid) 7个MT亚家族成员的名称/登录号信息为ScMT1/KJ504373、ScMT2-1-1/ scrufl3063a10.g、ScMT2-1-2/AAV50043、ScMT2-1-3/ AFJ44225、ScMT2-1-4/KJ504375、ScMT2-1-5/MH191346、ScMT3/KJ504374.1。
1.4 ScMTs基因表达模式分析
按照TRIzol Reagent (Invitrogen, 美国)说明书提取甘蔗材料总RNA; 按照RQ1RNase-Free DNase试剂说明书(Promega, 美国)逆转录前用DNA酶处理RNA样品; 按照PrimeScript 1st StrandcDNA Synthesis Kit (TaKaRa, 中国大连)说明书逆转录; 按照SYBR Green PCR Master Mix Kit (Rox) (Roche, 美国)说明书配制定量反应体系。
根据所克隆到的甘蔗MT家族基因的序列信息, 应用Primer Premier 5.0软件设计的定量引物。采用甘蔗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3- phosphate dehydrogenase, GAPDH)基因作内参基因[23], 引物具体信息见表2。qRT-PCR条件为50℃ 2 min; 95℃ 10 min; 95℃ 15 s, 60℃ 1 min, 40个循环。待反应停止, 进行融解曲线分析。采用2–DDCT算法分析实验结果[24]。在ABIPRISM7300 (Applied Biosystems, 美国)型实时荧光定量PCR仪上进行基因定量表达分析。
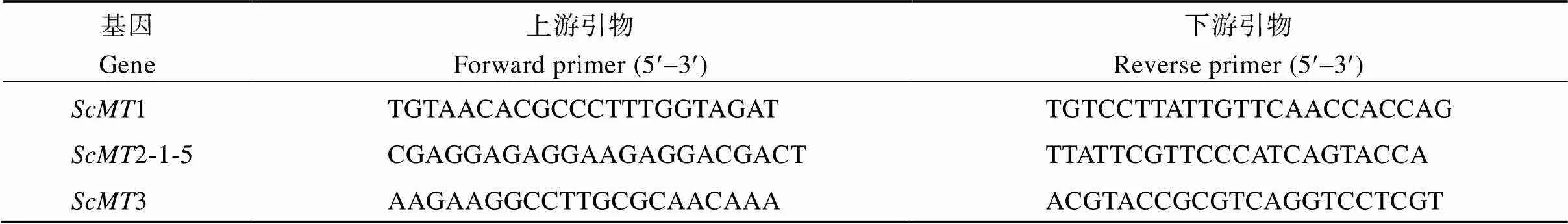
表1 甘蔗金属硫蛋白基因的克隆引物
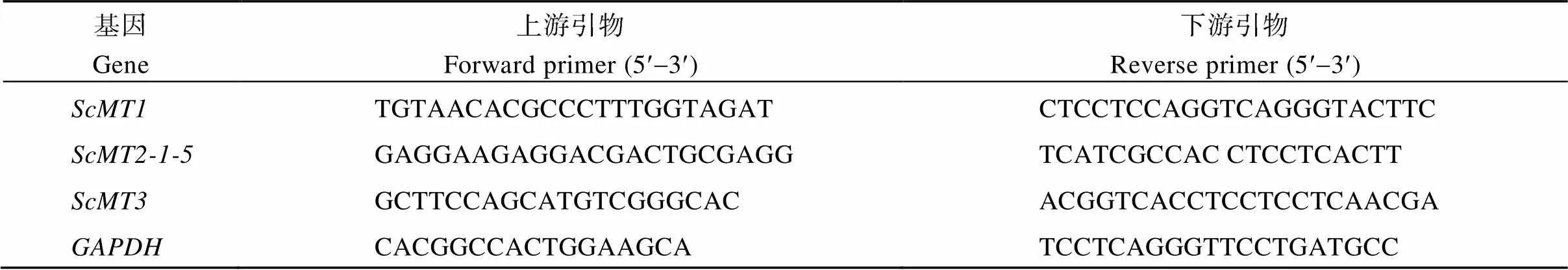
表2 检测甘蔗金属硫蛋白家族基因表达的荧光定量PCR引物
2 结果及分析
2.1 重金属胁迫下甘蔗幼苗的表型特征
甘蔗幼苗在250mmol L-1Cd2+或250mmol L-1Cu2+胁迫6 h和24 h时, 植株无明显症状, 但当胁迫48 h时, 植株叶片卷曲、叶尖干枯发黄、根系褐化(图1-B, D)。与Cd2+、Cu2+胁迫后的表现不同, 在所观测的时间点内, 1000mmol L-1Zn2+胁迫下的甘蔗植株未表现出明显的受害症状, 但有部分幼苗叶片的颜色变紫(图1-C)。解除重金属胁迫48 h时间后, 甘蔗幼苗表型开始恢复正常(图略)。

图1 不同重金属胁迫48 h时甘蔗幼苗表型
A: CK; B; CdCl2; C: ZnSO4; D: CuCl2.
2.2 甘蔗幼苗中重金属的累积特点
由图2可知, 甘蔗植株对重金属的富集量均随着胁迫时间的延长而明显上升, 其中, 地下部累积浓度远远超出地上部。甘蔗幼苗在Cd2+、Zn2+、Cu2+胁迫处理48 h后, 在地上部的累积量分别为(32.2±24.3) mg kg-1、(225.0±3.6) mg kg-1和(34.3± 15.9) mg kg-1, 在地下部的最大累积量分别为(196.7±26.6) mg kg-1、(1063.8 ±101.9) mg kg-1和(448.2±43.5) mg kg-1。
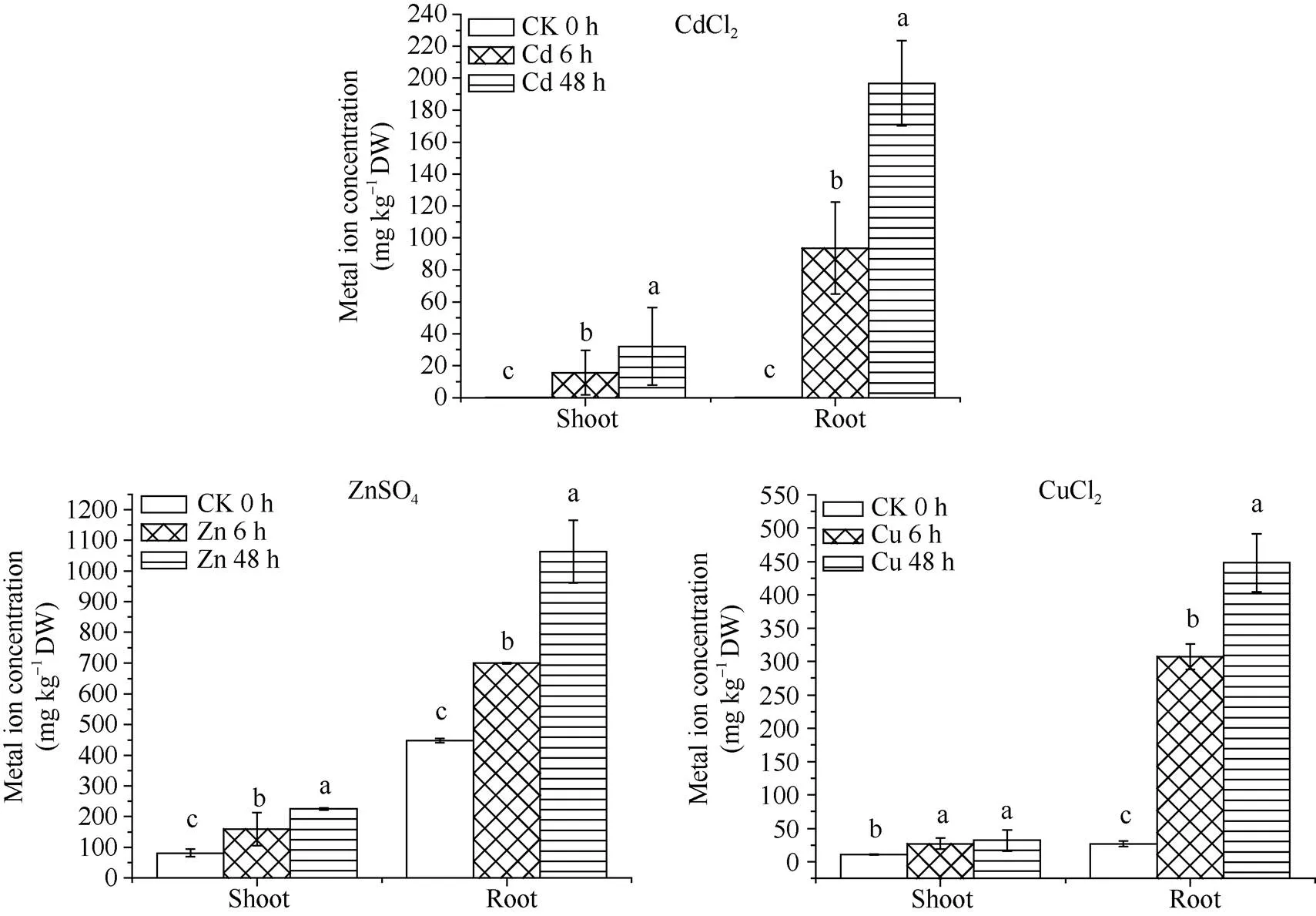
图2 Cd2+、Zn2+、Cu2+胁迫下甘蔗幼苗地上部、地下部重金属积累量
图柱上不同的小写字母表示5%水平下差异的显著性。
Bars superscripted by different letters are significantly different at the 5% probability level.
2.3 ScMTs基因克隆与生物信息学分析
应用RT-PCR技术, 从Badila中获得3个MT基因的cDNA序列(图3), 分别命名为1、2-1-5和3 (对应的GenBank登录号分别为KJ504373、MH191346和KJ504374)。其中,1的cDNA全长448 bp, 5¢非编码区长67 bp, 3¢非编码区长153 bp, ORF长228 bp, 共编码75个氨基酸; 推导蛋白ScMT1氨基酸序列的N端和C端均含有3个CXC排列(C表示半胱氨酸残基Cys, X表示除了Cys外的任意氨基酸), 排列方式符合植物MT1型的结构特征(图4-A)。2-1-5的cDNA全长461 bp, 5¢非编码区长36 bp, 3¢非编码区长179 bp, 开放阅读框长246 bp, 共编码81个氨基酸; 推导蛋白ScMT2-1-5氨基酸序列的N端含有CC、CXC和CXXC的排列结构, C端含有3个CXC排列, 符合植物MT2型的典型特征(图4-B)。3的cDNA全长416 bp, 5¢非编码区长64 bp, 3¢非编码区长154 bp, 开放阅读框长198 bp, 共编码65个氨基酸; 推导蛋白ScMT3氨基酸序列N端的前3个Cys以CXXCXC方式排列, C端的Cys以3个CXC方式排列, 该排列方式符合植物MT3型的序列特征(图4-C)。系统进化树分析结果也表明, 甘蔗ScMT1、ScMT2-1-5和ScMT3分别属于植物MT1、MT2和MT3型金属硫蛋白(图5)。
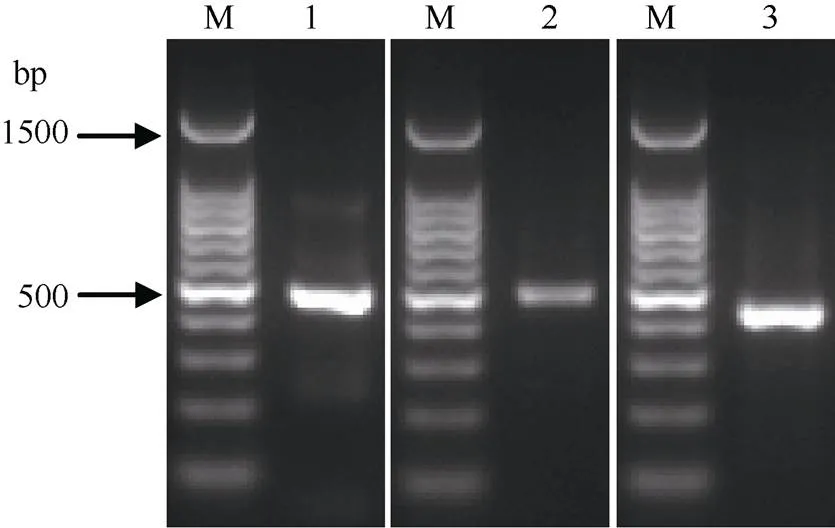
图3 甘蔗金属硫蛋白基因ScMTs的PCR产物凝胶电泳图
M: DNA ladder marker; 1:1; 2:2-1-5; 3:3.

图4 ScMTs cDNA序列及其推导的氨基酸序列
A:1; B:2-1-5; C:3。*: 终止密码子; C显示的是Cys富集结构域中的半胱氨酸残基。
A:1; B:2-1-5; C:3. *: Terminal codon; C shows the conservative cysteine residual of Cys-rich domain.
以gDNA为模板, 经PCR扩增, 获得甘蔗1、2-1-5和3基因的基因组DNA序列, 大小分别为615、1797和642 bp (图略)。比较cDNA基因和基因组DNA基因序列可知,1基因组DNA基因含有2个外显子, 由1个283 bp的内含子连接;2-1-5基因组DNA基因含有3个外显子, 由2个内含子(大小分别为483 bp和583 bp)连接;3基因组DNA基因含有2个外显子, 由1个内含子(259 bp)连接(图5)。上述内含子的结构均符合GT-AG法则。
2.4 ScMTs基因表达模式
1受Cd2+胁迫的诱导而上调表达(图6-A, B); 在Cd2+胁迫前期(6 h), 甘蔗地上部中1相对表达量的变化不明显, 但在胁迫后期(48 h)显著上调, 为对照的2.36倍(图6-B)。甘蔗地上部中1基因迅速正向响应Zn2+胁迫, 在6 h时显著上调表达为对照的1.86倍, 并在处理周期内维持高于对照的水平(图6-C, D); 地下部中1的相对表达水平在处理前期和后期均无显著变化(图6-D)。甘蔗地上部中1也迅速响应Cu2+胁迫且呈连续上调表达趋势, 在胁迫前期和后期, 该基因的表达水平分别为对照的1.51倍和2.19倍(图6-E, F)。在Cd2+或Cu2+胁迫下, 地下部中1的相对表达水平均呈“抑–扬”趋势, 在胁迫前期有所下调, 但在胁迫后期均显著上调, 分别为对照的1.74倍(图6-B)和3.27倍(图6-F)。
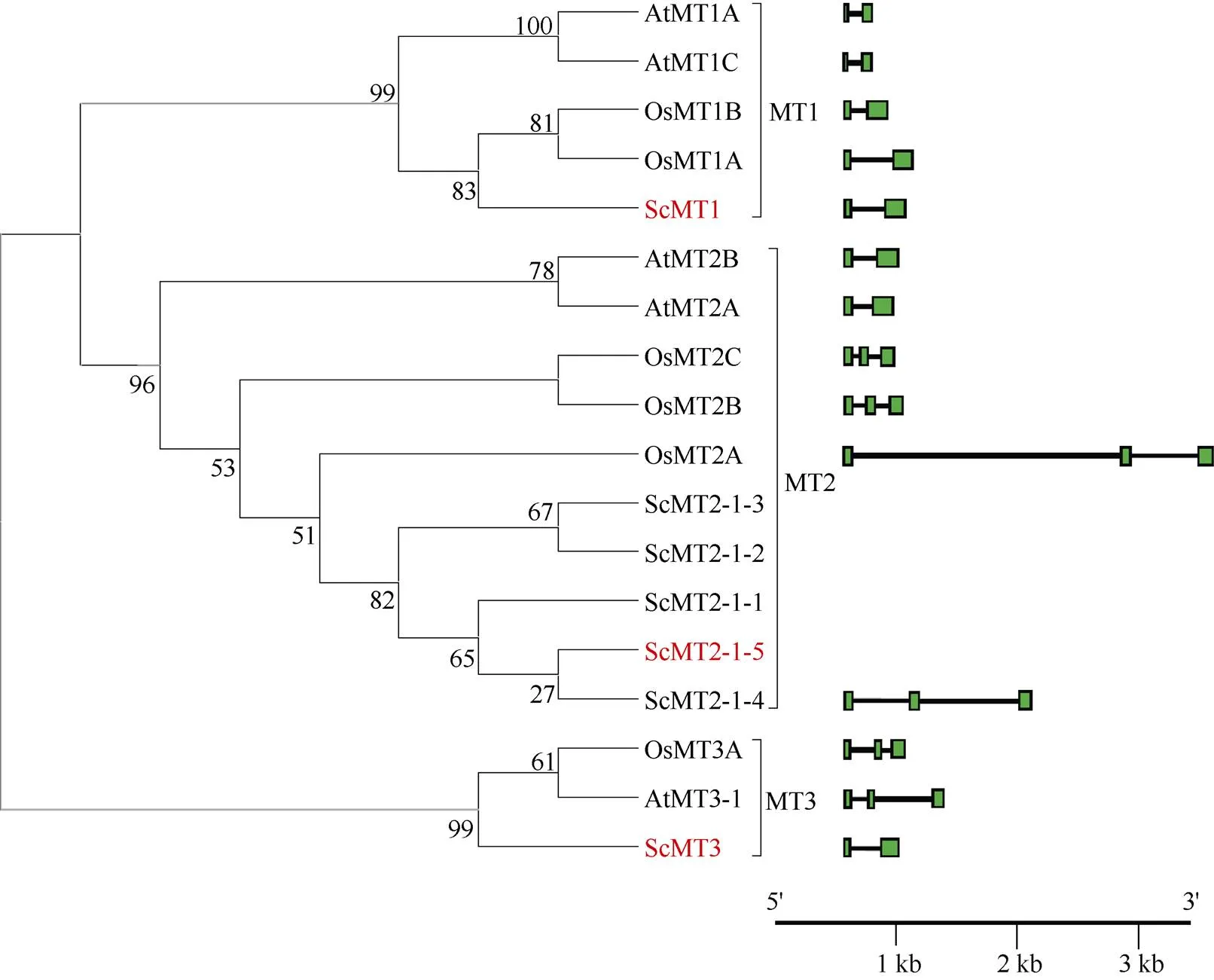
图5 甘蔗、水稻和拟南芥MTs的系统进化树及外显子/内含子结构示意图
方块和条线分别代表外显子和内含子。Boxes and lines indicate exons and introns, respectively.

图6 甘蔗ScMT1基因在不同重金属胁迫下的表达模式
A、C和E分别为1在CdCl2、ZnSO4和CuCl2处理下的表达模式。B、D和F分别为1在CdCl2、ZnSO4和CuCl2处理下和相应对照中相对表达量的比值。误差线为每组处理的标准误(= 3)。图柱上不同的小写字母表示5%水平下差异的显著性。
A, C, and E represent the expression patterns of1 in response to CdCl2, ZnSO4, and CuCl2, respectively. B, D, and F represent the ratio of1 expression level between treatment (CdCl2, ZnSO4,and CuCl2, respectively) and their control groups. The error bars represent the standard errors of each treating group (= 3). Bars superscripted by different letters are significantly different at the 5% probability level.
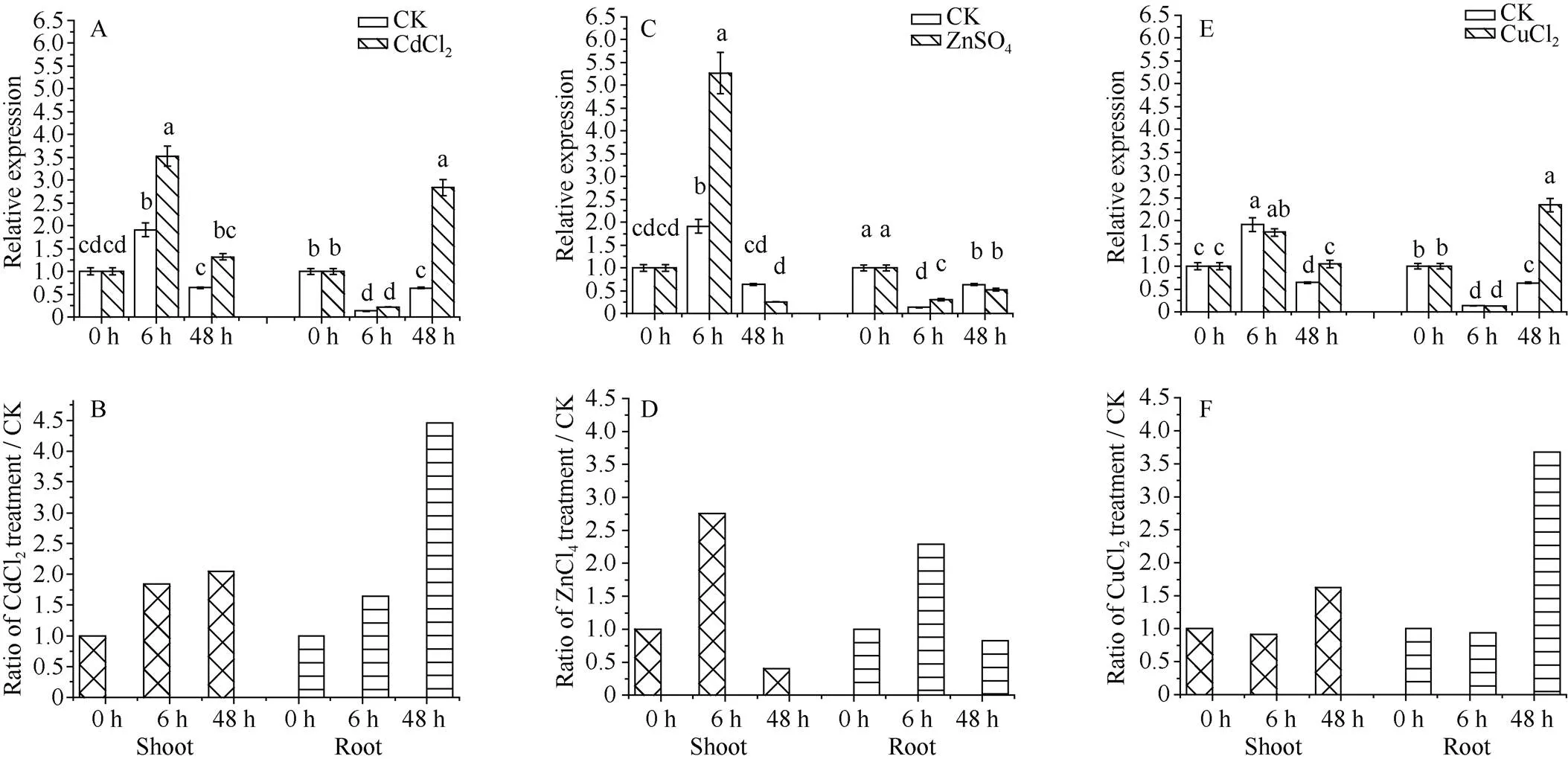
图7 甘蔗ScMT2-1-5基因在不同重金属胁迫下的表达模式
A、C和E分别为2-1-5在CdCl2、ZnSO4和CuCl2处理下的表达模式。B、D和F分别为2-1-5在CdCl2、ZnSO4和CuCl2处理下和相应对照中相对表达量的比值。误差线为每组处理的标准误(= 3)。图柱上不同的小写字母表示5%水平下差异的显著性。
A, C, and E represent the expression patterns of2-1-5 in response to CdCl2, ZnSO4,and CuCl2, respectively. B, D, and F represent the ratio of2-1-5 expression level between treatment (CdCl2, ZnSO4,and CuCl2, respectively) and their control groups. The error bars represent the standard errors of each treating group (= 3). Bars superscripted by different letters are significantly different at the 5% probability level.
2-1-5的表达受Cd2+胁迫的诱导, 在甘蔗地上部和地下部均呈连续上调趋势(图7-A, B)。其中,2-1-5在地上部的相对表达量在处理6 h和48 h时分别为对照的1.84倍和2.05倍, 同时, 地下部该基因的表达水平分别为对照的1.64倍和4.46倍(图7-B)。在处理前期,2-1-5在甘蔗地上部和地下部均受Zn2+胁迫的诱导而上调表达, 分别为对照的2.75倍和2.29倍(图7-C, D); 其相对表达量在48 h时回落至低于对照的水平(图7-D)。在甘蔗地上部和地下部,2-1-5的相对表达水平在Cu2+胁迫前期变化不明显, 但在胁迫后期均显著上调, 分别为对照的1.62倍和3.69倍(图7-E, F)。
甘蔗地上部3受Cd2+胁迫诱导, 呈上调表达趋势, 在48 h时为对照的1.64倍; 甘蔗地下部3的相对表达量在Cd2+胁迫6 h时上调为对照的1.41倍, 但在48 h时下调为对照的0.47倍(图8-A, B)。在Zn2+处理下, 甘蔗地上部3的相对表达水平也呈现上调趋势, 在胁迫6 h时就上调至对照的1.98倍, 并在处理后期维持在高于对照1.66倍的水平; 与地上部相比, Zn2+处理对地下部中3基因表达的诱导作用更加显著, 其表达水平在胁迫6 h时就迅速上调至对照的10.09倍, 并在处理后期维持在高于对照4.38倍的水平(图8-C, D)。甘蔗地上部3的表达受Cu2+处理的诱导而呈现上调趋势, 在胁迫6 h时和48h时, 分别上调为对照的1.71倍和1.46倍; 甘蔗地下部3基因对Cu2+胁迫的响应迅速且强烈, 其相对表达量在处理6 h时就达到最高, 为对照的3.96倍, 随后回落为对照的1.24倍(图8-E, F)。
3 讨论
现代甘蔗栽培种(spp. hybrid)对重金属镉具有良好的耐受能力。甘蔗对Cd2+胁迫的临界浓度在土壤栽培条件下达100 mg kg-1 [25], 在水培条件下达56.21 mg L-1 [15], 分别高于镉超富集植物龙葵(L.)和青葙(Linn.)的25 mg kg-1 [26]和20 mg kg-1 [27]。现代甘蔗栽培种对镉还具有一定的富集能力。在上述临界浓度下, 龙葵叶和根分别可富集到124.6 mg kg-1和259.9 mg kg-1 [26], 青葙叶和根分别可富集到388 mg kg-1和238 mg kg-1 [27], 而甘蔗地上部和地下部富集到的镉含量分别为451 mg kg-1和9621 mg kg-1(干重)[15]。与前二者相比, 尽管甘蔗对镉的转运系数小于1, 但基于其高生物量及对镉的高度富集能力, 依然被Sereno 等[15]认为是潜在的镉修复植物。此外, 甘蔗还对重金属铜具有一定的耐受与富集能力[15]。
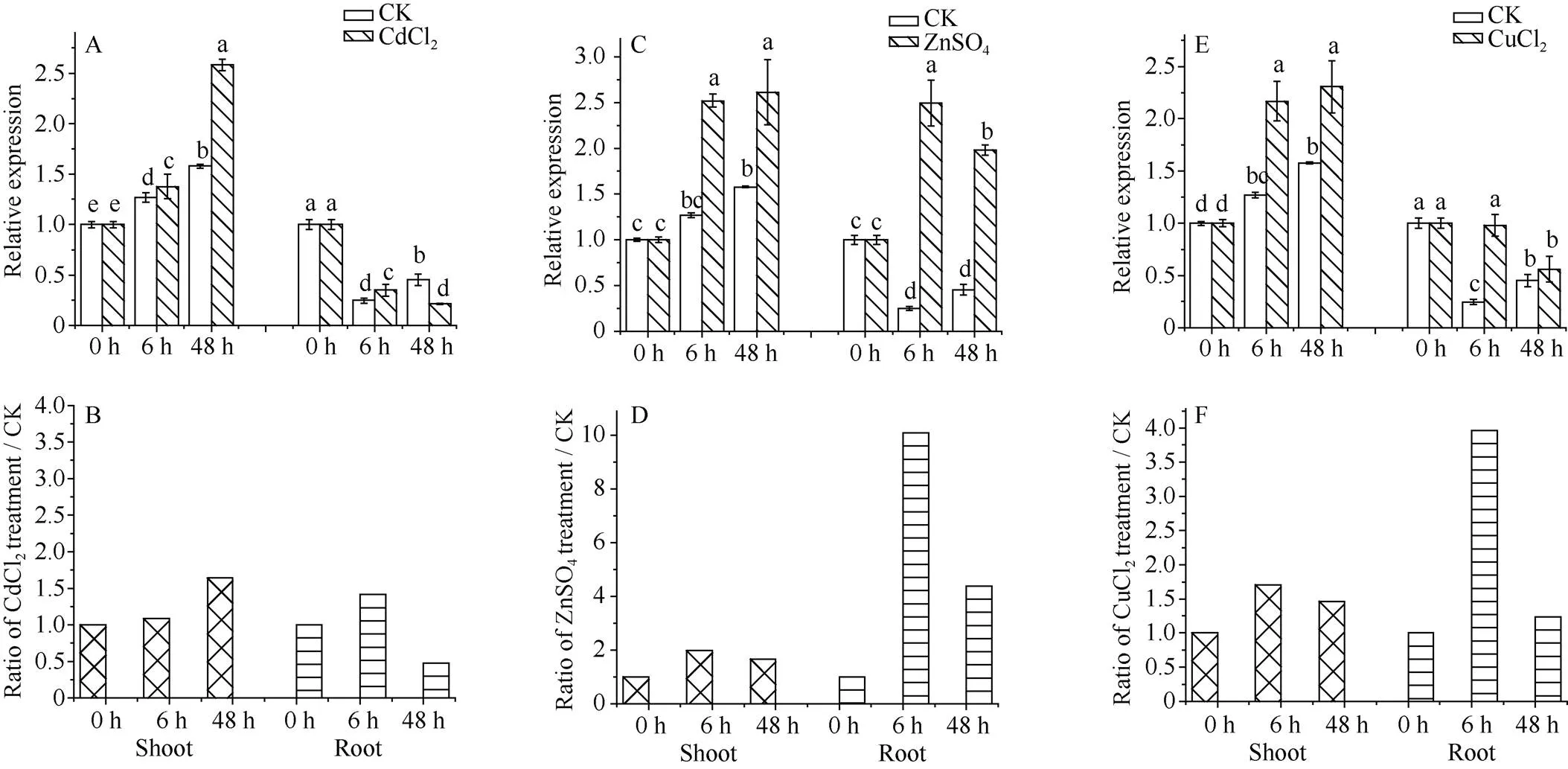
图8 甘蔗ScMT3基因在不同重金属胁迫下的表达模式
A、C和E分别为3在CdCl2、ZnSO4和CuCl2处理下的表达模式。B、D和F分别为3在CdCl2、ZnSO4和CuCl2处理下和相应对照中相对表达量的比值。误差线为每组处理的标准误(= 3)。图柱上不同的小写字母表示5%水平下差异的显著性。
A, C, and E represent the expression patterns of3 in response to CdCl2, ZnSO4, and CuCl2, respectively. B, D and F represent the ratio of3 expression level between treatment (CdCl2, ZnSO4, and CuCl2, respectively) and their control groups. The error bars represent the standard errors of each treating group (= 3). Bars superscripted by different letters are significantly different at the 5% probability level.
与现代甘蔗栽培种类似, 本研究中原始热带种Badila对镉、锌、铜等重金属也有一定的耐受与富集能力, 组培幼苗能在含有100mmol L-1CdCl2、500mmol L-1ZnSO4或100mmol L-1CuCl2的培养液中生长而不发生毒害症状(图略); 当Cd2+或Cu2+的处理浓度为250mmol L-1(Cd2+或Cu2+的含量分别相当于28.10 mg L-1和15.89 mg L-1)时, 幼苗在胁迫48 h时表现出受胁迫的表型(图1), 但生物量未见显著下降(结果略); 同时幼苗地上部中上述3种重金属的累积量分别达(32.2±24.3) mg kg-1、(225.0±3.6) mg kg-1和(34.3±15.9) mg kg-1, 在地下部的最大累积量分别为(196.7±26.6) mg kg-1、(1063.8±101.9) mg kg-1和(448.2±43.5) mg kg-1(图3)。上述3种重金属离子经由Badila根部吸收并运输和分配到地上部分, 进而引发了相应的表型变化, 这为后续深入研究金属胁迫下MT等功能蛋白对甘蔗吸收与耐受重金属的机理奠定了基础。
植物金属硫蛋白(MT)被认为是细胞内维持金属离子平衡的关键蛋白[1]。MT基因各型亚家族成员的克隆及其在重金属胁迫下的表达特性研究在拟南芥[28]、水稻[14]和大麦[13]等植物中已有较系统有报道。甘蔗是除了拟南芥、水稻以外的少数几个含有全部4类MT的植物[1]。一般认为, MT4仅在发育的种子中表达[1,29], 考虑到甘蔗是中日性植物, 开花结实需要特定的光温条件, 且生产上采用蔗茎进行无性繁殖, 因此本研究暂未关注甘蔗MT4类型的基因。MT2型基因在甘蔗中的报道最多, 例如克隆自甘蔗现代栽培种的2-1-1、2-1-2和2- 1-3[15-17], 以及来源于Badila的2-1-4[18]。Guo等[17]将植物MT2型分为3个亚类, 本研究中2- 1-5与上述甘蔗MT2型基因的推导蛋白序列均属于MT2-1亚类, 序列一致性为94.46%。2-1-5与2-1-4一样, 均来源于Badila, 且二者的推导蛋白序列一致性为96.39%。其中, ScMT2-1-4比ScMT2-1-5多了2个氨基酸残基, 且还有1个氨基酸残基的不同, 这3个氨基酸残基位于不含Cys的中间区域(图略), 初步推测二者为等位基因, 但还需要通过克隆该基因上下游区段等方法做进一步确认。关于甘蔗MT1型和MT3型基因的报道较少, Sereno等[15]应用RNA点杂交技术研究了甘蔗MT1 (GenBank登录号为CA287650)、MT2 (CA232620)和MT3 (CA109591) 3个类型的MT基因在Cu2+和Cd2+胁迫下的应答模式, 但上述基因均来源于甘蔗EST序列, 并无实体克隆的报道。本研究进一步对其推导的氨基酸序列分析发现, 该MT1 (GenBank登录号为CA287650) C端的Cys富集区结构域缺失, 而MT3 (CA109591)的N端和C端的Cys富集区结构域也缺失, 均不符合植物MT1型和MT3型的结构特征。本研究克隆的1、2-1-5和3基因, 其推导的氨基酸序列分别符合植物MT1型、MT2型和MT3型的结构特征(图3)。进一步比较拟南芥、水稻和甘蔗中上述3个类型的MT基因的结构, MT1型MT基因的外显子与内含子的构成在拟南芥、水稻和甘蔗中较为保守, 均只含有1个内含子; 拟南芥MT2型MT基因含有1个内含子, 而禾本科的水稻和甘蔗的MT2型MT基因含有2个内含子; 值得指出的是, 甘蔗MT3型MT基因仅含有1个内含子, 与拟南芥和水稻MT3型含有2个内含子的基因结构不同(图4)。
MT1型基因成员在镉、锌或铜的富集和耐受方面的功能已分别在拟南芥[28,30]和水稻[31]等模式植物中得到实验证据的支持。柽柳(sp.) MT1基因也被证明有助于提高转基因烟草植株对Cd2+的抗性[32]。不同植物的MT1基因对重金属胁迫的应答模式有类似的特点。大麦叶片中受到不同浓度Zn2+胁迫的诱导, 在胁迫48 h时均显著上调表达; 而不同浓度的Cd2+胁迫均抑制了该基因的表达; 此外,对Cu2+胁迫的响应存在剂量效应, 低浓度Cu2+胁迫(50mmol L-1CuSO4)下的表达水平变化不大, 而高浓度Cu2+胁迫(500mmol L-1CuSO4) 48 h时诱导的表达[13]。与类似, 水稻幼苗中基因受低浓度Zn2+(10mmol L-1)胁迫的诱导显著上调表达, 而对低浓度Cu2+(10mmol L-1)胁迫无明显响应[31]。本研究中,1对Cd2+胁迫的响应相对滞后, 在甘蔗地上部和地下部的表达水平在胁迫前期变化均不明显(图5-A), 随着甘蔗地上部和地下部镉的富集量从15.5 mg kg-1和93.7 mg kg-1分别上升到32.2 mg kg-1和196.7 mg kg-1(图2), 甘蔗地上部和地下部1分别显著上调表达为对照的2.37倍和1.75倍(图5-B)。上述结果表明1对Cd2+胁迫的响应存在域值或延后效应, 提示了1可能并不直接与Cd2+螯合, 但参与了胁迫后期过量Cd2+毒害引起的生理生化与分子响应。甘蔗地上部和地下部富集到的锌含量均随处理时间的延长呈连续上升的趋势, 且甘蔗地下部富集到的锌含量显著高于地上部(图2)。Zn2+胁迫下,1在甘蔗幼苗地上部的相对表达量总体上维持高于对照的水平, 但1在甘蔗幼苗地下部对Zn2+胁迫的响应却不敏感(图5-D), 提示了该基因在根中并不参与甘蔗对过量Zn2+胁迫的生理及分子响应, 而仅在地上部发挥其功能。1在Cu2+胁迫下的应答模式总体上与拟南芥类似, 后者也是在根和叶均受到Cu2+胁迫的诱导而上调表达[29], 而甘蔗地上部和地下部1对Cu2+胁迫的应答模式还是有所区别(图5-E, F): 地上部1对Cu2+胁迫的响应呈连续上调趋势(图5-F); 而地下部1对Cu2+胁迫的正向响应则相对滞后(图5-F)。这种滞后表现为甘蔗地下部富集到307.3 mg kg-1的铜时,1相对表达水平并不高于对照(图5-F), 而当铜含量达到448.2 mg kg-1时, 显著上调表达为对照的3.27倍(图5-F)。大麦[13]和水稻[31]对Cu2+胁迫的响应也存在相类似的剂量效应。1在地上部对Cu2+胁迫相对敏感, 而在地下部的响应存在域值或延后效应, 提示1参与甘蔗对过量Cu2+胁迫的分子响应, 但在地上部和地下部的机制有所不同。
与MT1类成员主要参与植物对重金属的富集有所区别, 已有的证据表明MT2类成员主要在提高植物对镉等重金属的耐受能力方面发挥功能。过表达提高了烟草对Cd2+的耐受能力, 但单独过表达2b对Cd2+和Zn2+从根部向地上部运输方面的促进作用不显著[33],2b在Cu2+转运或累积到拟南芥地上部方面也不起直接的作用[28]。过表达甘蔗2-1-3提高了重组大肠杆菌对Cd2+和Cu2+的耐受性[17], 也提示了甘蔗2基因有类似的功能。不同植物的MT2基因对重金属胁迫的响应各有特点, 二色补血草((Bunge) O. Kuntze)基因的表达受Cd2+和Cu2+诱导, 在地上部和地下部总体上均上调表达[34]; 东南景天(Hance)2基因的表达受Cd2+和Zn2+诱导, 在地上部和地下部均上调表达[35]; 而2对Cu2+胁迫的响应具有组织特异性, Cu2+(25mmol L-1CuSO4)能诱导拟南芥2a和2b分别在叶和根中高表达[29]。上述2基因对不同重金属胁迫的差异应答, 体现了MT2基因在不同植物适应重金属等氧化胁迫的进化过程中出现了功能分化。值得指出的是, 甘蔗是高度杂合的多倍体或非整倍体作物, 染色体组中2基因的等位基因数量较多, 对同一种重金属胁迫的应答趋势也不尽相同。2-1-3在甘蔗FN39组培苗(全株)中的表达受到Cu2+的促进, 然而却受Cd2+的抑制[17];2-1-4在地上部受Cd2+胁迫的诱导呈先抑后扬的模式, 但在地下部受Cd2+的抑制而稳定下调; 其在地上部和地下部响应Zn2+胁迫而呈先扬后抑的表达趋势; 并在地上部和地下部受Cu2+胁迫的诱导总体上有所上调[18]。本研究中2-1-5对Zn2+和Cu2+胁迫下的应答模式与2-1-4类似(图6-D, F), 但其在地上部和地下部的表达受Cd2+胁迫的诱导均呈连续上调趋势(图6-B), 表明2-1-5在甘蔗耐受Cd2+胁迫过程中可能起相对主要的作用; 其与等位基因2-1-4在甘蔗对Zn2+和Cu2+响应过程中可能起正向协同作用, 而在甘蔗地下部响应Cd2+重金属胁迫的过程中, 二者的功能及调控方式可能有所分化。2-1-4和2-1-5对同一种重金属胁迫的差异应答现象, 为了解等位基因在高度杂合的多倍体或非整倍体——甘蔗中的复杂功能及相应的调控机制提供了进一步的证据与思路。
有证据表明, 植物MT3在应答Cd2+胁迫方面并不起主要作用。天蓝遏蓝菜(J. & C. Presl)基因在地上部的表达水平高于地下部, Cd2+胁迫(100mmol L-1)对该基因在地上部和地下部的表达影响不显著[36], 而50mmol L-1Cu2+胁迫诱导该基因在地上部显著上调表达。与3类似水稻3基因受到Cu2+胁迫的诱导在叶片中表达量显著上调[37]。体外Cd2+、Zn2+或Cu2+胁迫下的酵母异源互补等实验也表明, 大麦(L.) MT3是维持重金属锌和铜在体内平衡的看家蛋白[38]。与3和3仅在地上部上调表达不同,3在地上部和地下部受Cu2+胁迫的诱导均上调表达, 并且在地下部上调幅度达3.96倍, 高于其在地上部的上调水平(图7-F)。3与3分别在地下部与地上部正向响应Cu2+等重金属胁迫或许与二者基因结构(内含子)的差异(图4)有关。同时,3还受Zn2+胁迫的诱导上调表达, 并且在地下部的表达水平高于对照10倍, 也远远高于其在地上部的上调幅度。此外, 尽管甘蔗地上部及地下部也富集了相当水平的镉(图2),3受Cd2+胁迫的诱导也有所上调(图7-B), 但上调表达的幅度明显低于其在Zn2+和Cu2+胁迫时的上调表达水平(图7-D, F)。上述结果提示了3主要在甘蔗地下部响应Zn2+和Cu2+胁迫时发挥更积极的作用。
尽管近年来已经有不少关于植物MT功能的研究, 但植物MT家族成员丰富, 要阐明MT各成员的功能及之间的协同作用, 仍然需用更多的证据[11]。
4 结论
从甘蔗热带种Badila中克隆获得金属硫蛋白家族3个成员基因1、2-1-5和3, 它们分别归属于MT1、MT2和MT3型植物MT亚家族。在营养液培养条件下Badila幼苗对重金属Cd2+、Zn2+和Cu2+有一定的耐受和富集能力, 上述重金属离子经由根部吸收并运输、分配到地上部, 引发了相应的表型和分子响应。1、2-1-5和3参与上述分子响应过程, 且在甘蔗不同组织中对Cd2+、Zn2+或Cu2+表现出协同或互补的应答特性, 提示了上述MT成员基因在甘蔗应对重金属伤害及其代谢机理等方面的功能分化, 和在时空上的协同作用。该研究为深入理解多倍体植物甘蔗中MT家族各成员基因在重金属耐受过程中的协同作用机制奠定了基础。
[1] Cobbett C, Goldsbrough P. Phytochelatins and metallothioneins: roles in heavy metal detoxification and homeostasis., 2002, 53: 159–182.
[2] 常团结, 朱祯. 植物金属硫蛋白研究进展(一) ——植物MT的分类、特征及其基因结构. 生物技术通报, 2002, (3): 5–10. Chang T J, Zhu Z. Study advances of plant metallothionein ——classification, characteristics and gene structure., 2002, (3): 5–10 (in Chinese with English abstract).
[3] 全先庆, 张洪涛, 单雷, 毕玉平. 植物金属硫蛋白及其重金属解毒机制研究进展. 遗传, 2006, 28: 375–382. Quan X Q, Zhang H T, Shan L, Bi Y P. Advances in plant metallothionein and its heavy metal detoxification mechanisms.(Beijing), 2006, 28: 375–382 (in Chinese with English abstract).
[4] Ziller A, Yadav R K, Capdevila M, Reddy M S, Vallon L, Marmeisse R, Atrian S, Palacios Ò, Fraissinet-Tachet L. Metagenomics analysis reveals a new metallothionein family: Sequence and metal-binding features of new environmental cysteine-rich proteins., 2017, 167: 1–11.
[5] Akashi K, Nishimura N, Ishida Y, Yokota A. Potent hydroxyl radical-scavenging activity of drought-induced type-2 metallothionein in wild watermelon., 2004, 323: 72–78.
[6] Wong H L, Sakamoto T, Kawasaki T, Umemura K, Shimamoto K. Down-regulation of metallothionein, a reactive oxygen scavenger, by the small GTPase OsRac1 in rice., 2004, 135: 1447–1456.
[7] Haq F, Mahoney M, Koropatnick J. Signaling events for metallothionein induction., 2003, 533: 211–226.
[8] Fabisiak J P, Borisenko G G, Liu S X,Tyurin V A, Pitt B R, Kagan V E. Redox sensor function of metallothioneins., 2001, 353: 268–281.
[9] Vašák M, Hasler D W. Metallothioneins: new functional and structural insights., 2000, 4: 177–183.
[10] Freisinger E. Structural features specific to plant metallothioneins., 2011, 16: 1035–1045.
[11] Grennan A K. Metallothioneins, a diverse protein family., 2011, 155: 1750–1751.
[12] Leszczyszyn O I, Imam H T, Blindauer C A. Diversity and distribution of plant metallothioneins: a review of structure, properties and functions., 2013, 5: 1146–1169.
[13] Schiller M, Hegelund J N, Pedas P, Kichey T, Laursen K H, Husted S, Schjoerring J K. Barley metallothioneins differ in ontogenetic pattern and response to metals., 2014, 37: 353–367.
[14] Kumar G, Kushwaha H R, Panjabi-Sabharwal V, Kumari S, Joshi R, Karan R, Mittal S, Pareek S L, Pareek A. Clustered metallothionein genes are co-regulated in rice and ectopic expression ofconfers multiple abiotic stress tolerance in tobacco via ROS scavenging., 2012, 12: 107.
[15] Sereno M L, Almeida R S, Nishimura D S, Figueira A. Response of sugarcane to increasing concentrations of copper and cadmium and expression of metallothionein genes., 2007, 164: 1499–1515.
[16] Figueira A, Kido E A, Almeida R S. Identifying sugarcane expressed sequences associated with nutrient transporters and peptide metal chelators., 2001, 24: 207–220.
[17] Guo J, Xu L, Su Y, Wang H, Gao S, Xu J, Que Y., a metallothionein gene of sugarcane, plays an important role in the regulation of heavy metal tolerance/accumulation., 2013. doi: 10.1155/2013/904769.
[18] 陈云, 王竹青, 傅志伟, 杨玉婷, 郭晋隆, 苏亚春, 许莉萍. 甘蔗金属硫蛋白基因(2-1-4)的克隆及表达分析. 基因组学与应用生物学, 2015, 34: 357–364. Chen Y, Wang Z Q, Fu Z W, Yang Y T, Guo J L, Su Y C, Xu L P. Cloning and expression analysis of metallothionein gene2-1-4 in Sugarcane., 2015, 34: 357–364 (in Chinese with English abstract).
[19] Verma A K, Agarwal A K, Dubey R S, Solomon S, Singh S B. Sugar partitioning in sprouting lateral bud and shoot development of sugarcane., 2013, 62: 111–115.
[20] D’hont A, Grivet L, Feldmann P,Rao S, Berding N, Glaszmann J C.Characterisation of the double genome structure of modern sugarcane cultivars (spp.) by molecular cytogenetics., 1996, 250: 405–413.
[21] Edmé S J, Comstock J C, Miller J D, Tai P Y P. Determination of DNA content and genome size in sugarcane., 2005, 25: 1–16.
[22] Zhang J, Nagai C, Yu Q, Pan Y B, Ayala-Silva T, Schnell R J, Comstock J C, Arumuganathan A K, Ming R. Genome size variation in threespecies., 2012, 185: 511–519.
[23] Iskandar H M, Simpson R S, Casu R E, Bonnett G D, Maclean D J, Manners J M. Comparison of reference genes for quantitative real-time polymerase chain reaction analysis of gene expression in sugarcane., 2004, 22: 325–337.
[24] Livak, K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−DDCTmethod., 2001, 25: 402–408.
[25] 夏会龙, 程文伟, 池小雅. 镉胁迫对甘蔗生长及生理性状的影响. 中国土壤与肥料, 2009, (1): 42–45. Xia H L, Cheng W E, Chi X Y. Effects of Cd stress on the growth and physiological properties of sugarcane., 2009, (1): 42–45 (in Chinese with English abstract).
[26] 魏树和, 周启星, 王新. 超积累植物龙葵及其对镉的富集特征. 环境科学, 2005, 26(3): 167–171. Wei S F, Zhou Q X, Wang X. Cadmium-hyperaccumulatorL. and its accumulating characteristics., 2005, 26(3): 167–171 (in Chinese with English abstract).
[27] 姚诗音, 刘杰, 王怡璇, 朱园芳, 丰顺. 青葙对镉的超富集特征及累积动态研究. 农业环境科学学报, 2017, 36: 1470–1476. Yao S Y, Liu J, Wang Y X, Zhu Y F, Feng S. Cd hyperaccumulation and accumulative kinetics ofLinn. for phytoremediation of Cd-contaminated soil., 2017, 36: 1470–1476 (in Chinese with English abstract).
[28] Guo W J, Meetam M, Goldsbrough P B. Examining the specific contributions of individualmetallothioneins to copper distribution and metal tolerance., 2008, 146: 1697–1706.
[29] Guo W J Bundithya W, Goldsbrough P B. Characterization of themetallothionein gene family: tissue-specific expression and induction during senescence and in response to copper., 2003, 159: 369–381.
[30] Zimeri A M, Dhankher O P, McCaig B, Meagher R B. The plant MT1 metallothioneins are stabilized by binding cadmiums and are required for cadmium tolerance and accumulation., 2005, 58: 839–855.
[31] Yang Z, Wu Y R, Li Y, Ling H Q, Chu C C. OsMT1a, a type 1 metallothionein, plays the pivotal role in zinc homeostasis and drought tolerance in rice., 2009, 70: 219–229.
姜廷波, 陈虹, 唐鑫华, 丁宝建, 王玉成, 李凤娟, 李绍臣. 转金属硫蛋白基因(MT1)烟草抗Cd2+胁迫的生理特性分析. 作物学报, 2007, 33: 1902–1905. Jiang T B, Chen H, Tang X H, Ding B J, Wang Y C, Li F J, Li S C. Analysis of physiologic characteristics for Cd2+tolerance on transgenic tobacco expressing metallothionein gene ()., 2007, 33: 1902–1905 (in Chinese with English abstract).
[33] Grispen V M J, Hakvoort H W J, Bliek T, Verkleij J A C, Schat H. Combined expression of themetallothionein MT2b and the heavy metal transporting ATPase HMA4 enhances cadmium tolerance and the root to shoot translocation of cadmium and zinc in tobacco., 2011, 72: 71–76.
[34] 班巧英, 刘桂丰, 王玉成, 张大伟, 蒋丽丽. 一个新的二色补血草金属硫蛋白基因的克隆及其表达分析. 遗传, 2008, 30: 1075–1082. Ban Q Y, Liu G F, Wang Y C, Zhang D W, Jiang L L. Cloning and expression of a novel metallothionein genefrom(Beijing), 2008, 30: 1075–1082 (in Chinese with English abstract).
[35] Zhang J, Zhang M, Tian S, Lu L, Shohag M J I, Yang X. Metallothionein 2 (SaMT2) fromhance confers increased Cd tolerance and acumulation in yeast and tobacco., 2014, 9: e102750.
[36] Roosens N H, Bernard C, Leplae R, Verbruggen N. Evidence for copper homeostasis function of metallothionein (MT3) in the hyperaccumulator., 2004, 577: 9–16.
[37] Zhu G H, Zhang J J, Chen J S, Peng X X. Characterization of a rice metallothionein type 3 gene with different expression profiles under various nitrogen forms., 2008, 52: 668–673.
[38] Hegelund J N, Schiller M, Kichey T, Hansen T H, Pedas P, Husted S, Schjoerring J K. Barley metallothioneins: MT3 and MT4 are localized in the grain aleurone layer and show differential Zinc binding., 2012, 159: 1125–1137.
Cloning and expression analysis of metallothionein family genes in response to heavy metal stress in sugarcane (L.)
GAO Shi-Wu1, FU Zhi-Wei1, CHEN Yun1, LIN Zhao-Li2, XU Li-Ping1, and GUO Jin-Long1,*
1Key Laboratory of Sugarcane Biology and Genetic Breeding (Fujian), Ministry of Agriculture and Rural Affairs / Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China;2Sugarcane and Products Quality Supervisory Inspection and Test Center of Ministry of Agriculture and Rural Affairs / Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China
Metallothioneins (MTs) are cysteine-rich, low-molecular-weight proteins. Plant MTs play important roles in detoxification and cellular redox regulation. In this study, hydroponic experiments of sugarcane (L. cv. Badila) were carried out to study the effects of CdCl2, ZnSO4, and CuCl2treatments on plantlet growth. And then three kinds of heavy metal content in both shoots and roots of sugarcane were detected, showing an enrichment and tolerance ability to Cd2+, Zn2+, and Cu2+in Badila seedlings. Three metallothionein genes, termed as1 (accession number: KJ504373),2-1-5 (accession number: MH191346), and3 (accession number: KJ5043704), were isolated from Badila.1 contained an open reading frame (ORF) of 228 bp encoding 75 amino acids residues. The first (52 bp) and second (176 bp) extrons of1 were separated by an intron (283 bp).2-1-5 contained an ORF of 246 bp encoding 81 amino acids residues. The first (64 bp), second (87 bp), and third (101 bp) extrons ofwere separated by two introns (483 bp and 853 bp).3 contained an ORF of 198 bp encoding 65 amino acids residues. The first (50 bp) and second (148 bp) extrons of3 were separated by an intron (259 bp). The deduce protein ScMT1, ScMT2-1-5, and ScMT3 were categorized into the subfamily of plant type1, type2, and type3 MTs, respectively. The expression profiles of the three genes under different heavy-metal stresses were investigated by real-time quantitative PCR (qRT-PCR) analysis. When treated with Cd2+, the expression of2-1-5 was continuously and significantly up-regulated in both shoots and roots, while that of1 showed a delayed up-regulation pattern. The expression of3 showed a delayed up-regulation pattern in shoots and a trend of first raising and then suppressing in roots. The results suggested that2-1-5 might play a more active role in response to Cd2+in sugarcane while3 might not, and1 is involved in the molecular responses of Cd2+stress at the later stage. When treated with Cu2+, the expression of1 was continuously and significantly up-regulated, and that of2-1-5 and3 general up-regulated in shoots. As in the roots, the expression of both1 and2-1-5 showed a delayed up-regulation pattern which was significantly up-regulated at the later stage, while that of3 significantly up-regulated at the early stage. It revealed that1 cooperated with2-1-5 and3 is involved in the positive response to Cu2+stress in roots, and might play a more positive role than2-1-5 and3, and the three genes are successively involved in the molecular responses of Cu2+stress in roots.When treated with Zn2+, the expression of1 and3 increased only in shoots and roots, respectively. The expression of2-1-5 was up-regulated at the early stage and then suppressed in both shoots and roots. It suggests that1 and3 mainly function in shoots and roots, respectively, when exposed to Zn2+stress.2-1-5 was involved in the molecular responses of Cd2+stress at the early stage.1,2-1-5, and3 showed similar or complementary expression patterns in different tissues of sugarcane when exposed to heavy metals, which revealed the functional diversity of sugarcane MTs in detoxification and cellular redox regulation, and their spatiotemporal coordination in mitigating or even preventing tissue injury caused by excessive heavy metals. The results provide a basic information for further research on mechanisms in the synergistic enhancement of tolerance to heavy metals for MTs family genes in the highly polyploid sugarcane.
sugarcane (L.); metallothionein; heavy metal; real-time qPCR
10.3724/SP.J.1006.2020.84086
本研究由国家自然科学基金项目(31871690)和国家留学基金委留学基金项目(20163035)资助。
This study was supported by the National Natural Science Foundation of China (31871690) and the Foundation for China Scholarship Council (20163035).
郭晋隆, E-mail: jl.guo@163com
E-mail: gaoshiwu2008@126.com
2019-06-10;
2019-09-26;
2019-10-14.
URL: http://kns.cnki.net/kcms/detail/11.1809.s.20191014.1354.008.html
